金樱子总黄酮对大鼠全血黏度和血小板聚集的影响
陈传平,方士英,彭 成,陈乃东
(1.皖西卫生职业学院,安徽 六安237000;2.皖西学院生物与制药工程学院,安徽 六安237012)
金樱子(Rasa Laevigata Michc)系蔷薇科蔷薇属常绿灌木的果实,在我国南方大部分地区均有分布,其中安徽大别山区资源尤为丰富[1],作为一种传统中药,可以治疗神经衰弱、高血压及慢性胃炎等多种疾病[2]。黄酮类化合物广泛存在于植物中,具有多种生理活性,如抗氧化、抗肿瘤、清除自由基、抗血小板凝集等[3]。研究表明,金樱子中所含的黄酮类化合物,具有一定的药理活性[4],但对抗血栓作用研究尚未见报道。本实验初步探讨金樱子总黄酮对大鼠血粘度的影响及抗血小板聚集作用,为进一步研究金樱子药理提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料
金樱子:产地为皖六安市金寨县,采摘于2011年10月,自然晒干。
1.1.2 主要仪器
精密电子天平(XR125SM),瑞士Precisa公司;旋转蒸发器(RE-52),上海青蒲沪西仪器厂;冷冻干燥机(FD-1),北京博医康公司;高效液相色谱(1525),美国 WATERS公司;全自动血液流变仪(SA6000)、血小板聚集测试仪(SC2000),北京赛科希德科技发展有限公司。
1.1.3 主要试剂
复方丹参片,天津飞鹰制药有限公司,批号:20120805;阿司匹林,陕西白鹿制药有限公司,批号:20130223;二磷酸腺苷(ADP)、血小板活化因子(PAF),Sigma公司;其余试剂均为AR。
1.1.4 实验动物
健康Wistar大鼠,雌雄各半,体重200g~250 g,由皖南医学院实验动物研究中心提供,合格证号:医动字第12-2512。
1.2 方法
1.2.1 金樱子总黄酮的制备
金樱子原料→洗净,去籽90℃烘干(48h)→粉碎,过40目筛→石油醚回流脱脂(60℃,2h)→挥干溶媒,置锥形瓶中,加入60%乙醇(v:v),60℃回流提取2.5h,过滤,滤液减压浓缩后冷冻干燥,得金樱子粗黄酮;粗黄酮采用AB-8型大孔吸附树脂精制,得精制金樱子总黄酮(TFR)[5]。
1.2.2 TFR黄酮含量的测定
为了准确测定TFR中黄酮含量,采用HPLCUV测定各组分的峰值比,具体条件为:色谱柱:Hypersil ODS2柱(4.6mm×250mm),检测波长:365nm,流速:1mL/min,柱温为室温,进样量:10 uL,分析时间:26min。
1.2.3 血瘀造模及大鼠全血黏度检测[6]
1.2.3.1 动物分组
大鼠经实验室适应性喂养1周后,随机分为5组:空白对照组、丹参对照组及TFR低、中、高剂量给药组,每组8只,雌雄各半。
1.2.3.2 饲喂药物
分组后正常饲喂,自由饮水。每天下午2点给药组按总黄酮/大鼠体重低(0.06g/kg)、中(0.12g/kg)、高(0.24g/kg)剂量ig不同浓度药物,对照组ig等体积生理盐水,丹参对照组按0.05g/kg剂量ig,连续2周。
1.2.3.3 血黏度检测
第15d早晨按0.006mL/kg剂量在大鼠皮下注射肾上腺素,2h后浸入冰水5min,4h后相同剂量再注射一次,禁食,次日腹主动脉抽血4mL,枸橼酸钠抗凝,用血液流变仪测定全血高切、中切及低切血粘度。
1.2.4 体外抗血小板聚集活性测试[7]
1.2.4.1 实验药物准备
精密称取TFR,用少量60%乙醇溶解,再用生理盐水稀释为浓度为1.2.3.2法溶液,同法配制浓度为10mg/L的阿司匹林溶液为对照组。
1.2.4.2 实验动物准备
正常饲喂大鼠5只,雌雄各半,禁食12h后,各从腹主动脉抽血5mL,共5份,每份用柠檬酸钠混匀抗凝,1 000r/min离心15min,取上清液,为富含血小板血浆 (PRP),余下血液以3 000r/min离心10 min,为贫血小板血浆(PPP)。用PPP调整PRP中血小板浓度为500×109/L左右备用。
1.2.4.3 血小板聚集率测定
在血小板凝集仪中,以PPP为对照,在PRP中分别加入二甲基亚砜(DMSO)作为阴性参照物,各加入上述不同浓度待测液0.5mL,37℃温育3min后分别加入二磷酸腺苷(ADP,终浓度1.05mol/L)、血小板活化因子(PAF,终浓度为0.4mg/L),测定血小板最大聚集率及抑制率,抑制率(%)=(空白组聚集率-给药组聚集率)/空白组聚集率×%。
1.2.5 统计学处理
所有数据用SPSS11.0for Windows数据包处理计量资料,用均数±标准差表示,组间经方差分析和t检验。
2 结果与分析
2.1 金樱子总黄酮含量测定结果
图1为HPLC-UV法测定色谱流出曲线,可看出金樱子总黄酮组分中共含6个特征峰,各峰放大结果见图2。黄酮类化合物在200~400nm左右有连续双峰[8],通过图2可以判断金樱子总黄酮组分中含3个黄酮特征峰(#1、#3和#4),#2、#5和#6不是黄酮。同时计算黄酮峰总面积占总峰面积的74.32%,在进样量和响应值都相同的情况下,峰面积比与含量比等值,即总黄酮含量为74.32%。
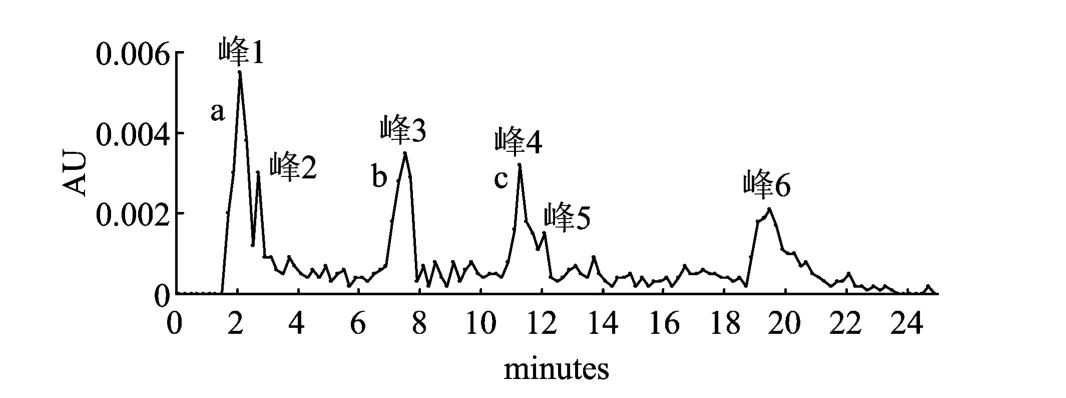
图1 金樱子总黄酮HPLC-UV检测峰结果(365nm)
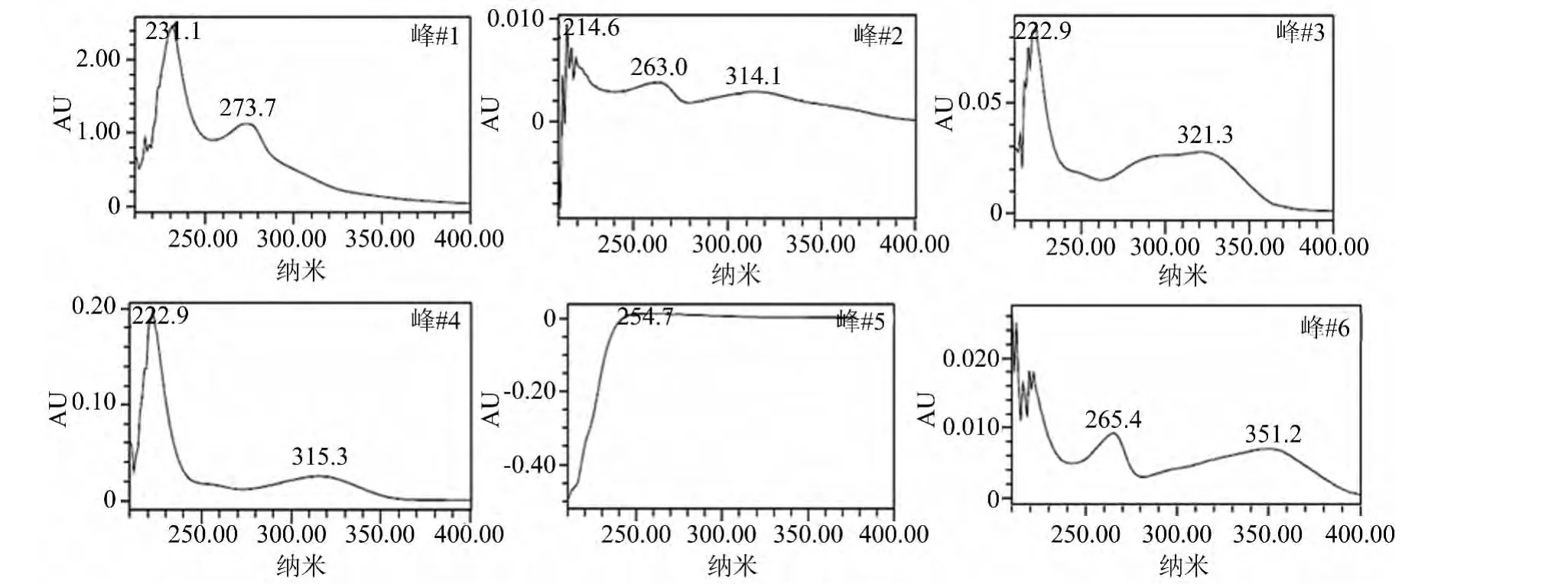
图2 各峰放大结果
2.2 TFR对大鼠全血黏度的影响
大鼠全血黏度检测结果见表1。与空白对照组比较,TFR低剂量组中的全血黏度中、高切没有显著性差异(P>0.05),但丹参组,TFR中、高剂量组全血黏度低、中、高切都有显著性差异(P<0.05或P<0.01),且显著性与TFR有一定的剂量依赖性关系,同时可看出TFR中剂量组(120mg/kg)与丹参组(50mg/kg)对大鼠全血血黏度的改善效果接近,说明TFR对大鼠血黏度有一定的降低作用。
表1 不同处理组大鼠血粘度检测结果(s,n=8)
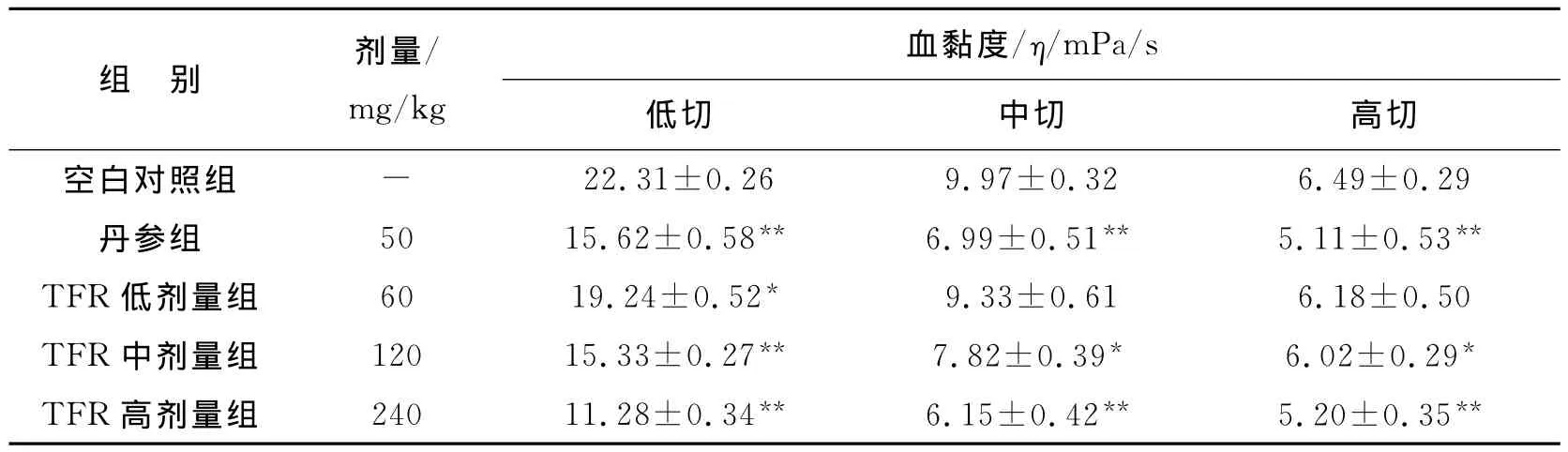
表1 不同处理组大鼠血粘度检测结果(s,n=8)
注:与空白对照组比较 *P<0.05,**P<0.01)
血黏度/η/mPa/s 22.31±0.26 9.97±0.32 6.49±0.29丹参组 50 15.62±0.58** 6.99±0.51** 5.11±0.53**TFR低剂量组 60 19.24±0.52* 9.33±0.61 6.18±0.50 TFR中剂量组 120 15.33±0.27** 7.82±0.39* 6.02±0.29*TFR高剂量组 240 11.28±0.34** 6.15±0.42** 5.20±0.35低切 中切 高切空白对照组组 别 剂量/mg/kg-**
2.3 TFR体外抗血小板聚集活性测试结果
TFR体外抗血小板聚集活性测试结果见表2。TFR低剂量组对ADP诱导的大鼠血小板聚集有一定的抑制作用(P<0.05),但对PAF诱导的血小板聚集抑制作用无显著性差异(P>0.05),阿司匹林及TFR中、高剂量组对由ADP、PAF诱导的大鼠血小板聚集均有明显的抑制作用(P<0.01),且剂量越大,抑制效果越明显。
表2 TFR体外抗血小板聚集活性测试结果(s,n=5)
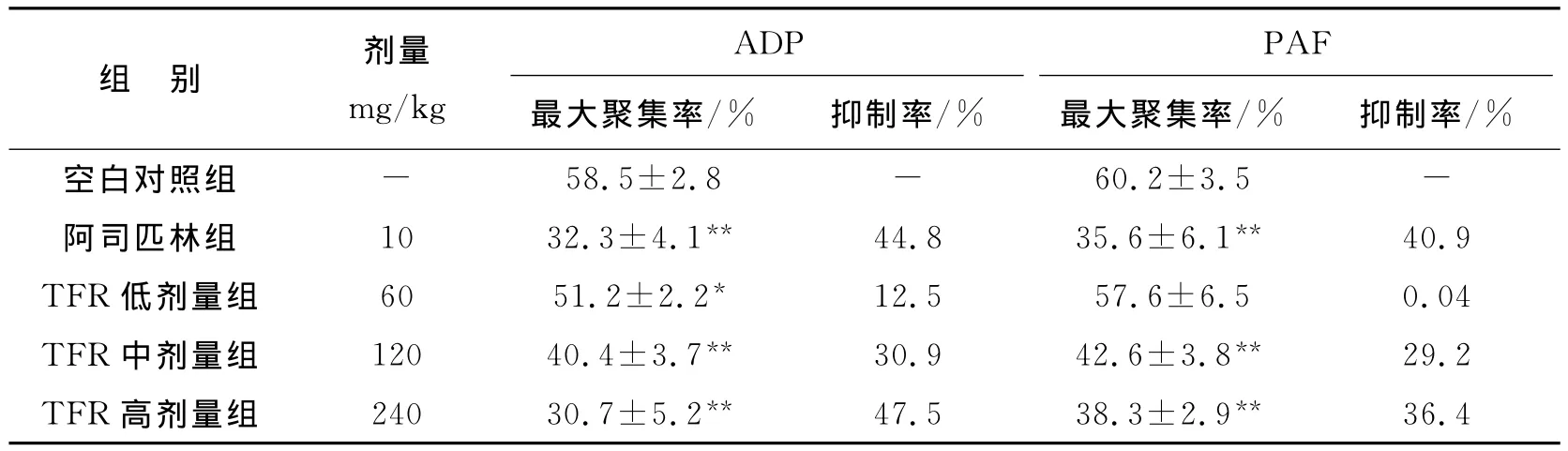
表2 TFR体外抗血小板聚集活性测试结果(s,n=5)
注:与空白对照组比较 *P<0.05,**P<0.01)
组 别 剂量mg/kg ADP PAF最大聚集率/% 抑制率/% 最大聚集率/% 抑制率/%空白对照组-36.4 58.5±2.8 - 60.2±3.5 -阿司匹林组 10 32.3±4.1** 44.8 35.6±6.1** 40.9 TFR低剂量组 60 51.2±2.2* 12.5 57.6±6.5 0.04 TFR中剂量组 120 40.4±3.7** 30.9 42.6±3.8** 29.2 TFR高剂量组 240 30.7±5.2** 47.5 38.3±2.9**
3 讨论
临床研究表明,血液黏度是血液在流动时内摩擦力大小的反应,黏度越大,在血管中流动的阻力就越大,血液流动的速度也就越慢,最终影响微循环及组织、器官的血流量,导致疾病的发生及血栓形成[9]。血液黏度的测定,在缺血性和出血性脑中风的鉴别诊断、疗效观察、预后判断有重要的意义。出血性脑中风时,以全血黏度降低最明显,在缺血性脑中风时,全血黏度升高,是造成缺血性血管病的主要原因。血小板可以和内皮细胞及白细胞一起诱发动脉粥样硬化的形成,并参与动脉粥样硬化晚期并发症的形成[10]。因此,寻找有效的抗血栓药物成为当前研究的热点,因而,近年来关于黄酮类化合物在治疗冠心病、动脉粥样硬化方面的作用研究更加广泛而深入。
药理研究表明,天然来源的黄酮类化合物具有的可通过选择性结合到血小板形成的血栓壁上来发挥抗血栓作用,导致已形成的血小板血栓分离,例如黄酮醇、儿茶素等可降低氧化型LDL-C和减少载脂蛋白有缺陷的大鼠动脉粥样硬化形成;摄取富含花色素的葡萄籽提取液,可减轻服用胆固醇兔的动脉粥样硬化,并且能同时降血清胆固醇酯和主动脉丙二醛水平;黄芩黄素通过抗平滑肌细胞增殖作用而抑制动脉粥样硬化等[11]。从本实验结果看,TFR能够明显地改善急性血瘀模型大鼠全血黏度,在一定程度上能够抑制ADP、PAF诱导的大鼠血小板聚集,初步研究表明,TFR在抑制血栓形成方面有一定的价值。图1表明,总黄酮中主要有3种组分,其活性机制是某种单一组分还是3种组分的协同,本课题组将做进一步探讨。
[1]余宏,陈传平.安徽省大别山山区金樱子资源开发利用现状调查[J].安徽农学通报,2012,18(12):124-124.
[2]闵俊,李燕燕,余华.金樱子的化学成分、药理作用及临床应用研究进展[J].环球中医药,2008(2):16-18.
[3]Huang,W,Ochiai,H.,Zhang,X.Y,et al.Introducing N-glycans into Natural Products through a Chemoenzymatic Approach [J].Carbohyd Res,2008,343(17):2903-2913.
[4]陈传平,彭成,方士英,等.不同提取工艺对金樱子黄酮体外抗氧化活性的影响[J].中国林副特产,2013(6):5-7.
[5]周守标,陈乃东,胡金蓉,等.春花胡枝子黄酮大孔树脂纯化工艺研究及纯化前后抗氧化性变化比较[J].中国实验方剂学杂志,2006,12(12):4-7.
[6]陈民利,寿旗杨,潘永民,等.冠心片对气滞血瘀大鼠抗血小板聚集和保护血管内皮作用[J].中国临床药理学与治疗学,2005,10(5):586-589.
[7]吴兆军,李顺来,丁忠仁,等.N6-烷基-2-烷氧基腺苷化合物的合成及抗血小板凝集活性[J].有机化学,2011,10(31):1618-1623.
[8]张东方,周美环,孟荃,等.HPLC-UV拟合紫外图谱识别黄芩中黄酮有效部位及其含量测定[J].辽宁中医学院学报,2005,3(7):266-267.
[9]Saeed SA,Rasheed H.Calcium Dependent Synergistic Interaction of Platelet Activating Factor and Epinephrine in Human Platelet Aggregation [J].Acta Pharmacol Sin,2003,24(1):30-34.
[10]唐宁.血栓形成及抗组织因子药物研究进展[J].中国老年学杂志,2013,1(33):222-224.
[11]吴兵,陈新,张长春,等.天然产物中黄酮类化合物抗血小板作用研究进展[J].武汉工业学院学报,2010,3(29):53-56.

