响应面法优化皖西粗老绿茶茶多糖提取工艺
何晓梅,沈涛涛,陈壮壮,张 颖
(1.皖西学院生物与制药工程学院,安徽 六安237012;2.植物细胞工程安徽省工程技术研究中心,安徽 六安237012)
皖西地处大别山腹地,是我国重要的江北茶区,境内气候温和,雨量充沛,植被条件良好,森林覆盖率高,土壤多属山地黄棕壤,有机质丰富,结构良好,所产茶叶内含物丰富。名优茶品种繁多,有六安瓜片、霍山黄芽、舒城小兰花、金寨翠眉、霍山菊花茶、小岘春等。而名优茶产量只占茶叶总产量的20%左右,中低档茶叶和粗老茶叶得不到充分利用,造成极大浪费。茶多糖是一类从茶叶中提取出来的多糖类化合物,具有增强免疫力、降血脂、降血糖、抗辐射、抗凝血、抗血栓等功效,具有多种药理作用[1]。据研究,茶叶越粗老,其茶多糖含量越高[2-3]。目前对皖西粗老绿茶茶多糖提取研究未见报道,若能从皖西粗老绿茶中提取茶多糖并制成保健品,对于皖西粗老茶叶的综合利用具有较大的经济价值。
本研究以皖西粗老绿茶为原料,在单因素试验的基础上,采用响应面法进一步优化茶多糖的提取工艺,以期得到最佳提取工艺参数,为皖西茶叶茶多糖的进一步开发利用提供依据和参考。
1 材料与方法
1.1 试验材料
新鲜粗老绿茶,安徽一笑堂茶业有限公司提供。
1.2 仪器与试剂
1.2.1 主要仪器
智能型电热恒温鼓风干燥箱,电子分析天平(1/1000),SHJ-A4水浴磁力搅拌器,RE-2000E 旋转蒸发器,SHB-Ⅲ型台式循环水式多用真空泵,GL-21M大型冷冻离心机,TU-1901紫外可见分光光度计。
1.2.2 主要试剂
葡萄糖标准品、苯酚、浓硫酸,均为国产分析纯,水为二次蒸馏水。
1.2.2.1 葡萄糖标准溶液的配制
精密称取经105℃干燥至恒重的葡萄糖标准品25.00mg,置于25mL容量瓶中,加水溶解并稀释至刻度,摇匀,备用。
1.2.2.2 6%苯酚溶液的配制
取重蒸酚80.00g加蒸馏水20mL溶解,摇匀,置棕色瓶于4℃冰箱保存,临用前用80%苯酚溶液加蒸馏水稀释配制而成。
1.3 试验方法
1.3.1 绿茶茶多糖的浸提
将含有绿茶粉末的滤纸包置于索氏提取器中,用石油醚回流脱脂,晾干。然后准确称取一定质量绿茶粉末于三角烧瓶中,按一定水茶比加入蒸馏水,在一定温度下浸提一定时间,抽滤,离心,测定浸提液中茶多糖含量。
1.3.2 茶多糖提取率计算
采用苯酚—硫酸法制备葡萄糖标准曲线[4]。精密量取葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8mL置于20mL具塞试管中,各加蒸馏水至2.0mL,依次加入6%苯酚溶液1.0mL,浓硫酸5.0mL,摇匀,静置20min后测OD490nm值,制作标准曲线(图1)。由图1得回归曲线方程为:y=15.668x,R2=0.9994。

图1 葡萄糖标准曲线
茶多糖提取率计算:取茶多糖提取液1mL同标准曲线制备操作步骤,测OD490nm值,根据标准曲线回归方程计算样品浓度(C样品)。根据下列公式计算茶多糖提取率(%)。
茶多糖提取率(%)= [(C样品×提取液总体积×换算因子[5])/(茶样质量×103)]×100。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 浸提时间对茶多糖提取率的影响
准确称取5.000g脱脂绿茶粉末,选取水茶比为30∶1,浸提温度为80℃,浸提时间为1h、1.5h、2h、2.5h、3h、3.5h(每个水平进行3组平行实验,以下同),按照1.3.1的方法进行实验,结果如图2。
由图2可知,随着浸提时间的延长,茶多糖提取率呈上升趋势,但增加幅度不大。考虑到浸提时间越长,茶叶中其他水溶性成分越容易扩散出来,另外耗费能源也越多,故选用浸提时间为2h。
2.1.2 浸提温度对茶多糖提取率的影响
准确称取5.000g脱脂绿茶粉末,选取水茶比为30∶1,浸提时间为2h,浸提温度为50℃、60℃、70℃、80℃、90℃,按照1.3.1的方法进行实验,结果如图3。

图2 浸提时间对茶多糖提取率的影响

图3 浸提温度对茶多糖提取率的影响
由图3可知,浸提温度在50~80℃时,随着浸提温度的升高,茶多糖的得率增加明显;超过80℃时,随着温度的升高,茶多糖得率增加幅度减缓。考虑到高温可能会破坏茶多糖的结构,影响其生物活性,故采用浸提温度为80℃。
2.1.3 水茶比对茶多糖提取率的影响
准确称取5.000g脱脂绿茶粉末,选取浸提温度为80℃,浸提时间为2h,水茶比为10∶1、20∶1、30∶1、40∶1、50∶1、60∶1,按照1.3.1的方法进行实验,结果如图4。
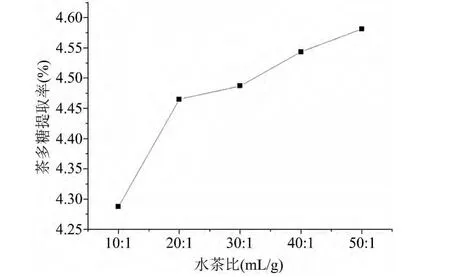
图4 水茶比对茶多糖提取率的影响
由图4可知,随着水茶比的增大,茶多糖提取率逐渐增加,其中水茶比从10∶1增加到20∶1时,茶多糖提取率增加明显。随着水茶比例的增加,提取液过滤、浓缩时间大大增加,考虑到节约时间和成本,故采用水茶比为20∶1。
2.1.4 浸提次数对茶多糖提取率的影响
准确称取5.000g脱脂绿茶粉末,选取浸提温度为80℃,浸提时间为2h,水茶比为20∶1,按照1.3.1的方法进行实验,结果如图5。

图5 浸提次数对茶多糖提取率的影响
由图5可知,随着浸提次数的增加,茶多糖总提取率增加,但第2至第4次浸提液中茶多糖含量都较少,所以在后续优化实验中,只进行一次浸提。
2.2 二次响应面法实验结果与分析
根据Box-Behnken Design试验设计原理,综合单因素实验结果,选取浸提时间、浸提温度、水茶比作为考察因素,浸提液中茶多糖提取率作为因变量,采用Box-Behnken设计三因素三水平的响应面分析[6]。Box-Behnken设计的方案及结果见表1和表2。

表1 Box-Behnken设计实验因素及编码水平
利用Design-Expert软件对表2的试验结果进行分析,得到茶多糖提取率Y与各自变量关系的二次多项回归方程为:Y=4.65+0.14A+0.36B+0.19C-0.067AB-0.037AC+0.091BC-0.15A2-0.18B2+0.056C2
由回归方程的方差分析(表3)可知,实验所选用模型P值为0.0003(P<0.01),极显著。而且 A、B、C、A2、B2各项都表现显著或极显著,说明回归模型具有较好的拟合度,能较好地反映茶多糖的浸提率与各选择因素不同水平之间的量效关系。
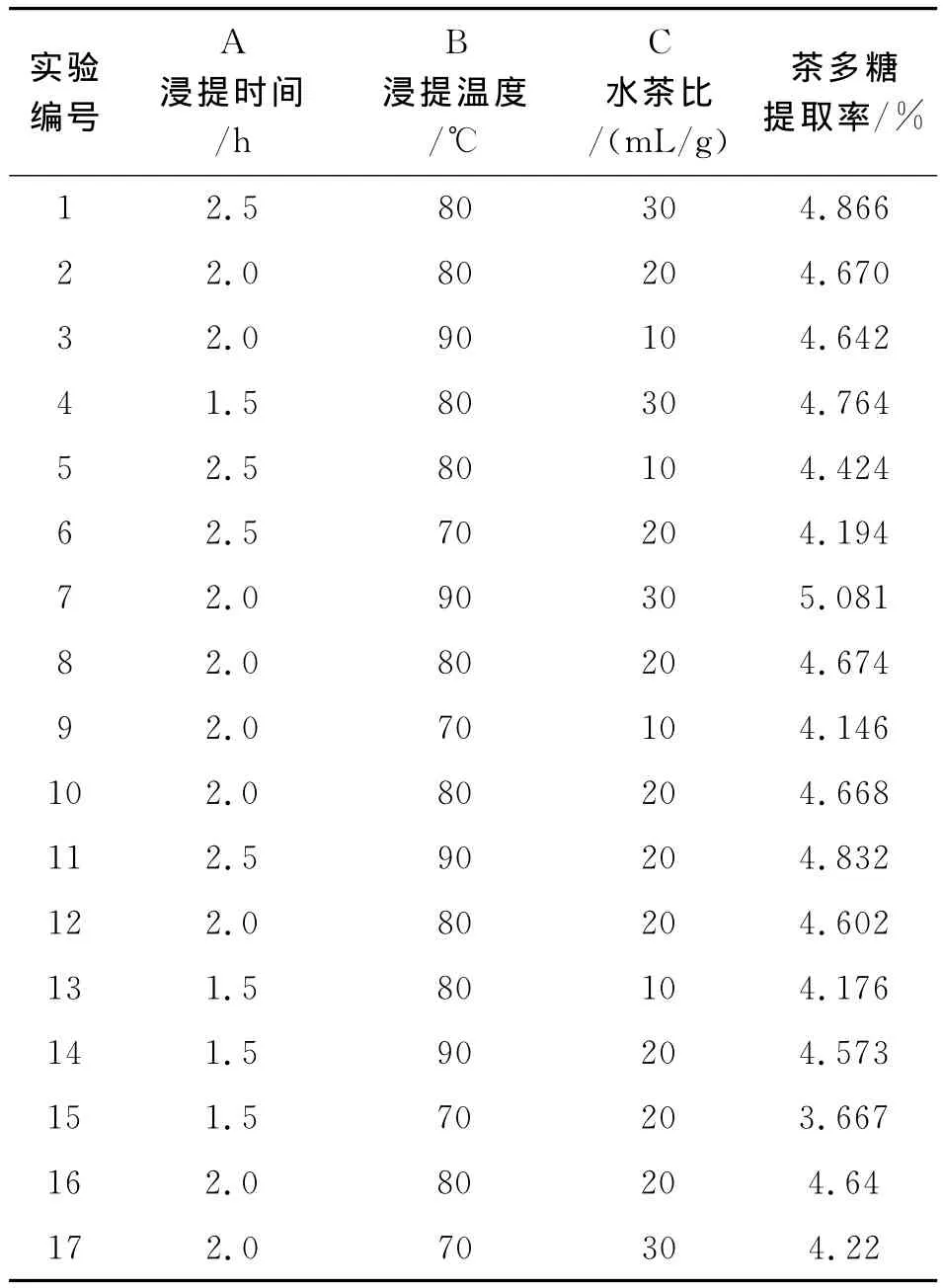
表2 Box-Behnken试验设计与结果
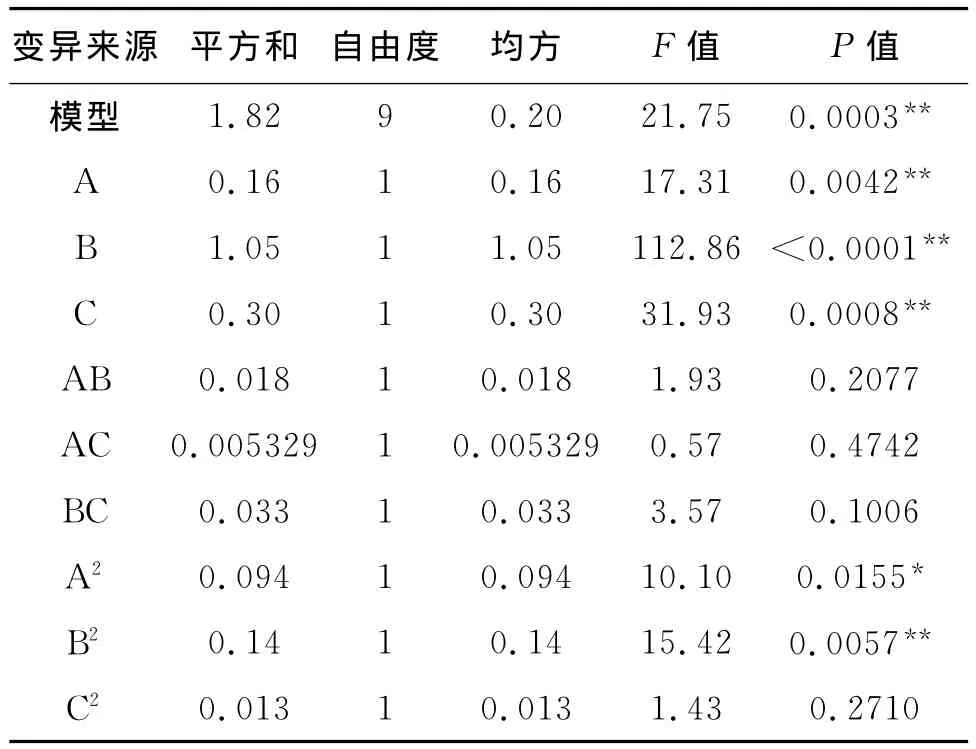
表3 回归方程的方差分析
利用Design-Expert软件对茶多糖得率进行计算机模拟,得到各因素取最优值(浸提时间2.06h、浸提温度90℃、水茶比30∶1)后的响应所能取得的最大值为5.171%,与实验条件(浸提时间2.0h、浸提温度90℃、水茶比30∶1)所得实验值5.081%相差较小,因此Design-Expert软件所得的最优条件可以作为茶多糖浸提的条件。
3 结论
以水为提取溶剂,在单因素实验的基础上,通过响应面实验和Design-Expert分析软件确定茶多糖的最佳浸提条件为浸提时间2.06h、浸提温度90℃、水茶比30∶1、浸提1次,茶多糖最高浸提率为5.171%。
实验所得浸提温度为90℃,与参考文献[7]相比偏高,较高的温度是否影响茶多糖的结构和活性有待进一步研究。
[1]陈义勇,窦祥龙,黄友如,等.响应面法优化超声-微波协同辅助提取茶多糖工艺[J].食品科学,2012,33(4):100-103.
[2]陈建国,胡欣,梅松.茶叶中茶多糖的提取和测定方法[J].中国卫生检验杂志,2004,14(4):432-433.
[3]汪东风,谢晓凤,王泽农,等.粗老茶中的多糖含量及其保健作用[J].茶叶科学,1994,14(1):73-74.
[4]傅博强,谢明勇,聂少平,等.茶叶中多糖含量的测定[J].食品科学,2001,22(11):69-73.
[5]张惟杰.复合多糖生化研究技术[M].上海:上海科技出版社,1987.
[6]Giovinni M.Response Surface Methodology and Product Optimization[J].Food Technology,1982,37(9):41-45.
[7]原龙,范泳,徐文芳.绿茶中提取茶多糖最佳工艺的优化[J].食品工业科技,2010,31(5):255-256.

