新生儿细菌性脑膜炎脑脊液中激活素A表达的临床研究
巴 爽,郝丽红,王 琳,郭 静,林书祥,张宏艳 (1.天津医科大学,天津 300074;.天津市儿童医院新生儿科,天津300074)
BM是新生儿期常见的细菌感染性疾病,是导致新生儿死亡的重要原因之一。目前,此症的病死率逐年下降,后遗症和并发症的发生呈增多趋势,对患儿预后及生活质量产生影响。本文拟通过研究新生儿BM患儿CSF中ACT A的表达情况,探讨其在BM的病程中不同时期的表达规律,研究其在新生儿BM治疗评价及预后中的应用价值。证实其是否可作为BM治疗过程中较早提示预后的指标,减少后遗症和并发症的发生,为BM的治疗提供新的思路。现报告如下。
1 资料与方法
1.1 研究对象:2010年3月~2012年8月在我院新生儿内科住院、依据《实用新生儿学》[1]的诊断标准,确诊为新生儿BM并全程规范治疗的62例患儿,治疗总疗程4周及以上。其中24例CSF培养阳性,分别为大肠埃希菌6例,无乳链球菌4例,溶血葡萄球菌及表皮葡萄球菌各3例,金黄色葡萄球菌及屎肠球菌各2例,星座链球菌、耳葡萄球菌、模仿葡萄球菌及鲁氏不动杆菌各1例。其余38例依据临床表现及CSF指标确诊[1]:白细胞数>20/mm3且中性粒细胞比例>60%,葡萄糖 (GLU)<2.2 mmol/L或低于同期血糖的50%,伴蛋白质 (PRO)增高 (>100 mg/dl)。72例患儿随访12~18个月,依据其是否出现合并症或后遗症分为BM有合并症和后遗症组 (A组)及BM无合并症和后遗症组(B组)。另收集同期住院的非颅内疾病患儿为对照组 (C组),均为有发热、精神差等全身感染症状,怀疑BM,经CSF检查排除诊断者。全部病例入院后均通过头MR排除颅内出血、先天性脑发育畸形,结合动态脑电图结果除外癫痫及缺氧、缺血性脑病。A组:26例,男16例,女10例;胎龄 (39.21±1.74)周,日龄 (18.25±9.87)d,体重(3.35±0.91)kg。在26例患儿中治疗3周后 (包括出院后随访时期)出现硬膜下积液9例 (34.6%),脑积水5例(19.2%),癫痫及精神运动发育迟缓各4例 (各15.4%),神经性耳聋3例 (11.5%),脑积水合并癫痫1例 (3.8%)。B组:36例,男20例,女16例;胎龄 (39.13±2.75)周,日龄 (16.33±9.95)d,体重 (3.17±1.04)kg,治疗期间未出现各种合并症,随访未发现神经系统后遗症。C组:30例,男15例,女15例;胎龄 (39.39±1.67)周,日龄(17.45±10.12)d,体重 (3.28±0.82)kg。三组之间性别(χ2=1.495)、胎龄 (F=0.210)、日龄 (F=0.289)、体重(F=0.293)比较差异无统计学意义 (P值均>0.05)。本研究通过本院伦理委员会伦理通过,儿童家长均知情同意。
1.2 方法
1.2.1 标本采集:三组患儿于入院初在严格无菌操作下进行腰椎穿刺检查,留取CSF 1 ml,放入无致热原试管;A、B两组患儿在治疗过程中每周复查CSF,均留取1 ml。每次留取标本后即置-20℃冷冻保存、待测。
1.2.2 CSF、ACT A及生化指标测定:ACT A采用ELISA法测定,试剂盒购自上海西唐生物科技有限公司,试验步骤按说明书进行。每次检测设空白和标准两孔做双孔检测,于450 nm处测OD值,每孔测定两次,取其平均值,根据样本OD值从标准曲线确定样本的ACT A含量。生化指标 (包括葡萄糖、蛋白质、乳酸、乳酸脱氢酶等)采用瑞士罗氏公司生产的Cobas C 501型全自动生化仪测定。
1.2.3 统计学方法:采用SSPS 17.0统计软件进行数据处理,各组数据以均数±标准差 (±s)表示。多组间比较采用F检验,两组间比较采用独立样本t检验,治疗前后采用配对t检验,治疗前后两组单因素分析采取t检验或χ2检验,P<0.05为差异有统计学意义。对A、B两组各危险因素(治疗前后)分别进行Logistic回归分析,建立回归方程。
2 结果
2.1 A、B两组在不同治疗时期CSF、ACT A水平的比较:结果见表1。
表1 A、B两组间在治疗不同时期CSF中ACT A的比较(ng/L,±s)
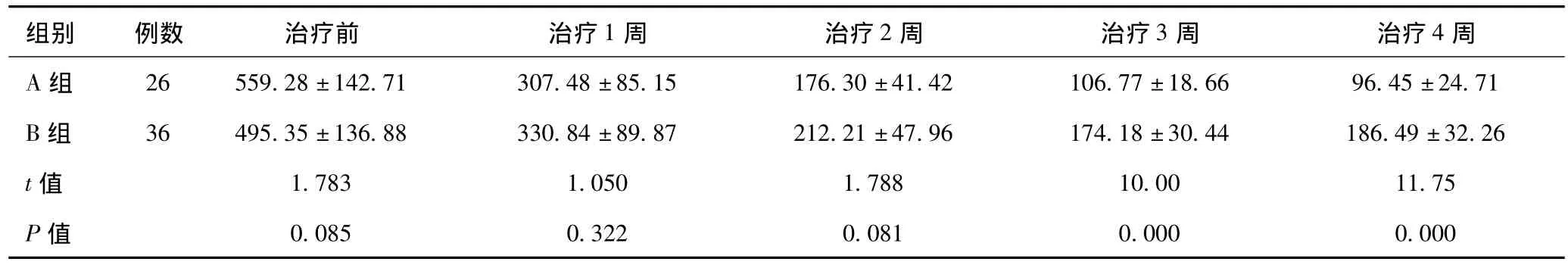
表1 A、B两组间在治疗不同时期CSF中ACT A的比较(ng/L,±s)
组别 例数 治疗前 治疗1周 治疗2周 治疗3周 治疗4周A组 26 559.28±142.71 307.48±85.15 176.30±41.42106.77±18.66 96.45±24.71 B组 36 495.35±136.88 330.84±89.87 212.21±47.96 174.18±30.44 186.49±32.26 t值 1.783 1.050 1.788 10.00 11.75 P值0.085 0.322 0.081 0.000 0.000
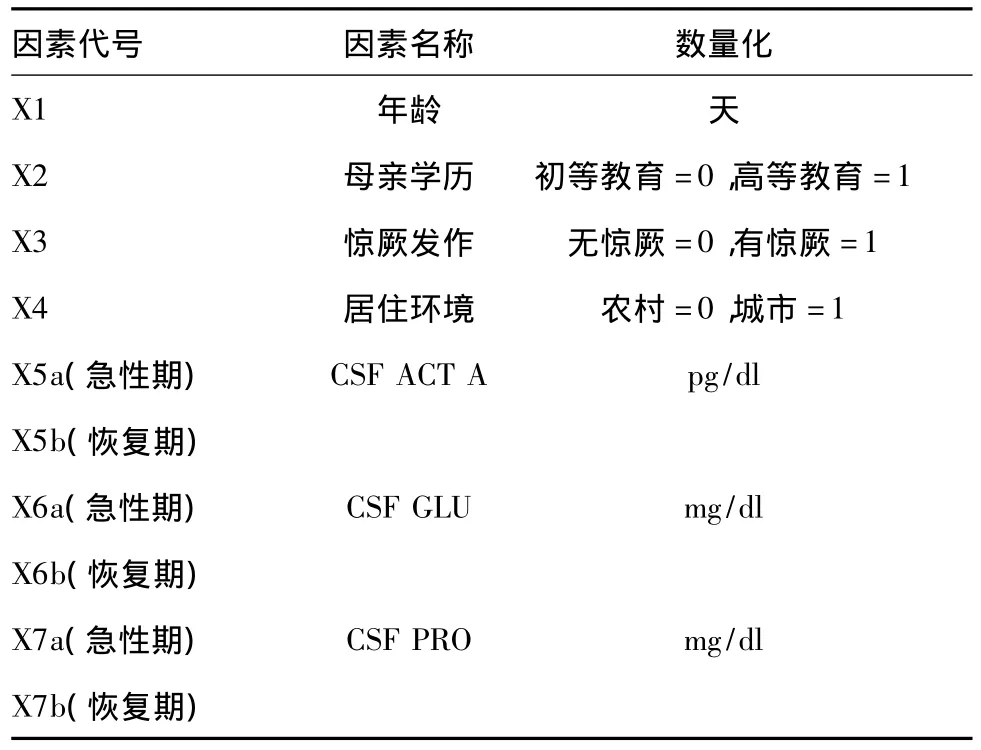
表2 各因素量化表
A、B两组不同阶段分别与治疗前比较,治疗1周(t=9.96,10.32,Pa< 0.05)、治疗 2 周(t=13.92,15.65,Pa<0.05)、治疗3周(t=14.58,14.97,Pa<0.05)、治疗 4 周(t=15.77,14.53,Pa<0.05)。治疗前 3周 A组和 B组 CSF中ACT A水平均较治疗前降低,治疗4周,A组CSF中ACT A水平持续下降,B组CSF中ACT A水平较前有所回升。
2.2 治疗前后A、B两组的单因素分析:见表2。
2.3 A、B两组各因素比较及治疗前后监测指标比较:见表3。
恢复期脑脊液中高水平的ACT A及糖的含量是细菌性脑膜炎发生后遗症的保护因素,而临床惊厥发生、急性期脑脊液蛋白含量增加等是其危险因素。
2.4 A、B两组各危险因素Logistic分析结果:见表4、5。
由表4得出回归方程为:log(P/1-P)=-8.112+(-0.470)×X1+2.392×X3+0.025×X7a
由表5得出回归方程为:log(P/1-P)=16.852+(-0.053)×X5b+(-0.302)×X6b
表3 两组单因素分析(±s)
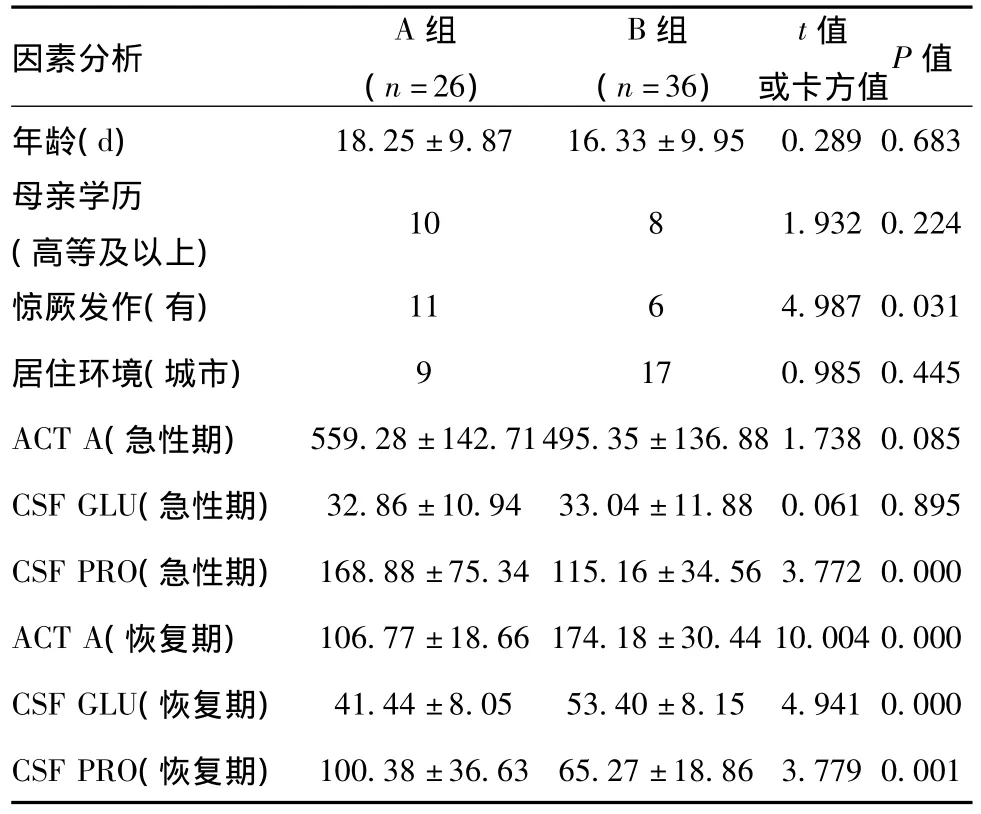
表3 两组单因素分析(±s)
因素分析A组(n=26)B组(n=36)t值或卡方值P 值年龄(d)18.25±9.87 16.33±9.95 0.289 0.683母亲学历(高等及以上)10 8 1.932 0.224惊厥发作(有) 11 6 4.987 0.031居住环境(城市) 9 17 0.985 0.445 ACT A(急性期) 559.28±142.71495.35±136.88 1.738 0.085 CSF GLU(急性期) 32.86±10.94 33.04±11.88 0.061 0.895 CSF PRO(急性期) 168.88±75.34 115.16±34.56 3.772 0.000 ACT A(恢复期) 106.77±18.66 174.18±30.44 10.004 0.000 CSF GLU(恢复期) 41.44±8.05 53.40±8.15 4.941 0.000 CSF PRO(恢复期)100.38±36.63 65.27±18.86 3.779 0.001
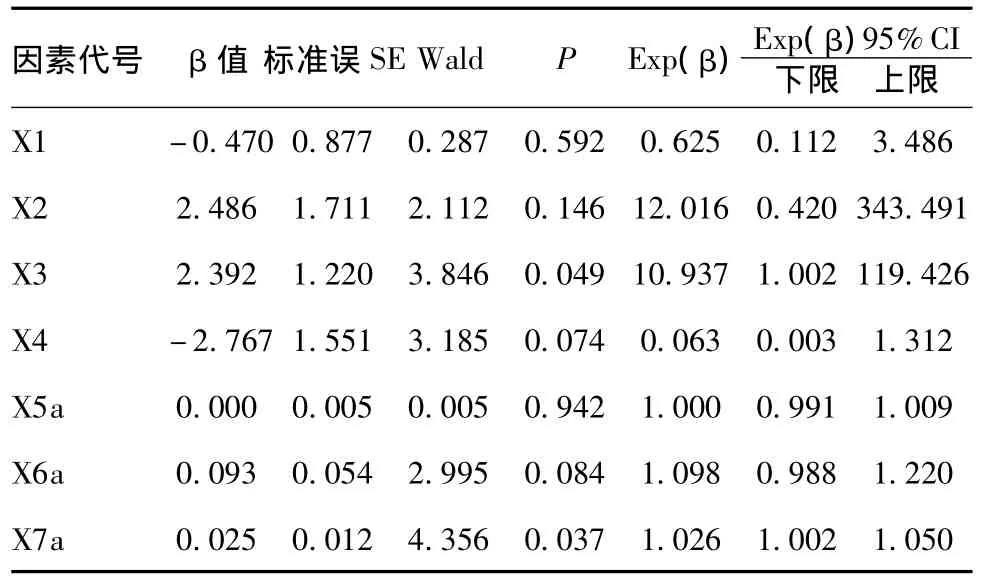
表4 治疗前(急性期)两组各因素Logistic分析
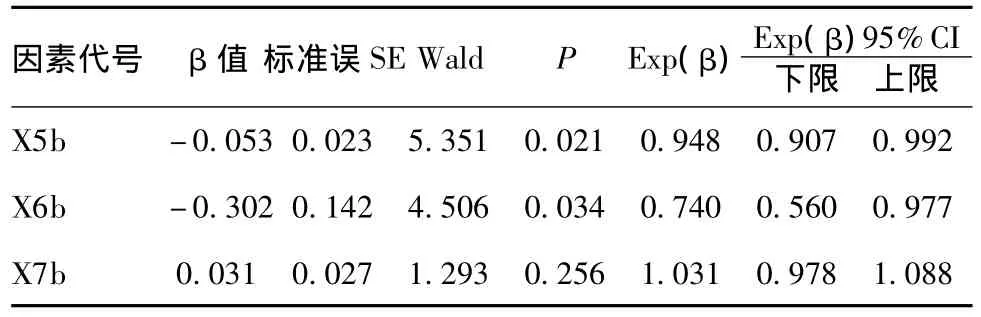
表5 治疗3周后(恢复期)两组各因素Logistic分析
3 讨论
新生儿BM的发病率约占活产新生儿的0.1%,早产儿高达0.3%,经正规治疗后存活者约有40%~50%可遗留神经系统后遗症[1],严重影响患儿日后的生活质量,一旦发生感染性休克等危险情况,则可能严重威胁患儿生命[2]。因此,对于新生儿BM除早期诊断和规范治疗外,还应积极寻找可预测其预后的指标,为治疗提供更多的临床指导。
ACT是近年来发现的一组重要的细胞因子,属于转化生长因子(TGF)β超家族成员[3]。目前对于ACT A的研究较多,ACT A广泛存在于人和其他动物的多个组织器官中,参与调节胚胎发育、形成、红细胞分化、肝实质细胞分化、神经细胞存活等生理过程[3]。ACT A作为一种炎性反应因子,是急性全身炎性反应时体液中最先检测到的细胞因子[4],通过促进巨噬细胞分泌细胞因子,增强巨噬细胞吞噬活性,提高巨噬细胞参与机体固有免疫应答的能力,在机体早期防御中发挥重要的作用[5]。Ebert S等[6]在研究 ACT A 时发现其在健康人群中与年龄呈正相关,年龄越小其水平越低,与性别无关,且在脑膜炎患者的CSF中ACT A的水平明显增高。Wilms H[7]的研究发现在BM患者的CSF中ACT A的含量较病毒性脑炎和健康对照组呈数十倍的增加。本研究也表明,在BM患者治疗前CSF中ACT A的水平明显升高,高于对照组,A、B两组治疗前CSF中ACT A的水平与C组的差异存在统计学意义(P<0.05);而无论是否出现合并症或神经系统后遗症,ACT A在病程急性期的表达水平差异无统计学意义(P>0.05),说明ACT A参与了这种炎症过程。
本研究分别检测了治疗前及治疗1~4周的CSF中ACT A水平,发现在治疗后1周ACT A水平较治疗前明显下降,治疗2周后ACT A水平接近对照组,A、B两组间差异无统计学意义(P>0.05);治疗3周,A、B两组患儿CSF中ACT A水平继续下降,A组明显低于B组,二者差异有统计学意义(P<0.05);治疗4周,A组患儿CSF中ACT A水平持续下降,B组患儿CSF中ACT A水平逐渐上升,二者差异有统计学意义(P<0.05),这表明ACT A在治疗过程中存在积极意义,尤其以治疗恢复期更为重要。研究证实ACT A具有神经保护作用和抗炎活性,有助于CNS神经元的存活及间质细胞的修复[8],在体内及体外均具有神经保护作用,在特定情况下能够诱导神经元分化[9]。因此,在感染早期,CSF中ACT A水平升高很可能是脑组织损伤和修复的内源性机制之一,在恢复期维持正常的ACT A水平,有利于脑损伤的恢复。也有研究显示,ACT A是新生儿围生期脑组织损伤后的生化标志物之一[10],对新生儿缺氧、缺血性脑病的严重程度和估计预后可能有重要作用[11-12]。同时外源性ACT A对缺血性神经损伤具有保护作用,对新生儿CNS的发育及损伤后的修复具有促进作用[13],但关于其在BM预后方面的研究还未见类似报道。本研究表明在新生儿BM的治疗过程中,通过建立Logistic回归方程,综合分析CSF中ACT A水平及其他临床及生化指标,可能对BM预后的评估具有一定的价值。本研究表明,恢复期脑脊液中高水平的ACT A是细菌性脑膜炎发生后遗症的保护因素,可以推断,对于评估判定的BM预后不良的病例,在常规治疗基础上,适时补充外源性ACT A对改善BM预后(减少后遗症和并发症的发生)在理论上成为可能。
总之,动态监测BM患儿CSF中ACTA的水平为判定其预后提供了重要依据,恢复期持续过低的ACT A水平可能与不良的预后有关,因此,外源性ACT A的应用可能会为BM的治疗提供了一种新的思路,也为降低其后遗症带来了希望。
[1] 金汉珍,黄得珉,官希吉.实用新生儿学[M].第3版.北京:人民卫生出版社,2001:351-352.
[2] 杨春晖,施玉麒,彭嘉恒,等.新生儿感染性休克的临床分析[J]. 吉林医学,2013,34(21):4339.
[3] Bilezikjian LM,Blount AL,Donaldson CJ,et al.Pituitary actions of ligands of the TGF-beta family:Activins and inhibins[J].Reproduction,2006,132(2):207.
[4] 霍德胜,柳忠辉,王世瑶,等.激活素A对小鼠巨噬细胞RAW264.7吞噬活性的促进作用[J].中国生物制品学杂志,2008,21(9):759.
[5] 李 楠,柳忠辉,崔雪玲,等.激活素A对小鼠腹腔巨噬细胞分泌细胞因子的影响[J].中国生物制品学杂志,2010,(10):1068.
[6] Ebert S,Phillips DJ,Jenzewski P,et al.Activin A concentrations in human cerebrosp inal fluid are age-dependent and elevated in meningitis[J].Neuro Sci,2006,250(1-2):50.
[7] Wilms H,Schwark T,Brandenburg LO,et al.Regulation of activin A synthesis in microglial cells:pathophysiological implications for bacterial meningitis[J].Neurosci Res,2010,88(1):16.
[8] de Kretser DM,O'Hehir RE,Hardy CL,et al.The roles of activin A and its binding protein,follistatin,in inflammation and tissue repair[J].Mol Cell Endocrinol,2012,359(1-2):101.
[9] Suzuki K,Kobayashi T,Funatsu O,et al.Activin A induces neuronal differentiation and survival via ALK4 in a SMAD-independent manner in a subpopulation of human euroblastomas[J].Biochem Biophys Res Commun,2010,394(3):639.
[10] Florio P,Abella R,Marinoni E,et al.Biochemical markers of perinatal brain damage[J].Front Biosci,2010,2:47.
[11] Florio P,Luisi S,Moataza B,et al.High urinary concentrations of activin A in asphyxiated full-term newborns with moderate or severe hypoxic ischemic encephalopathy[J].Clin Chem,2007,53(3):520.
[12] Florio P,Frigiola A,Battista R,et al.Activin A in asphyxiated full-term newborns with hypoxic ischemic encephalopathy[J].Front Biosci,2010,2:36.
[13] He JT,Mang J,Mei CL,et al.Neuroprotective effects of exogenous activin A on oxygen-glucose deprivation in PC12 cells[J].Molecules,2012,17(1):315.

