腹腔植入缓释氟尿嘧啶预防胃癌术后复发转移的临床研究
罗志光,柯传烽,余树青,余 锋,张富民,何雪玲,黄炯强,雷 建 (.广东省连平县人民医院,广东 连平 5700;.广州医科大学附属第一医院,广东 广州 500)
世界范围内胃癌在常见恶性肿瘤中排名第三位[1];2010年,美国胃癌新发病例估计超过21000例,死亡约10570例[2];在日本,胃癌是男性最常见的肿瘤;超过70%的新发病例和死亡病例发生在发展中国家[3]。2010年卫生统计年鉴显示,2005年,胃癌死亡率占我国恶性肿瘤死亡率的第三位;我国胃癌男女人口调整死亡率分别是欧美发达国家的4.2~7.9倍和3.8~8倍,并且有明显的城乡差异性,农村是城市的1.6倍[4]。由于没有有效的筛查机制,90%胃癌患者就诊时已是进展期胃癌,总体疗效较差,胃癌防治工作任重道远。
1 资料与方法
1.1 一般资料:选取我院2011年12月~2013年9月收治的进展期胃癌患者80例临床资料进行观察和分析,年龄43~78岁,平均(53.9±4.2)岁。组织病理学分型:乳头状腺癌25例,管状腺癌15例,黏膜腺癌10例,黏液细胞癌10例,低分化腺癌5例,未分化癌5例,腺鳞癌3例,鳞癌4例和类癌3例。80例进展期胃癌患者根据是否植入缓释氟尿嘧啶随机分为观察组40例和对照组40例。
1.2 方法:①治疗组:在标准D2胃癌根治性切除术中,在吻合口重建完毕,冲洗腹腔盆腔、吸尽腹腔液体后。根据原发病灶的部位,将总量为800 mg的植入用缓释氟尿嘧啶植入病灶切除区域及腹腔动脉、肠系膜上动脉等血管旁,每一植药点剂量不超过150 mg,各点间距>2 cm。②对照组:在标准D2胃癌根治性切除术中,在吻合口重建完毕冲洗腹腔盆腔、吸尽腹腔液体后,用5-FU 500 mg/m2+生理盐水500 ml冲洗腹腔与盆腔并保留。③随访:每3个月一次血清学标志物检查(CEA、CA199);每6个月一次胃镜镜检查,了解吻合口有无复发,必要时活检;每6个月一次影像学检查CT,了解肝脏、腹盆腔有无复发转移灶,如CEA升高而CT阴性者查PET-CT。
1.3 观察指标:①观察两组胃癌患者血小板、白细胞、血肌酐、谷丙转氨酶情况;②观察两组胃癌患者恶心呕吐、切口感染、腹腔积液情况;③观察两组胃癌患者局部复发率、远处转移率及生存率情况。
1.4 统计学分析:通过统计学软件SPSS 15.0建立数据库,通过t检验和χ2检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组胃癌患者红细胞、白细胞、血肌酐、谷丙转氨酶情况比较:见表1。
表1 两组胃癌患者红细胞、白细胞、血肌酐、谷丙转氨酶情况比较(±s)

表1 两组胃癌患者红细胞、白细胞、血肌酐、谷丙转氨酶情况比较(±s)
组别 例数 PLT(×109)WBC(×109)Cr(μmol/L)ALT(U/L)对照组40 27.5±2.6 8.1±1.5 23.8±10.1 39.6±3.3观察组 40 27.9±2.5 8.3±1.6 25.0±11.0 40.8±3.6 t值 0.61 0.50 0.44 1.35 P值 >0.05 >0.05 >0.05 >0.05
2.2 两组胃癌患者恶心呕吐、切口感染、腹腔积液情况:见表2。

表2 两组胃癌患者恶心呕吐、切口感染、腹腔积液情况[例(%)]
2.3 两组胃癌患者局部复发率、远处转移率及2年生存率情况:见表3。
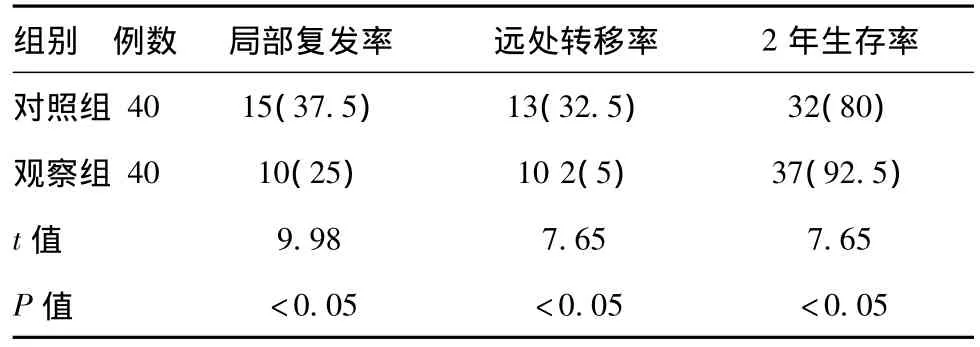
表3 两组胃癌患者局部复发率、远处转移率及2年生存率情况[例(%)]
3 讨论
迄今,胃癌的主要的治疗手段仍为手术切除,但术后5年生存率仅为20% ~50%[5]。造成胃癌患者的主要死亡原因是肿瘤的复发和转移,资料显示胃癌术后局部复发率为30%~50%,肝转移率为 5% ~20%[6],腹膜转移率为 40% ~50%[7]。所以,如何减少胃癌手术后的转移和复发是改善预后的关键。
胃癌术后复发和转移主要包括局部直接浸润、淋巴结转移、脏器转移和腹腔种植转移,主要涉及“种子-土壤”学说[8]和Sugarbaker等提出的“细胞诱陷假说”[9]。术中残留的阳性淋巴结、微小病灶或脱落的癌细胞是肿瘤复发的“种子”,而手术创面是土壤,在纤维蛋白保护,炎性细胞、生长因子等作用及术后机体肿瘤负荷减轻、机体免疫的下降等使癌细胞迅速增殖。在原发肿瘤病灶切除后的24 h内,残留的细胞可发生动力学改变,呈加速增殖的状态[10-11]。术后原发肿瘤血管抑制因子的消失,导致残留微小病灶快速增殖[12]。原发病灶切除后7 d内,隐匿残留癌细胞对腹腔内化疗最敏感,是化疗的最佳时机[13]。理论上讲,由于肿瘤本身的生物学特性,无论外科手术如何规范,也无法达到肿瘤的无残存,胃癌的腹腔化疗就是针对腹腔残存的肿瘤细胞或者微转移灶实施的一种化疗方法。
研究证明[14],腹腔化疗和静脉化疗相比局部化疗的优势主要有:①药物效能浓度时间曲线下的面积(AUC)明显高于静脉给药。②门静脉和肝脏内恒定持久的高浓度抗癌药物可以有效防止胃肠道癌细胞肝转移并对已有的微小癌灶产生杀伤作用。③大容积的腹腔化疗可使药液分布到腹腔各个部位,使其与游离的癌细胞充分接触。④减轻抗癌药物对全身的不良反应。⑤大大提高了机体对抗癌药物的耐受性。⑥化疗药物同时杀灭腹腔内炎性细胞和血小板,减少生长因子的释放,阻断其对肿瘤细胞增殖作用。⑦腹腔化疗对机体的免疫功能影响较小。术中持续温热腹腔内灌注化疗被认为是预防胃癌术后腹膜转移的有效措施[15]。Brigand等[16]认为,温热化疗与手术结合能有效改善胃癌术后腹膜转移患者的预后。
常规的胃癌术后腹腔化疗以温热灌注化疗最常用,通常使用化疗药物水溶剂进行。但由于化疗药物水溶剂的作用时间短,大多需连续多次给药,对于预防使用时显得极不方便。抗肿瘤缓释植入剂解决了这一难题。5-FU是胃癌辅助化疗的有效的核心化疗药,而且腹腔化疗是目前较常使用的胃癌综合治疗的辅助方案,近年来我国自主研制的植入用缓释氟尿嘧啶(商品名:中人氟安)获得广泛重视[17-22];其优点在于:①释药期长,为240 h,作用持久;②经靶位植入后,局部组织浓度高,药物浓度对作用时间之积分AUC是外周血的数十到近千倍,故可大大提高疗效,减轻全身不良反应;③一次性完成植入,操作简单,患者易于接受;④组织内扩散能力强,扩散半径达3~6 cm,提高了药物的接触面积;⑤腹腔相关并发症少,安全性好。为胃癌的治疗提供了一个新的研究方向。
本研究通过比较一种腹腔植入缓释氟尿嘧啶联合标准术后辅助化疗方案,在预防进展期胃癌术后局部复发和远处转移方面,与接受术中氟尿嘧啶注射剂腹腔化疗联合标准术后辅助化疗的患者,具有降低复发转移率和延长无瘤生存时间的优势,同时局部较高的药物浓度不依赖血循环,无需全身药物再分配,由组织液中穿过局部毛细血管壁进入血液的药物很少。已进行的临床试验未观察到与使用该药物明显相关的不良反应和不良反应,而且不干扰患者术后全身辅助治疗的正常进行,具有良好的临床应用前景。
[1] Kamangar F,Dores GM,Anderson WF.Patterns of cancer incidence,mortality,and prevalence across five continents:defining to reduce cancer disparities in different geographic regions of the world[J].J Clin Oncol,2006,24(14):2137.
[2] Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277.
[3] Ahmedin Jemal,Freddie Bray,Melissa MCenter,et al.Global Cancer Statisics[J].CA Cancer J Clin,2011,61(2):134.
[4] 孙秀娣,牧 人,周有尚,等.中国胃癌死亡率20年变化情况分析及其发展趋势预测[J].中华肿瘤杂志,2002,24:101.
[5] Ajani JA.Evolving chemotherapy for advanced gastric cancer[J].Oncologist,2005,10(Suppl 3):49.
[6] 何建苗.胃癌手术后局部灌注化疗预防局部复发和肝转移的临床研究[J].中国普通外科杂志,2005,14(3):165.
[7] 吴 涛.胃癌腹膜转移预测和治疗进展[J].国外医学肿瘤学分册,2005,32(1):61.
[8] Paget S.The distribution of secondary growths in cancer of the breast.1889[J].Cancer Metastasis Rev,1989,8(2):98.
[9] Sugarbaker PH,Cunliffe WJ,Belliveau J,et al.Rationale for integrating early postoperative intraperitoneal chemotherapy into the surgical treatment of gastrointestinal cancer[J].Semin Oncol,1989,16(4 Suppl 6):83.
[10] Bernard Fisher.Influence of the interval between Primary Tumor Removal and Chemotherapy on Kinetics and Growth of Metastasis[J].Cancer Research,1983,43(4):1488.
[11] 范应方.结直肠癌浸润和转移分子机制研究进展[J].中国肿瘤生物治疗杂志,2001,8(3)236.
[12] Li TS,Kaneda Y,Ueda K,et al.The influence of tumor resection on angiostatin levels and tumor growth:an experimental study in tumor-bearing mice[J].Eur J Cancer,2001,37(17):2283.
[13] Sethna KS,Sugarbaker PH.New prospects for the control of peritoneal surface dissemination of gastric cancer using perioperative intraperitoneal chemotherapy[J].Cancer Therapy 2004,2(A):79.
[14] 郝希山,王殿昌.腹部肿瘤学[M].北京:人们卫生出版社,2003:94-96.
[15] 陈志新,张 波.胃癌综合治疗现状及展望[J].中国普外基础与临床杂志,2008,15(1):71.
[16] Brigand C,Arvieux C,Gilly FN,et al.Treatment of peritoneal carcinomatosis in gastric cancer[J].Dig Dis,2004,22(4):366.
[17] 任统伟,王润莲,张 敏,等.植入用缓释氟尿嘧啶治疗胃肠道肿瘤安全性研究[J].肿瘤学杂志,2007,13(4):309.
[18] 朱雯怡,范跃祖,阎 波,等.结肠旁植入氟尿嘧啶缓释剂化疗的药代动力学实验研究[J].中国肿瘤,2007,16(1):63.
[19] 刘华顶,王世亮,武四化,等.术中植入缓释氟尿嘧啶治疗大肠癌临床研究[J].腹部外科,2005,18(3):175.
[20] 储成顶,成 微,王世亮,等.缓释植入剂局部给药治疗系统的药动学模型[J].中国新药杂志,2004,7:613.
[21] 万圣云,刘 弋,张俊舜.缓释剂对直肠癌区域性化疗局部药物浓度的影响[J].安徽医药,2003,7(4):250.
[22] 仇爱峰,施育华.进展期胃癌术中区域性植入氟尿嘧啶缓释剂预防术后复发和转移的临床研究[J].吉林医学,2012,33(31):6778.

