一株在低温条件下产纤维素酶的草生帚霉
王 垚,王玉荣,罗 韵,陈万浩,韩燕峰,梁宗琦
(贵州大学真菌资源研究所,贵州 贵阳 550025)
纤维素酶作为一种重要的酶产品,在造纸行业、纺织工业、饲料行业、食品工业以及秸秆降解等领域都具有广阔的应用前景。自然界中产纤维素酶的生物有很多,细菌、放线菌、真菌和昆虫等都能产生;而目前研究最多是丝状真菌,因为它们具有产酶效率高、便于提取、产酶比例适当等优点[1]。这些产酶真菌又以木霉属 Trichoderma Pers.、曲霉属Aspergillus Link和青霉属 Penicillium Link报道最多;但它们大多存在酶系组分不全、活性不稳定、作用pH范围窄、特别是产酶温度要求高等问题[2],大大限制了它们的应用。低温纤维素酶在自然条件(特别是低温的自然条件)下仍可以高效发挥作用,与中高温酶相比在应用上更具优势和潜力[3]。从自然界扩大产纤维素酶真菌筛选,获得应用范围广的菌株,现已受到人们更多的关注[4-5]。
随着城市化水平和人民生活水平的不断提高,城市生活垃圾产出量与日俱增,由此引发的环境问题也日益突出。我国是农业大国,城市生活垃圾采用堆肥技术,既符合国情,又能达到垃圾无害化、减量化、资源化的目的,前景相当广阔[6]。研究中的大量资料表明[7],纤维素分解作用是堆肥腐熟的关键问题,但天然纤维素分解菌的活性低,降解速度慢;再加上我国北方地区平均气温较低,纤维素降解更受限制。这就需要对产纤维素酶的微生物进行大量筛选,从而获得在自然条件(特别是低温的自然条件)下仍能产生高活性纤维素酶的菌株,以提高堆肥腐熟的效率。
帚霉属 Scopulariopsis是 Bainier于 1907年建立的,其模式种为 S.brevicaulis(Sacc.)Bainier。后来,Manual(1949)指出其产孢细胞为具有环痕的瓶梗,而Hughes(1953)对该产孢细胞进行了更详细的描述:“产孢细胞随着孢子的产生而延长,每次都留下一个疤痕,这种产孢细胞称为环痕梗。”至此,该属的概念才明确。现已知该属的有性阶段为小囊菌属 Microascu Zukal[8]。帚霉属分布广泛,植物种籽、纤维物质、粪、土壤、空气等都可带菌,还能参与纤维素、粪素的分解和腐殖质的形成[9]。所以帚霉也是产纤维素酶的潜在菌种资源。
作者于2013年在进行中国部分地区戴氏霉属Taifanglania Liang et al.真菌资源调查及其对木质纤维素的降解研究时,从陕西合阳县葱的根际土壤中分离到一株真菌E71702M,经形态学结合分子系统学手段鉴定为草生帚霉Scopulariopsis hibernica Mangan。在国内,此菌仅见有名录,而无详细描述记载[10]。经初步试验表明,草生帚霉 S.hibernica E71702M菌株,在较低温度(10℃)条件下亦具有明显的纤维素酶活性。
1 材料与方法
1.1 材料
1.1.1 样品 采集自我国陕西合阳县葱的根际土壤。菌株保存于贵州大学真菌资源研究所。
1.1.2 培养基 马丁氏培养基:磷酸氢二钾1 g,硫酸镁0.5 g,蛋白胨5 g,葡萄糖10 g,琼脂18 g,孟加拉红1/300 mL。用前待温度冷却在40℃ 左右,加入青霉素 20 pg/mg,链霉素 40 pg/mg,水1 000 mL,pH自然。灭菌条件:121℃ 灭菌30 min。(以下灭菌条件与此相同)。
PDA培养基:马铃薯200 g切块,用水煮沸30 min,加葡萄糖 20 g,琼脂 20 g,水补足 1 000 mL,pH自然。
CMC刚果红培养基:羧甲基纤维素钠2 g,硫酸铵2 g,硫酸镁0.5 g,磷酸氢二钾1 g,氯化钠0.5 g,刚果红0.4 g琼脂20 g,蒸馏水1 000 mL,明胶2 g,pH值自然。
1.2 方法
1.2.1 菌株的分离纯化 分离菌株参照文献[11]的方法,称取2 g样品加入盛有20 mL无菌水和玻璃珠的三角瓶中,振荡10 min左右,使土样均匀地分散在无菌水中成为悬液,静置片刻,然后吸取1 mL悬液到含9 mL无菌水的试管中并充分混匀,依次按10倍法稀释,稀释到10-1~10-3倍。吸取1 mL稀释后的悬液于干净无菌的平板上,倒入20 mL左右添加了双抗(链霉素和青霉素)的马丁氏培养基,待冷却后置于25℃ 培养。培养5 d后,在显微镜下进行观察并分离纯化,纯化后转移至PDA斜面保存。
1.2.2 形态鉴定 参照 Bainier[12]和 Morton等人[13]的方法,将菌株 E71702M 接种于 PDA培养基上25℃ 培养,观察记录菌落的大小、质地、颜色、边缘情况等。采用胶带粘片法制片,在 Motic数码显微镜下观察产孢结构特征,记录其菌丝、分生孢子梗、产孢细胞形状大小和分生孢子的形态大小等特征,并选取具典型性状特征的视野拍照。
1.2.3 DNA序列提取和PCR扩增 刮取平板上生长旺盛的菌丝和孢子,经DNA提取后,采用通用引物ITS4 5'-TCCTCCGCTTATTGATATGC-3'和ITS5 5'-GGAAGTAAAAGTCGTAACAAGG-3'进行PCR扩增。
扩增体系选用25 μL反应体系,包括引物ITS4 1 μL,ITS5 1 L,2 × Master Mix 12.5 μL,模板 2 μL,用无菌ddH2O补足25 μL。PCR条件为:94℃ 预变性3 min;94℃ 变性30 s,55℃ 退火30 s,72℃延伸1 min,30个循环;最后72℃延伸5 min。将扩增产物送北京诺赛基因组研究中心有限公司进行测序,得到的序列经校正后提交 GenBank(KJ704846)。
1.2.4 数据处理和系统发育树的构建 在 Gen-Bank上经Blast后,下载与E71702M菌株序列相似性 >80% 的菌株序列共19条,以菌株Scedosporium apiospermum 532F08的ITS1-5.8S-ITS2 rDNA序列为外群,在CLUSTAL X1.83上进行序列比对,手工校正后,用 Mega5.0中的邻接法 (NJ),经1 000次 bootstrap验证,构建系统发育树[14]。
1.2.5 产纤维素酶测定 参照文献[15]的方法,取平板上生长旺盛的菌丝和孢子,点接种于 CMC刚果红平板中,分别置于10℃、17℃、25℃、32℃、40℃ 下恒温培养。每个温度3个重复。
1.2.6 数据分析 采用统计软件SPSS 20.0。
2 结果
2.1 形态鉴定
PDA培养基上,25℃,7 d菌落直径12~14 mm,6周长满整个平板。菌落平展,中部稍有隆起,近粉状,橄榄黑色,易发生角变现象;背面边缘一轮白色,其余黑色。菌丝透明或半透明,无色或淡褐色,光滑,1.5~3 μm。瓶梗3.5 ~20 μm ×1.5 ~3 μm,常单生于气生菌丝上,或在梗基上青霉状排列,环痕区长1~2 μm。梗基显著膨大,6 ~8.5 μm ×2 ~5 μm。分生孢子幼时光滑,随着培养时间的延长会产生疣突,倒卵形、椭圆形至短棒状,4.5~6 μm×2.5 ~4 μm,聚集成长链(图1)。
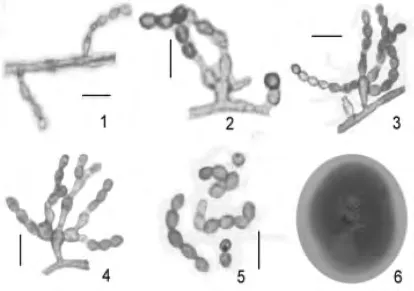
图1 草生帚霉S.hibernica E71702M的产孢结构和菌落特征Fig.1 Conidiogenous structures and colony characteristics of S.hibernica E71702M
草生帚霉Scopulariopsis hibernica Mangan的主要鉴别特征是[16]:梗基显著膨大,瓶梗3.5~22.5 μm,分生孢子倒卵形至短棒状。该种与球孢帚霉S.sphaerospora Zach,雪白帚霉 S.nivea Demelius和黑帚霉S.carbonaria Morton&Smith相似。球孢帚霉和雪白帚霉的分生孢子均为球形,与草生帚霉分生孢子倒卵形至短棒状易于区分。黑帚霉分生孢子卵形,瓶梗 4~8μm,与该种也可明显区分。E71702M菌株除作者在后期可观察到分生孢子具疣突外,同该种形态描述基本一致。
2.2 系统发育分析
NJ法构建的系统发育树显示(图2),这些序列分为2个进化分支。进化分支Ⅰ包含两个属:帚霉属Scopulariopsis Bainier和它的有性阶段——小囊菌属Microascus Zukal,它们以100% 的支持率聚在一起。作者观察研究的菌株 E71702M与S.hibernica的两个菌株以100% 的支持率聚在一个独立的亚分支中,说明它们的关系非常近。进化分支Ⅱ包含毛束霉属Trichurus Clem,矛束霉属Doratomyces Corda和沃德霉属 Wardomyces Brooks&Hansford三个属中的一些种。
结合E71702M的形态学特征和分子系统学分析提供的信息,菌株 E71702M被鉴定为草生帚霉Scopulariopsis hibernica Mangan。

图2 E71702M菌株和相关种基于ITS-5.8Sr DNA序列构建的系统发育树Fig.2 Phylogenetic tree based on the ITS-5.8SrDNA sequences of E71702M and its relatives
2.3 产纤维素酶测定
CMC刚果红平板显示(图3),菌株E71702M在10℃、17℃、25℃ 和32℃ 的温度下均见有纤维素酶活性,而在40℃ 下未见有纤维素酶活性,这很可能是菌株E71702M无法适应高温环境的缘故。

图3 E71702M菌株在不同温度下产纤维素酶情况Fig.3 Cellulase hydrolysis of strain E71702M at different temperatures
对菌株E71702M在不同温度条件下产生的纤维素水解圈的直径进行方差分析,32℃产生的水解圈直径最大,它与其他温度的差异均达到显著水平;17℃ 次之,10℃ 再次之,但二者差异并不显著(P=0.086>0.05);菌株 E71702M 在25℃ 时产生的纤维素水解圈最小。
某种程度上纤维素水解圈的大小,代表了菌株产纤维素酶能力的强弱。上述实验结果(图3和表1)表明,菌株E71702M在32℃ 时产酶能力最强,其次是17℃ 和10℃;在25℃ 下生长情况最好。值得注意的是,菌株E71702M在较低温度(10℃)下产生的纤维素水解圈直径不仅与17℃ 时没有明显差异,而且同32℃ 时产生的最大水解圈相比也只相差15%,说明此菌株具有在低温条件下产纤维素酶的潜力。

表1 不同温度条件下纤维素水解圈直径Tab.1 The diameters of cellulase hydrolysis zone at different temperatures
3 讨论
目前,草生帚霉S.hibernica除耿月华等在《藏东三江峡谷地带土壤暗色丝孢菌研究初报》中提及菌名外[10],该种在国内尚未见详细的描述报道。此外,有关该种产纤维素酶以及其它的应用研究,国内外也未见报道。本文对该种不仅进行了详细的特征描述和分子鉴定,还对它的产纤维素酶能力进行了初步研究。
在进行系统发育分析时,作者发现进化分支Ⅱ的3个属,沃德霉属 Wardomyces是小囊菌属的无性型[17];矛束霉属 Doratomyces与帚霉属具有相同的产孢方式,2个属界限模糊,因而有人认为矛束霉属不过是帚霉属的孢梗束时期,应该把它们划分在1个属内[18];毛束霉属 Trichurus与头束霉 Cephalotrichum Link联系紧密[19]。小囊菌属的无性型还有头束霉 Cephalotrichum[17],所以进化分支Ⅱ的3个属与帚霉属的亲缘关系也较密切,这从整个系统发育关系支持了菌株E71702M鉴定为S.hibernica的合理性。
菌株E71702M在25℃ 下生长情况最好,是典型的中温微生物,但具有在较低温度下(10℃)产纤维素酶的潜力。低温酶并非只来自低温微生物,有报道从腐殖质土样中分离得到的1株中温纤维弧菌,在0℃ 时的残留酶活力仍为最大酶活的60%,属于典型的低温酶[3]。
秸秆中含有大量的纤维素,在高温堆腐条件下,较易腐解。而秸秆的应用难题在于农田秸秆大规模的降解,其腐解温度低,需要筛选常温或低温条件下能够产生高活性的纤维素酶菌株加快秸秆腐熟[2]。目前报道的产纤维素酶菌株对其产酶温度的研究大多都在25℃ 以上[20-21],不利于在田间低温条件下发挥作用,为此,低温纤维素酶的研究已成为国内研究的热点[5]。此外,冬季城市垃圾的处理也急需寻找低温产纤维素酶的菌种。本文报道的菌株E71702M 在10℃、17℃、25℃ 和32℃ 的温度下均有纤维素酶活性,是1株值得关注的具有产生低温纤维素酶潜力的菌株。
[1]罗晓妙,王 英.纤维素酶的生产及其在食品工业中的应用[J].中国食品添加剂,2003(6):90-92.
[2]刘 爽,范丙全.秸秆纤维素降解真菌 QSH3-3的筛选及其特性研究[J].植物营养与肥料学报,2012,18(1):218-226.
[3]董 硕,迟乃玉,王 鑫,等.低温纤维素酶的研究进展[J].生物技术通报,2011,2:37-41.
[4]JUWAIED A A,ADNAN S,A L-AMIERY A A H H.Production cellulase by different co-culture of Aspergillus niger and Tricoderma viride from waste paper[J].Journal of Yeast and Fungal Research,2010,1(6):108-111.
[5]穆春雷,武晓森,李术娜,等.低温产纤维素酶菌株的筛选,鉴定及纤维素酶学性质[J].微生物学通报,2013,40(7):1 193-1 201.
[6]吴香尧.城市生活垃圾堆肥化处理的现状问题及解决途径初探[J].成都理工学院学报,1999,26(3):211-216.
[7]杨朝晖,曾光明,袁兴中,等.微生物选育技术在生活垃圾堆肥处理中的应用[J].环境卫生工程,2003,11(3):115-118.
[8]张悦丽.中国中南部亚热带及热带地区土壤暗色丝孢菌分类研究[D].泰安:山东农业大学,2007.
[9]姜成林,徐丽华,陈庆涛.帚霉属的一个新种[J].菌物学报,1985,4(3):167-170.
[10]耿月华,张天宇,王洪凤.藏东三江峡谷地带土壤暗色丝孢菌研究初报[J].菌物学报,2008,27(1):39-47.
[11]ZHANG Y W,HAN Y F,LIANG J D.et al.A new species of the genus Chrysosporium from the rhizosphere soil of palm[J].Mycosystema,2013,32(4):612-616.
[12]BAINIER G.Mycothèque de l'école de pharmacie XI.Paecilomyces,genre nouveau de mucédinées[J].Bull.Soc.Mycol.Fr,1907,23:26-27.
[13]MORTON F J,SMITH G.The genera Scopulariopsis Bainier,Microascus Zukal,and Doratomyces Corda[M].Kew:Commonwealth Mycological Institute,1963.
[14]TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular biology and evolution,2011,28(10):2 731-2 739.
[15]岳耀峰,黄晓艳,龚明福.纤维素分解菌筛选方法初步研究[J].安徽农业科学,2010,38(4):1 667-1 668,1 779.
[16]MANGAN A.Scopulariopsis hibernica sp.nov.[J].Transactions of the British Mycological Society,1965,48(4):617-620.
[17]李 静,孙 琴,赵筱萌,等.中国小囊菌科的研究[J].菌物研究,2012,10(1):13-19.
[18]BARRON G L.The genera of Hyphomycetes from soil[M].Baltimore:The Williams & Wilkins Co.1968,1-364.
[19]耿月华,张 猛.头束霉Cephalotrichum Link分子系统学分析[C]//2012年中国菌物学会学术年会会议摘要,2012.
[20]王希国,杨 谦,燕 红,等.梅林青霉液态发酵生产纤维素酶条件的研究[J].农业环境科学学报,2007,26(B03):97-100.
[21]王仪明,张宗舟,蔺海明,等.绿色木霉固态发酵产纤维素酶活力的研究[J].草业科学,2009,26(5):123-127.

