PPAR-γ对人鼻咽癌CNE1/DDP细胞顺铂耐药性的逆转作用及其机制探讨
陈 磊,郑树艳,黄永望
(1天津医科大学第二医院,天津300211;2天津市咸水沽医院)
鼻咽癌是我国南方的常见癌症之一,抗肿瘤药物耐药性的产生是其临床治疗失败的重要原因[1],主要与耐药基因导致细胞药物蓄积降低和肿瘤细胞抗凋亡能力提高有关[2~4]。多重耐药基因 1(MDR1)及其产物P-糖蛋白(P-gp)、多药耐药相关蛋白(MRP)和B淋巴细胞瘤-2基因(bcl-2)的表达增高,以及磷酸化Akt蛋白(p-Akt)过度活化都可以导致耐药性增加。氧化物酶体增殖物激活受体-γ(PPAR-γ)是一种Ⅱ型核受体,被认为是一种抑癌基因,可促进细胞凋亡、抑制肿瘤转移[5]。罗格列酮属于噻唑烷二酮类抗糖尿病药物,也是细胞PPAR-γ激动剂。2013年4月~2014年2月,我们利用罗格列酮激活人鼻咽癌CNE1/DDP细胞的PPAR-γ活性,观察PPAR-γ对细胞顺铂耐药性的逆转作用,并探讨其机制。
1 材料与方法
1.1 材料 人鼻咽癌细胞系CNE1购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所,人鼻咽癌顺铂耐药细胞系CNE1/DDP为本实验室通过大剂量冲击法构建。罗格列酮购自浙江万马公司,顺铂购自Sigma公司,MTS试剂盒和RT-PCR试剂盒购自Promega公司,凋亡检测试剂盒购自BD公司,Western抗体购自Santa Cruz公司。
1.2 方法
1.2.1 细胞培养及分组处理 CNE1/DDP细胞用含10%胎牛血清(FBS)的DMEM培养基,于37℃、5%CO2、饱和湿度培养箱中培养,含0.25%胰酶-EDTA消化。取对数生长期的CNE1/DDP细胞,接种后培养过夜。将细胞随机分为观察组和对照组,观察组分别加入10、20 μg/mL罗格列酮,对照组加入等体积培养液。
1.2.2 细胞耐药性逆转率检测 采用MTS法。两组作用72 h 后,均分别加入 0、1、2、5、10、20、50、100 μmol/L顺铂,培养72 h;吸去培养基,加入MTS培养4 h后,酶标仪检测490 nm波长下的每孔吸光度(OD值)。细胞抑制率 =(1-OD观察组/OD对照组)×100%,根据不同浓度顺铂作用后的细胞抑制率计算IC50,细胞耐药逆转率 =观察组 IC50/对照组 IC50×100%。
1.2.3 细胞凋亡和P-gp表达检测 采用流式细胞术。两组作用24 h后,均加入20 μmol/L顺铂,培养24 h。Anexin V/PI染色后避光孵育15 min,以流式细胞仪检测细胞凋亡,FACSDiva软件计算细胞凋亡率。两组以上述方法加入顺铂并培养后,加入PE-P-gp抗体,避光孵育30 min。流式细胞仪检测细胞P-gp表达,P-gp阳性表达为细胞膜与PE-P-gp抗体相结合,通过488 nm激发后呈红色;FACSDiva流式软件计算P-gp阳性率。
1.2.4 细胞 PPAR-γ、MDR1、MRP、bcl-2 和 p-Akt蛋白表达检测 采用Western blot法。两组作用24 h,收集细胞,裂解并提取总蛋白。以12%SDSPAGE法分离并转移至PVDF膜上,5%脱脂奶粉室温封闭1 h;分别加入PPAR-γ一抗,以β-actin作为内参;4℃孵育过夜,洗去一抗,以HRP连接的山羊抗兔IgG室温孵育1 h,洗涤后显示免疫反应条带。以目的蛋白与β-actin条带的比值表示其相对表达量。以同样的方法检测MDR1、MRP、bcl-2和p-Akt蛋白表达。
1.2.5 细胞 PPAR-γ、MDR1、MRP、bcl-2 mRNA 表达检测 采用RT-PCR法。两组作用24 h后,Trizol法提取总RNA,逆转录得到cDNA。PPAR-γ上游引物:5'-ACTGTCGGTTTCAGAAGTGC-3',下游引物:5'-ATGGACACCATACTTGAGC-3';MDR1上游引物:5'-TGACATTTATTCAAAGTTAAAAGC-3',下游引物:5'-TAGACACTTTATGCAAACATTTCAA-3';MRP上游引物:5'-GGGGGAGAAAAGGTCGGCATCG-3',下游引物:5'-GTGCAGGCCGATCTTGGCGA-3';bcl-2上游引物:5'-ACGGGGTGAACTGGGGGAGGA-3',下游引物:5'-TGTTTGGGGCAGGCATGTTGACTT-3'。以GADPH为内参,上游引物:5'-GGGAGCCAAAAGGGTCATCATCTC-3',下游引物:5'-CCATGCCAGTGAGCTTCCCGTTC-3'。反应条件:95 ℃、10 s,65 ℃、30 s,72℃、60 s,40个循环后72℃延伸5 min。目的基因相对表达以 2-ΔΔCT表示。
1.2.6 统计学方法 采用SPSS11.0统计软件。实验数据以±s表示,采用单因素方差分析(One-way ANOVA)进行比较。P≤0.05为差异有统计学意义。
2 结果
2.1 两组细胞耐药逆转率、细胞凋亡率及P-gp阳性率比较 见表1。
表1 两组细胞耐药逆转率、细胞凋亡率及 P-gp阳性率比较(%,±s)

表1 两组细胞耐药逆转率、细胞凋亡率及 P-gp阳性率比较(%,±s)
注:与对照组比较,*P <0.05;与观察组10 μg/mL 比较,△P <0.05
组别 细胞耐药逆转率 细胞凋亡率 P-gp阳性率100.0 2.2 ±0.3 100.0观察组10 μg/mL 149.3 ±11.3* 28.7 ±2.1* 62.5 ±4.2*20 μg/mL 293.8 ±25.5*△ 43.5 ±3.7*△ 27.5 ±1.6*△对照组
2.2 两组 PPAR-γ、MDR1、MRP、bcl-2 和 p-Akt蛋白相对表达量比较 见表2。
2.3 两组 PPAR-γ、MDR1、MRP、bcl-2 mRNA 相对表达量比较 见表3。
3 讨论
铂类药物虽然对鼻咽癌有一定治疗效果,但易产生耐药性而导致治疗失败。肿瘤细胞产生耐药性的常见机制有两种:①MDR1、MRP1等耐药基因过表达,这些基因编码的蛋白可跨膜转运将药物泵出细胞,降低细胞内药物蓄积;②抗凋亡基因过表达导致细胞抗凋亡,细胞凋亡减少。PPAR-γ属于PPARs家族的一员,在肿瘤组织中低表达。研究发现,诱导PPAR-γ活化可阻滞肿瘤细胞生长并诱导其凋亡,但是PPAR-γ在肿瘤耐药中的作用研究较少。本研究中,我们将CNE1/DDP细胞经PPAR-γ激动剂罗格列酮处理24 h后,细胞中PPAR-γ mRNA和蛋白表达提高,CNE1/DDP细胞对顺铂的敏感性显著增强。
表2 两组 PPAR-γ、MDR1、MRP、bcl-2和 p-Akt蛋白相对表达量比较(±s)
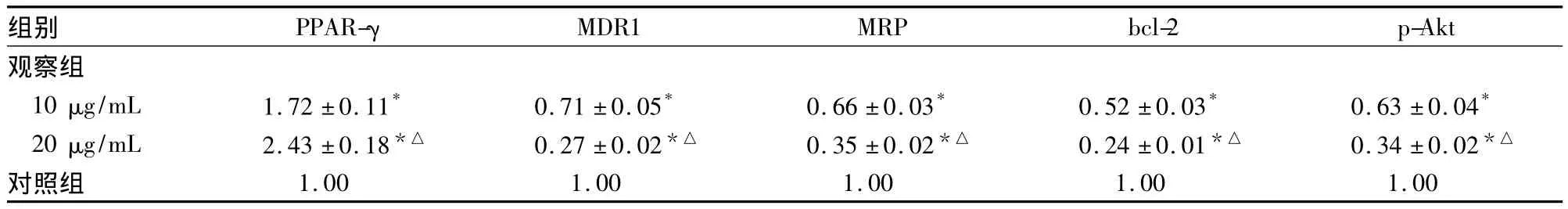
表2 两组 PPAR-γ、MDR1、MRP、bcl-2和 p-Akt蛋白相对表达量比较(±s)
注:与对照组比较,*P <0.05;与观察组10 μg/mL 比较,△P <0.05
组别 PPAR-γMDR1 MRP bcl-2 p-Akt观察组10 μg/mL 1.72 ±0.11* 0.71 ±0.05* 0.66 ±0.03* 0.52 ±0.03* 0.63 ±0.04*20 μg/mL 2.43 ±0.18*△ 0.27 ±0.02*△ 0.35 ±0.02*△ 0.24 ±0.01*△ 0.34 ±0.02*△对照组1.00 1.00 1.00 1.00 1.00
表3 两组 PPAR-γ、MDR1、MRP、bcl-2 mRNA相对表达量比较(±s)

表3 两组 PPAR-γ、MDR1、MRP、bcl-2 mRNA相对表达量比较(±s)
注:与对照组比较,*P <0.05;与观察组10 μg/mL 比较,△P <0.05
组别 PPAR-γmRNA MDR1 mRNAMRP mRNAbcl-2 mRNA 100.0 100.0 100.0 100.0观察组10 μg/mL 182.3 ±16.5* 64.7 ±5.3* 71.7 ±5.4* 52.8 ±4.1*20 μg/mL 232.4 ±21.7*△ 12.2 ±0.9*△ 38.5 ±2.1*△ 17.6 ±1.1*△对照组
MDR1基因及其产物P-gp嵌于细胞膜表面形成具有外排功能的能量依赖性“药泵”,具有逆向转运脂质等功能,将细胞内带阳性电荷的亲脂类化疗药物逆浓度泵至细胞外,防止内源性或外源性脂溶性有毒物质在胞内积聚对细胞造成毒性损害,保持细胞内环境的稳定;但其表达增高使细胞内化疗药物达不到有效作用浓度,是肿瘤耐药的原因之一。MRP可与谷胱甘肽结合将阴离子的共轭物排泄出细胞,在清除外源性毒素中发挥作用。在人体正常组织中普遍呈低水平表达,在肿瘤组织中的表达明显高于正常组织中,也被认为与肿瘤耐药密切相关。本研究结果表明,罗格列酮作用后细胞MDR1、MRP mRNA和蛋白表达降低,说明PPAR-γ逆转CNE1/DDP耐药性的机制可能与其抑制耐药基因MDR1、MRP的表达有关。Akt在多种肿瘤组织中都有过度表达和活化的现象,化疗药物可增加Akt磷酸化水平,在肿瘤耐药中主要发挥促进细胞增殖和抗细胞凋亡作用,使肿瘤细胞产生化疗耐受[13]。本研究发现,PPAR-γ表达增加可使细胞中p-Akt水平降低,说明抑制Akt磷酸化也是PPAR-γ逆转鼻咽癌细胞顺铂耐药性的机制之一。
bcl-2基因是重要的抗凋亡调控基因,其表达和调控是影响细胞凋亡的关键环节。bcl-2基因表达增加,抗凋亡作用增强,细胞凋亡受到抑制,从而导致耐药。研究发现,肿瘤的多药耐药与bcl-2基因表达密切相关,可能与其抑制肿瘤细胞凋亡有关[6~12]。同时bcl-2 mRNA和蛋白表达降低并促进细胞凋亡,且呈剂量依赖性。本研究中,PPAR-γ表达增加使bcl-2 mRNA和蛋白表达降低,同时流式细胞术显示,肿瘤细胞凋亡率明显增加。
PPAR-γ对CNE1/DDP细胞的顺铂耐药性具有逆转作用,且呈剂量依赖性;可能与其抑制Akt磷酸化和耐药基因MDR1、MRP表达,并促进细胞凋亡有关。
[1]Zuo Q,Shi M,Li L,et al.Development of cetuximab-resistant human nasopharyngeal carcinoma cell lines and mechanisms of drug resistance[J].Biomed Pharmacother,2010,64(8):550-558.
[2]Zhang KG,Qin CY,Wang HQ,et al.The effect of TRAIL on the expression of multidrug resistant genes MDR1,LRP and GST-π in drug-resistant gastric cancer cell SGC7901/VCR[J].Hepatogastroenterology,2012,59(120):2672-2676.
[3]律洁,田玉峰.抑制Src酪氨酸激酶活性对人肺癌A549/DDP细胞耐药性及MDR1和LRP表达的影响[J].中国肺癌杂志,2012,15(9):501-506.
[4]江青山,邓文蓉,肖桃源,等.SAA在鼻咽癌 CNE-2细胞中的表达及其对细胞生长、凋亡的影响[J].山东医药,2013,53(45):1-4.
[5]Reka AK,Goswami MT,Krishnapuram R,et al.Molecular cross-regulation between PPAR-γ and other signaling pathways:Implications for lung cancer therapy[J].Lung Cancer,2011,72(2):154-159.
[6]Zhu Y,Liu XJ,Yang P,et al.Alkylglyceronephosphate synthase(AGPS)alters lipid signaling pathways and supports chemotherapy resistance of glioma and hepatic carcinoma cell lines[J].Asian Pac J Cancer Prev,2014,15(7):3219-3126.
[7]Chen J,Ding Z,Peng Y,et al.HIF-1α inhibition reverses multidrug resistance in colon cancer cells via downregulation of MDR1/P-glycoprotein[J].PLoS One,2014,9(6):e98882.
[8]Sezgin Alikanoglu A,Yildirim M,Suren D,et al.Expression of cyclooxygenase-2 and Bcl-2 in breast cancer and their relationship with triple-negative disease[J].J BUON,2014,19(2):430-434.
[9]Qiang F,Guangguo R,Yongtao H,et al.Multidrug resistance in primary tumors and metastases in patients with esophageal squamous cell carcinoma[J].Pathol Oncol Res,2013,19(4):641-648.
[10]Shityakov S,Förster C.Multidrug resistance protein P-gp interaction with nanoparticles(fullerenes and carbon nanotube)to assess their drug delivery potential:a theoretical molecular docking study[J].Int J Comput Biol Drug Des,2013,6(4):343-357.
[11]Guo Q,Nan XX,Yang JR,et al.Triptolide inhibits the multidrug resistance in prostate cancer cells via the downregulation of MDR1 expression[J].Neoplasma,2013,60(6):598-604.
[12]Munic'V,Kelneric'Z,Mikac L,et al.Differences in assessment of macrolide interaction with human MDR1(ABCB1,P-gp)using rhodamine-123 efflux,ATPase activity and cellular accumulation assays[J].Eur J Pharm Sci,2010,41(1):86-95.
[13]Yang M,Huang J,Pan HZ,et al.Triptolide overcomes dexamethasone resistance and enhanced PS-341-induced apoptosis via PI3k/Akt/NF-kappaB pathways in human multiple myeloma cells[J].Int J Mol Med,2008,22(4):489-496.

