血府逐瘀汤、天麻钩藤饮、温胆汤对自发性高血压大鼠心肌组织MAPK信号通路的影响
张国华,杨 光,赵想玲
(1南方医科大学中医药学院,广州 510515;2南方医科大学药学院)
丝裂原活化蛋白激酶(MAPK)信号通路是生物体内重要的信号转导系统之一,其参与介导细胞生长、发育、分裂和分化等多种生理及病理过程[1~3]。MAPK信号途径作为各种肥厚刺激因子在细胞内信号传递的共同通路,在多种致肥大因子介导的心肌细胞反应中起关键作用[4,5]。在哺乳动物细胞中,MAPK亚族主要包括ERK1/2、c-Jun氨基末端激酶(JNK)、p38丝裂原活化蛋白激酶(p38MAPK)、细胞外信号调节激酶5(ERK5),它们对细胞增殖、分化、转化及凋亡有重要作用,这几条通路之间存在相互“对话”,参与心肌细胞肥大反应,与心肌肥厚、心肌纤维化密切相关[6]。血府逐瘀汤、天麻钩藤饮、温胆汤分别为平肝潜阳、理气化瘀、活血化瘀的代表方剂;近年来,三方广泛用于高血压、心脏病的治疗,适用于肝阳上亢、痰浊内扰、瘀血内阻三个证型;以往研究报道,三方有抗心肌纤维化的作用,但其具体作用机制尚不清楚。2013年10月~2014年8月,我们观察了血府逐瘀汤、天麻钩藤饮、温胆汤对自发性高血压大鼠心肌组织MAPK信号通路的影响,并探讨其临床意义。
1 材料与方法
1.1 试剂与仪器 蛋白酶体抑制剂(MG132,美国Selleck公司),蛋白激酶检测试剂盒(德国Qiagen公司);RPMI1640培养基、胎牛血清(FBS)、胰酶(美国Gibco-BRL公司);LiquiChip液相芯片分析系统(Qiagen公司)。
1.2 药物制备 实验中所用中药材由南方医院中药房提供,经南方医科大学中医药学院药用植物学和中药鉴定学教研室鉴定合格后使用。天麻钩藤饮组方:天麻9 g,钩藤12 g(后下),石决明18 g(先煎),栀子 9 g,黄芩 9 g,川牛膝 12 g,杜仲 9 g,益母草9 g,桑寄生9 g,夜交藤9 g,茯苓9 g。温胆汤组方:半夏 6 g,竹茹 6 g,枳实 6 g,陈皮 9 g,甘草 3 g,茯苓5 g。血府逐瘀汤组方:桃仁12 g,红花9 g,当归 9 g,生地 9 g,川芎 5 g,赤芍 6 g,牛膝 9 g,桔梗5 g,柴胡3 g,枳壳6 g,甘草3 g。以上中药经3次煎煮后,过滤去渣,浓缩至1 mL药液(含1 g生药),4℃保存备用。
1.3 实验动物分组 16周龄雄性自发性高血压大鼠60 只,体质量(265.5 ±8.3)g,由北京维通利华实验动物技术有限公司提供;许可证编号:SCXK(京)2013-001;级别:SPF/VAF。60只大鼠随机分为阳性对照组、MG132组、天麻钩藤饮组、温胆汤组、血府逐瘀汤组各12只。雄性正常血压大鼠12只,体质量(269.1±9.6)g,由南方医科大学实验动物中心提供,设为阴性对照组。各组均普通饮食喂养7 d后开始实验,控制室温为(22±2)℃,湿度为55%±15%,标准饮食。MG132组腹腔注射 MG-132,0.1 mg/(kg·d)[7];天麻钩藤饮组、温胆汤组、血府逐瘀汤组给予相应的药物灌胃,按2 mL/100 g;阳性对照组、阴性对照组给予等量生理盐水灌胃,2次/d。连续灌胃8周后断头处死,取其心脏称重,取左室中部冠状面心肌,即刻放入液氮中冻存备用。
1.4 心肌组织 JNK、p38MAPK、ERK5检测 取大鼠心肌组织50 mg,在预冷的研钵中加入液氮研磨成粉状,加入组织裂解缓冲液,离心后取上清,定量并分装,-80℃冻存备用。采用LiquiChip液相蛋白芯片系统检测大鼠心肌组织 JNK、p38MAPK、ERK5,操作步骤如下:首先取50 μL待测心肌组织上清,加入96孔过滤板中,加入25 μL偶联有抗细胞因子抗体的球形基质(一抗),漩涡混匀,室温避光振摇2 h。然后用真空泵从反应板底部将各孔中液体除去,加入75 μL检测缓冲液,轻轻振摇后,再次抽去液体,每孔加入75 μL检测缓冲液和25 μL生物素化的二抗(报告分子),室温避光振摇1.5 h;每孔加入25 μL链霉亲和素偶联的藻红蛋白溶液,室温避光振摇0.5 h;每孔加入25 μL终止缓冲液,室温避光振摇5 min后,用真空泵从反应板底部将各孔中液体除去,每孔加入125 μL测定缓冲液,室温避光振摇1 min;最后在LiquiChip液相芯片检测系统上读取各孔荧光强度,并根据标准品的荧光强度得到样品的细胞因子浓度。
1.5 统计学方法 采用SPSS16.0统计软件。计量资料以±s表示,组间比较采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
各组大鼠心肌组织JNK、p38MAPK、ERK5表达比较见表1。
3 讨论
高血压为临床最常见的慢性疾病,心肌纤维化作为高血压心肌损害的主要病理基础,表现为心肌细胞外基质胶原的过度沉积和肌成纤维细胞数目的增多,进而影响心室壁动度及心室的舒张及收缩功能,从而导致严重心律失常、心功能不全及心源性猝死等严重并发症,严重威胁人类健康。因此,高血压心肌纤维化的发生机制和防治措施已成为近年来国内外研究热点。
表1 各组大鼠心肌组织JNK、p38MAPK、ERK5 表达比较(pg/mL, ±s)
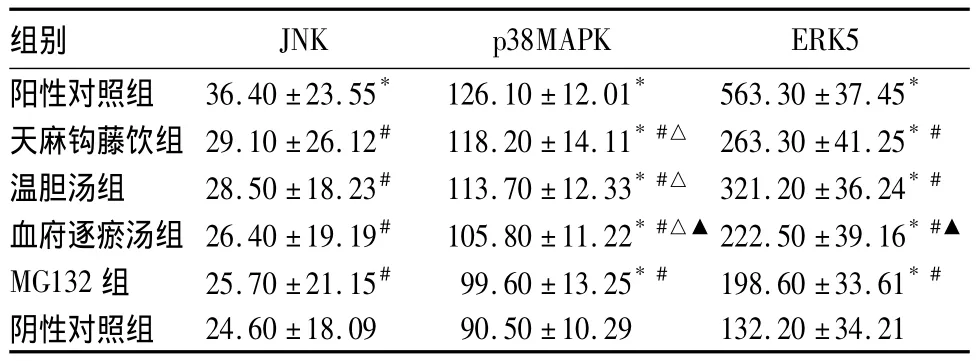
表1 各组大鼠心肌组织JNK、p38MAPK、ERK5 表达比较(pg/mL, ±s)
注:与阴性对照组比较,*P<0.01;与阳性对照组比较,#P<0.01;与MG132组比较,△P<0.01;与天麻钩藤饮组、温胆汤组比较,▲P<0.05
组别JNK p38MAPK ERK5阳性对照组 36.40 ±23.55* 126.10 ±12.01* 563.30 ±37.45*24.60 ±18.09 90.50 ±10.29 132.20 ±34.21天麻钩藤饮组 29.10 ±26.12# 118.20 ±14.11*#△ 263.30 ±41.25*#温胆汤组 28.50 ±18.23# 113.70 ±12.33*#△ 321.20 ±36.24*#血府逐瘀汤组 26.40 ±19.19# 105.80 ±11.22*#△▲ 222.50 ±39.16*#▲MG132 组 25.70 ±21.15# 99.60 ±13.25*# 198.60 ±33.61*#阴性对照组
自发性高血压大鼠模型是与人类原发性高血压遗传背景极为接近的模型,大鼠6周龄时血压开始升高,10周龄时左室肥厚(LVH)和心肌纤维化已经形成,并且随着鼠龄的增加而逐渐加重[8]。引起高血压LVH和心肌纤维化的机制十分复杂,除与高血压压力负荷及心肌组织内多种细胞因子的表达有关外,其中与MAPK有密切的关系。
高血压病程的进展可导致心肌肥厚的发生,后者可进一步促使高血压病情的恶化。MAPK是细胞内执行信号级联放大的一类蛋白质,包括ERK1/2、JNK、p38MAPK和ERK5,是与细胞增殖和肥大调控关系最为密切的细胞内信号转导蛋白激酶,其激活对促进心肌的生长发育起着至关重要的作用。ERK是主要的生长相关刺激的调控者,心脏靶向表达ERK1/2的上游激酶MEK-1可持续激活ERK1/2,磷酸化的ERK1/2蛋白表达显著增高,可导致明显的心室向心性肥厚,ERK5也在心肌肥厚的发展中起重要的调控作用[9,10]。JNK 和 p38MAPK 在心肌肥厚代偿期表现为活性增加,在失代偿期尤其是p38MAPK 则表现为活性降低[11~14]。MG132 也可通过调节MAPK信号通路预防高血压心肌肥厚的发生,同时可通过抑制核因子-κB信号通路预防和逆转心肌纤维化和心肌重塑[15]。
中医认为,瘀血内阻、肝阳上亢、痰浊内扰是高血压最常见的临床证型。血府逐瘀汤、天麻钩藤饮、温胆汤分别为活血化瘀、平肝潜阳、理气化痰的代表方。血府逐瘀汤出自清代王清任的《医林改错》,本方从桃红四物汤化裁而来,不仅可行血分之瘀滞,而且可解气分之郁结,活血而不耗血,袪瘀又能生新,将“血府”之瘀逐去而气机畅通,从而诸证悉除。天麻钩藤饮出自近代胡光慈的《杂病证治新义》,具有平肝潜阳、补益肝肾和清热活血的作用,是中医治疗肝阳上亢型高血压的经典方剂。温胆汤出自孙思邈的《千金要方》,具有理气化痰、清胆和胃的作用。近年来,三种方剂广泛用于高血压及相关并发症的临床治疗,具有良好的临床效果。本研究显示,天麻钩藤饮组、温胆汤组、血府逐瘀汤组 JNK、p38MAPK、ERK5表达较MG132组、阴性对照组升高,较阳性对照组降低,提示血府逐瘀汤、天麻钩藤饮、温胆汤可抑制大鼠心肌组织 JNK、p38MAPK、ERK5的表达,而血府逐瘀汤较天麻钩藤饮、温胆汤抑制作用更为明显。
[1] Lawrence MC.The roles of MAPKs in disease[J].Cell Res,2008,18(4):436-442.
[2]Shaul YD,Seger R.The MEK/ERK cascade:from signMing specificity to diverse functions[J].Biochim Biophys Acta,2007,1773(8):1213-1226.
[3]Raman M,Chen,Cobb MH.Differential regulation and properties of MAPKs[J].Oncogene,2007,26(22):3100-3012.
[4]Pimienta G,Pascual J.Canonical and alternative MAPK signaling[J].Cell Cycle,2007,6(21):2628-2632.
[5]Barr RK,Kendrick TS,Bogoyeviteh MA.Identification of the critical features of a small peptide inhibitor of JNK activity[J].J Biol Chem,2002,277(13):10987-10997.
[6]Kacimi R,Gerdes AM.Alterations in gprotein and MAP kinase signaling pathways during cardiac remodeling in hypertension and heart failure[J].Hypertension,2003,41(4):968-977.
[7]Kuwahara F,Kai H,Tokuda K.Transforming growth factorβ function blocking prevents myocardial fibrosis and diastolic dysfunction in pressure-overloaded rats[J].Circulation,2002,106(1):130-135.
[8] Ares-Carrasco S,Picatoste B,Benito-Martín.Myocardial fibrosis and apoptosis,but not inflammation,are present in long-term experimental diabetes[J].Am J Physiol Heart Circ Physiol,2009,297(6):2109-2119.
[9]Kehat I,Davis J,Tiburcy M,et al.Extracellular signal-regulated kinases 1 and 2 regulate the balance between eccentric and concentric cardiac growth[J].Circ Res,2011,108(2):176-183.
[10]Kimura TE,Jin J,Zi M,et al.Targeted deletion of the extracellular signal-regulated protein kinase 5 attenuates hypertrophic response and promotes pressure overload-induced apoptosis in the heart[J].Circ Res,2010,106(5):961-970.
[11]Dingar D,Merlen C,Grandy S,et al.Effect of pressure overloadinduced hypertrophy on the expression and localization of p38 MAP kinase isoforms in the mouse heart[J].Cell Signal,2010,22(11):1634-1644.
[12]Choukroun G,Hajjar R,Fry S,et al.Regulation of cardiac hypertrophy in vivo by the stress-activated protein kinases/c-JunNH(2)-terminal kinases[J].J Clin Invest,1999,104(4):391-398.
[13]Ono K,Han J.The p38 signal transduction pathway:activation and function[J].Cell Signal,2000,12(1):1-13.
[14]Takeishi Y,Huang Q,Abe Ji,et al.Src and multiple map kinase activation in cardiac hypertrophy and congestive heart failure under chronic pressure-overload:comparison with acutemechanical stretch[J].J Mol Cell Cardiol,2001,33(9):1637-1648.
[15]Ma Y,Chen B,Liu D,et al.MG132 treatment attenuates cardiac remodeling and dysfunction following aortic banding in rats via the NF-κB/TGFβ1pathway[J].Biochem Pharmacol,2011,81(10):1228-1236.

