心电图对曲妥珠单抗介导心脏毒性的预测价值
薛剑,金欣,于农,张孝忠
目前,早期乳腺癌患者经规范治疗后可延长生存期[1],但潜在的心脏毒性影响患者的生活质量[2]。心脏毒性已经成为心脏科和肿瘤科医生共同关注的话题[3,4]。心电图在评估患者心功能方面有着其他检查手段不可替代的作用[5]。在经典化疗药物的时代,肿瘤患者的心电图改变就已经被证实与化疗药物介导的心脏毒性有着密切的相关性[6]。目前,乳腺癌的治疗已经进入靶向药物的治疗时代。本研究旨在评估心电图诊断曲妥珠单抗心脏毒性的临床价值。
1 资料与方法
1.1 研究对象 入选军事医学科学院附属医院乳腺肿瘤内科2008年1月2013年1月收治的采用曲妥珠单抗辅助治疗的表皮生长因子受体2(HER2)阳性早期乳腺癌患者199例。所有患者均为女性,平均年龄为(47.47±10.20)岁,入组前心电图检查、超声心动图检查均正常。所有患者入组前均未接受曲妥珠单抗及其他药物治疗。排除既往有冠脉疾病,心脏瓣膜病等严重的心血管疾病(LVEF<50%),意识不清,不能配合,伴有其他器质性疾病的患者。
1.2 临床分组 采用美国心功能评估委员会(CREC)制定的关于曲妥珠单抗治疗相关心脏毒性的定义:左室射血分数降低≥10%(绝对值≤55%)伴有相关心衰症状或者无症状的射血分数降低≥15%(绝对值≤50%)[2,3]。随访观察患者心功能改变,符合心脏毒性定义则归入心脏毒性组,余为无心脏毒性组。
1.3 辅助化疗方案 所有患者在接受曲妥珠单抗靶向治疗前均先接受4周期常规化疗。常规化疗方案包括AT方案、TC方案及AC方案。AT方案中表阿霉素≥75 mg/m2(或吡柔比星≥50 mg/m2)和紫杉醇≥175 mg/m2(或多西他赛≥75 mg/m2);TC方案中紫杉醇≥175 mg/m2(或多西他赛≥75 mg/m2)和环磷酰胺≥75 mg/m2;AC方案中表阿霉素≥75 mg/m2(或吡柔比星≥50 mg/m2)和环磷酰胺≥75 mg/m2。化疗21 d为1周期,共4周期。
1.4 曲妥珠单抗辅助治疗剂量和时间 所有患者均接受曲妥珠单抗(商品名:赫赛汀,瑞士罗氏制药生产)靶向治疗,首次剂量8 mg/kg,之后每3周给予维持量6 mg/kg。治疗疗程均为1年(共18次)。
1.5 观察指标及方法
1.5.1 心电图及超声心动图检查 采用标准12导联心电图进行检查,由专人负责。所有患者在每周期治疗前1 d及治疗后第7 d行心电图检查。使用GE LOGIQ7型彩色多普勒超声诊断仪,探头频率(24)MHz,每3月复查1次,主要观察左室射血分数(LVEF)变化。结束治疗后,至少随访1年时间,每半年评估一次心功能。心电图结果由专门负责的心内科医师判读。
1.5.2 心电图异常的评价标准 以ST段改变、T波改变(升高、降低及倒置)、QRS波变化(升高或降低)和心律失常为主要标准。其他心电图异常情况(各种传导阻滞、左室高电压、P波异常、复极异常等)作为辅助参考标准。
1.6 统计学分析 使用SPSS 20.0统计学软件包处理所有数据,计量资料采用均数±标准差(±s)表示,两组间均数的比较采用t检验,计数资料采用例数(构成比)表示,组间比较采用χ2检验。采用COX生存分析进行心脏毒性事件比较。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料 所有入组患者,平均随访13.4个月,最长随访15个月,共有42例(21.11%)患者相继出现符合诊断标准的心脏毒性事件,仅有3例患者(7.14%)出现明显的胸闷症状,其余患者主要表现为无症状射血分数降低,所有患者均未暂停或者终止曲妥珠单抗的治疗。两组患者年龄、体质指数、合并高血压和糖尿病比例、肿瘤分期、使用化疗药物、射血分数比较均无统计学差异(P均>0.05)。见表1。
2.2 心电图变化 与无心脏毒性组比较,心脏毒性组心电图异常比例增加(59.24% vs. 73.81%),差异具有显著统计学意义(P<0.01)。应用曲妥珠单抗第2周期开始,心脏毒性组较无心脏毒性组心电图异常比例显著增加(P均<0.05)。患者心电图变化见表2。
2.3 Cox回归分析 早期的心电图异常改变是心脏毒性事件发生的独立预测因素。在整个随访中,一次心电图异常者的心脏毒性风险可能性增加1.7倍(HR=1.762,95%CI:0.914~3.793)。2次心电图异常的患者风险增加2.8倍(HR=2.881,96%CI:1.461~5.679)。观察到心电图异常次数越多,其后出现心脏毒性事件的可能性越大,完整的模型分析见表3。

表1 入组患者一般资料

表2 入组患者常见心电图变化
2.4 敏感性与特异性分析 心电图异常改变对于预测其后出现的心脏毒性的预测价值进行了敏感性与特异性分析。所有入组病例中,出现1次心电图异常预测其后心脏毒性发生的敏感性和特异性分别为73%,41%。出现2次心电图异常时,其敏感性与特异性分别为69%,58%。在出现5次以上(包括5次)的心电图异常患者中,其预测心脏毒性的特异性高达83%。见表4。
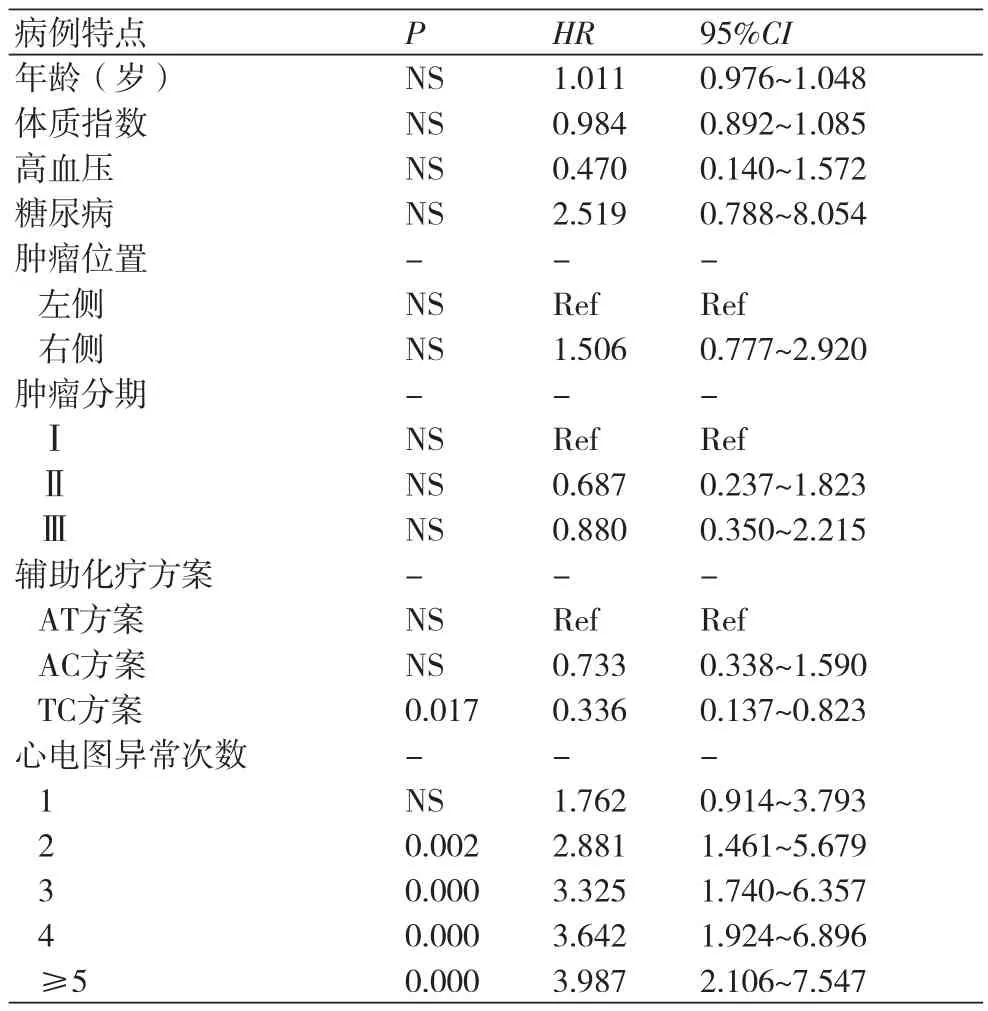
表3 Cox回归模型

表4 心电图异常次数与其预测价值
3 讨论
随着乳腺癌治疗手段的提高和患者生存时间的延长,曲妥珠单抗治疗相关的心脏毒性越来越受到人们的关注。既往研究报道辅助阶段应用曲妥珠单抗后相关心脏毒性的发生率在27%~34%之间[1-3]。本研究中,曲妥珠单抗相关的心脏毒性发生率21.11%,略低于其他文献报道的发生率。可能与排除了既往有心电图异常,冠心病病史,这些可能出现心脏毒性事件的高危患者有关。
目前为止,曲妥珠单抗介导心脏毒性的发生机制尚未明确。心脏毒性为曲妥珠单抗治疗的最常见的不良反应,多发生在治疗开始6个月以后,表现为胸闷心悸,LVEF降低,患者的生活质量受到很大影响。本研究评估了在辅助阶段应用曲妥珠单抗的前5周期中心电图,发现其对于心脏毒性的早期诊断有重要价值。
随访中,有64%的患者出现了至少1次心电图异常,提示曲妥珠单抗其潜在的心脏毒性损伤较大,尤其是与蒽环类化疗药物联合应用时。既往研究证实,与蒽环类药物相比,曲妥珠单抗介导的心脏毒性多表现为一过性无症状性射血分数降低[1]。本研究随访观察到的心电图异常改变特点与曲妥珠单抗介导的心脏毒性特点相似。绝大部分出现的心电图异常改变为一过性无症状异常改变,无需特别处理自行消失。而这种常常被临床医生忽视的心电图细微异常往往提示其心功能恶化的可能。
本研究中,71%的心脏毒性患者出现了至少一次的T波异常改变。临床上将独立的T波异常改变常常称为非特异性ST-T改变,这种异常心电图变化确切的机制尚未明确,在临床上,有很多因素可能引起患者出现非特异性的ST-T改变,如心肌炎、心肌缺血、电解质紊乱等,因此大部分观点认为单纯的非特异性ST-T改变没有临床诊断意义。但是在肿瘤患者这个特殊人群中,其往往提示细微的心肌损伤。在注射化疗药物的实验动物中也观察到类似的心电图改变,其心电图改变与随后的心肌病理改变呈显著相关性[7]。提示非特异性心电图异常改变可能由化疗药物介导的心肌氧代谢供需失衡引起的。乳腺癌化疗药物的使用,特别是蒽环类药物的应用,可引起血管内皮细胞损伤,同时线粒体功能受损,ATP合成障碍,最终致心肌细胞线粒体和DNA氧化损伤[8],但是心脏整体的射血功能并没有明显改变,表现为非特异的心脏电活动改变。这种非特异性的ST-T改变可能是心功能损伤的早期预警信号。
[1] Piccart-Gebhart MJ,Procter M,Leyland-Jones B,et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer[J]. N Eng J Med,2005,353(16):1659-72.
[2] Romond EH,Jeong JH,Rastogi P,et al. Seven-year follow-up assessment of cardiac function in NSABP B-31, a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel (ACP) with ACP plus trastuzumab as adjuvant therapy for patients with node-positive, human epidermal growth factor receptor 2-positive breast cancer[J]. J Clin Oncol,2012,30(31):3792-9.
[3] Farolfi A,Melegari E,Aquilina M,et al. Trastuzumab-induced cardiotoxicity in early breast cancer patients: a retrospective study of possible risk and protective factors[J]. Heart,2013, 99(9):634-9.
[4] Schwartz RG,Jain D,Storozynsky E. Traditional and novel methods to assess and prevent chemotherapy-related cardiac dysfunction noninvasively[J]. J Nucl Cardiol,2013,20(3):443-64.
[5] Birnbaum GD,Birnbaum I,Birnbaum Y. Twenty years of ECG Grading of the Severity of Ischemia[J]. J Electrocardiology,2014,47(4):546-55.
[6] Tjeerdsma G,Meinardi MT,van Der Graaf WT,et al. Early detection of anthracycline induced cardiotoxicity in asymptomatic patients with normal left ventricular systolic function: autonomic versus echocardiographic variables[J]. Heart,1999,81(4):419-23.
[7] Van Acker SA,Kramer K,Voest EE,et al. Doxorubicin-induced cardiotoxicity monitored by ECG in freely moving mice. A new model to test potential protectors[J]. Cancer Chemother Pharmacol,1996,38(1):95-101.
[8] Zambelli A,Della Porta MG,Eleuteri E,et al. Predicting and preventing cardiotoxicity in the era of breast cancer targeted therapies. Novel molecular tools for clinical issues[J]. Breast,2011,20(2):176-83.

