四川省女性ERα基因多态性与乳腺癌风险关系的病例对照研究
曹兰青,李 卉,刘 莉,王 琼,李冬锋,齐亚娜,李 卉△,李佳圆
(1.成都市妇女儿童中心医院,成都610041;2.四川省肿瘤医院,成都610041;3.四川大学华西公共卫生学院,流行病与卫生统计学系,成都610041)
乳腺癌的发生发展与女性体内雌激素暴露密切相关。雌二醇(estradiol,E2)通过与广泛分布在乳腺细胞核内的雌激素受体(estrogen receptor,ER)结合,促进乳腺细胞和组织的增殖分化。ER在乳腺组织的雌激素应答反应中起重要的调节作用。研究发现人类正常乳腺组织ERα表达或功能的改变可能会影响乳腺癌发生风险[1]。XbaⅠ(rs9340799)、PvuⅡ(rs2234693)是人群研究较为关注的ERα基因多态性位点,均位于ERα基因第1内含子内,分别在第2外显子上游351bp和397bp处发生A/G(x/X)、C/T(P/p)基因突变[2]。有研究者认为上述基因突变可能会影响乳腺细胞ERα基因外显子区域mRNA选择性剪接,从而改变ERα蛋白质功能[3]。目前国内外关于XbaⅠ、PvuⅡ基因多态性与乳腺癌患病风险的人群研究结论尚不一致[4-13]。因此本研究采用病例对照研究设计探讨四川汉族女性XbaⅠ、PvuⅡ基因多态性与乳腺癌患病风险的关系,并进一步分析二者的联合作用。
1 对象及方法
1.1 研究对象
2010年10月至2012年7月,采用便利抽样收集来源于四川省肿瘤医院经组织病理学诊断的原发性乳腺癌新发病例。对照组来源于成都市妇女儿童医学中心的健康体检女性。调查对象均签署知情同意书。
病例组:纳入标准:(1)年龄为30~70岁;(2)居住于四川省10年以上。排除标准:(1)转移性乳腺癌患者;(2)精神疾病患者;(3)内分泌疾病患者。
对照组:纳入标准:(1)年龄为30~70岁;(2)均居住于四川省10年以上。排除标准:(1)有放射线等职业暴露史者;(2)恶性肿瘤患者;(3)内分泌疾病患者;(4)生殖系统疾病患者;(5)精神疾病患者。
1.2 调查内容
采用问卷调查收集研究对象的一般人口学特征、身高、体重、月经史、生育史、雌激素药物服用史等常见乳腺癌危险因素信息。
1.3 基因型检测
PCR反应:采用EDTA抗凝管收集研究对象的外周静脉血5ml。采用天根生化科技(北京)有限公司全血基因组DNA提取试剂盒提取基因组DNA。采用限制性片段长度多态性技术(RFLP)检测XbaⅠ(rs9340799)、PvuⅡ(rs2234693)基因多态性。目的基因扩增采用巢式PCR技术,利用Primer Premier 5.0引物设计软件设计PCR引物。外侧引物:上游5-CTGCCACCCTATCTGTATCTTTTCCTATTCTCC-3;下游5-TCTTTCTCTGCCACCCTGGCGTCGATTATCTGA-3。内侧引物:上游5-AGGCTGGGCTCAAACTACAG-3’,下游 5-CTCTGGGAGATGCAGCAGAT-3’。引物设计参照陆旭[9]、宋传贵[14]等的研究。内、外侧PCR反应体系总量均为 25μl,包括 1μl模板(0.1ng/μl),1μl前引物(10μmol/L),1μl后引物(10μmol/L),12.5μl 2 × Taq PCR master Mix(含染料),9.5μl RNase-free water。引物由北京 invitrogen英杰生命技术公司合成,其他试剂购自北京康为世纪生物科技有限公司。外侧PCR反应条件为:95℃预变性3分钟,95℃变性30秒,60.9℃退火30秒,72℃延伸1分钟,循环30次,最终72℃延伸10分钟。内侧PCR反应条件为94℃预变性2分钟,94℃变性30秒,54.6℃退火30秒,72℃延伸1分钟,循环30次,最终72℃延伸7分钟。
PCR产物酶切:采用 XbaⅠ内切酶(1U/μl)、PvuⅡ内切酶(1U/μl)对目的位点进行酶切。酶切体系包括:31μl酶切体系,包括10μlPCR产物、1μl XbaⅠ或 PvuⅡ内切酶(1U/μl)、2μl10 × Buffer Tango或Buffer G、18μl灭菌超纯水。所有试剂均购自北京康为世纪生物科技有限公司。将配制好的酶切体系置于37℃恒温水浴箱内酶切4至16小时,取出后滴加1.31μl0.5MEDTA 终止反应。
琼脂糖凝胶电泳:配制1.5%琼脂糖凝胶进行凝胶电泳。取10μl酶切反应产物和2μl溴酚蓝上样缓冲液混合后,加入点样孔内,100V恒压电泳40分钟,凝胶成像系统紫外灯下观察结果。
基因型判定:XbaⅠ电泳结果仅出现一条316bp的条带,为野生纯合型(xx);存在615bp和316bp两条带,为突变杂合型(Xx);仅出现一条615bp的条带,为突变纯合型(XX),见图1。PvuⅡ电泳结果仅出现一条615bp的条带,为野生纯合型(PP);存在615bp和271bp,344bp三条带,为突变杂合型(Pp);仅出现271bp和344bp两条带,为突变纯合型(pp),见图2。
1.4 质量控制
随机抽取5%研究对象于调查两周后重新进行问卷复核,两次回答一致率为90%。随机抽取10%的样本进行基因型重复检测,重测结果一致率为100%。PCR片断经DNA测序证明无误。
1.5 统计分析
采用 Epidata3.0建立数据库。采用 Spss17.0软件对数据进行统计分析。采用频数及构成比描述XbaⅠ、PvuⅡ基因型及等位基因的分布,并检验对照组基因型分布是否符合Hardy-Weinberg遗传平衡定律。将本次研究样本人群的XbaⅠ、PvuⅡ基因型分布与Hapmap数据库中国人群数据进行比对。采用χ2检验比较病例组与对照组乳腺癌危险因素的分布差异,筛选出有统计学意义的协变量。检验
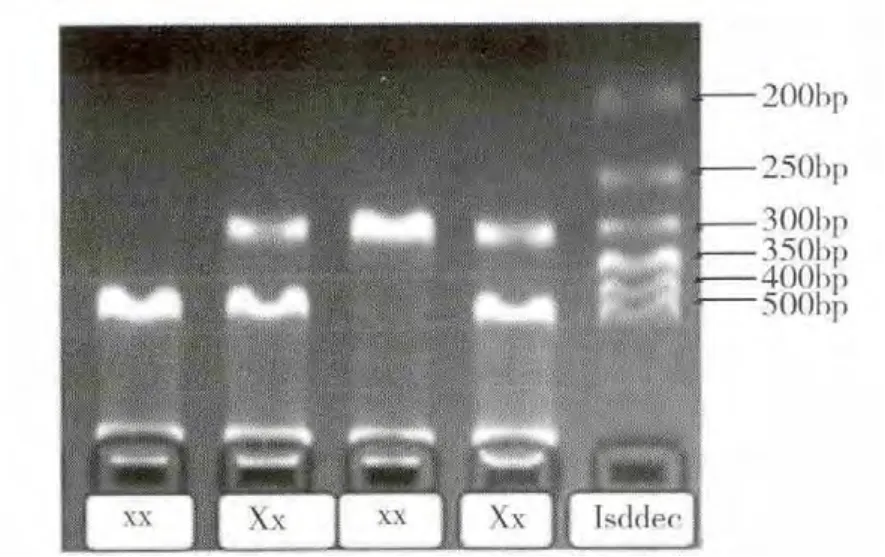
图1 XbaⅠ各基因型电泳图
2 结果
2.1 乳腺癌病例组和对照组一般情况及常见危险因素的组间比较
本次研究共纳入病例221例,对照252例。病例组平均年龄(48.25±10.04)岁,对照组平均年龄为(47.52 ±9.31)岁,年龄差异无统计学意义(t=-0.83,P=0.41)。病例组绝经前161例(63.9%),绝经后水准为双侧α=0.05。采用非条件多因素 logistic回归评价XbaⅠ、PvuⅡ基因多态性与乳腺癌患病风险的关系。采用分层分析估计基因与基因间的联合效应。按照绝经状态进行亚组分析。91 例(36.1%);对照组绝经前 130 例(58.8%),绝经后91例(41.2%);经检验,绝经状态在病例对照组间分布无统计学差异(χ2=1.28,P=0.26)。χ2检验结果显示总人群中,文化程度、家庭人均月收入、职业、BMI、初产年龄、哺乳、活产数等变量组间分布具有统计学差异(P<0.05)(表1)。绝经前后亚组危险因素筛选结果详见表1。
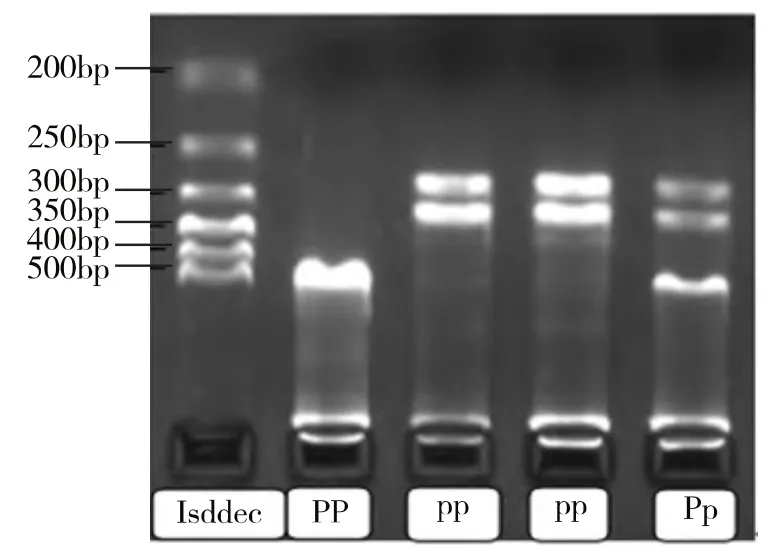
图2 PvuⅡ各基因型电泳图

表1 乳腺癌一般危险因素变量筛选结果
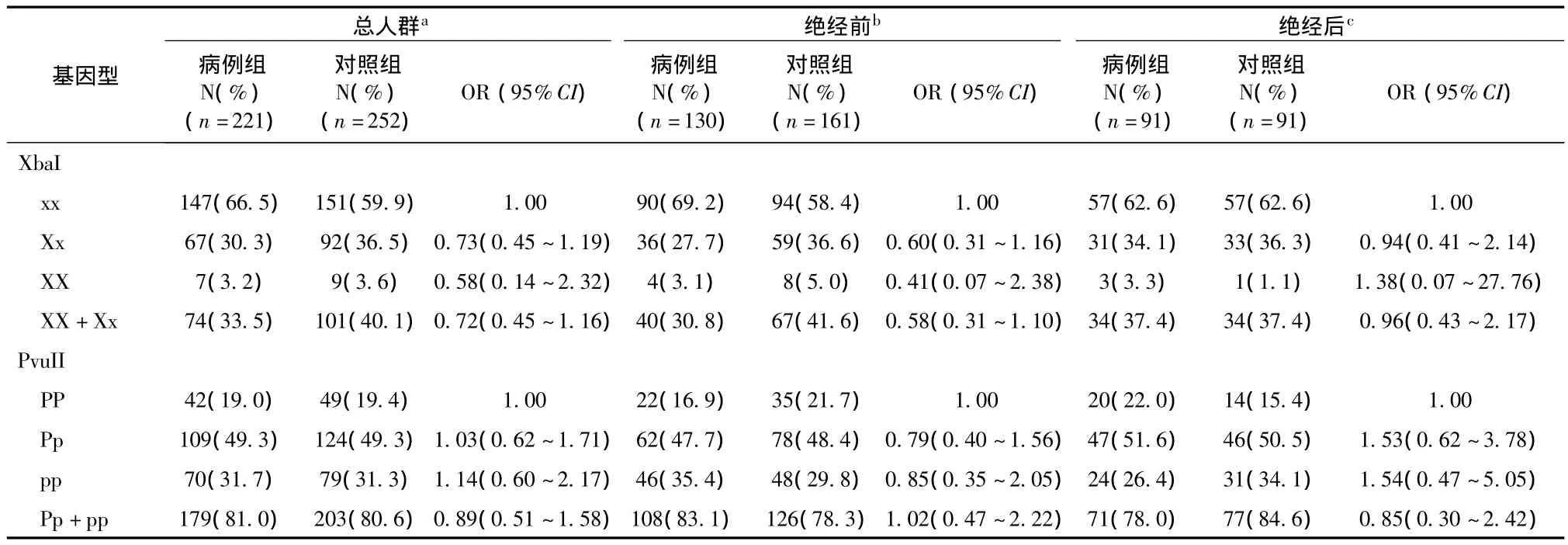
表2 XbaⅠ、PvuⅡ基因多态性与乳腺癌患病风险的关系
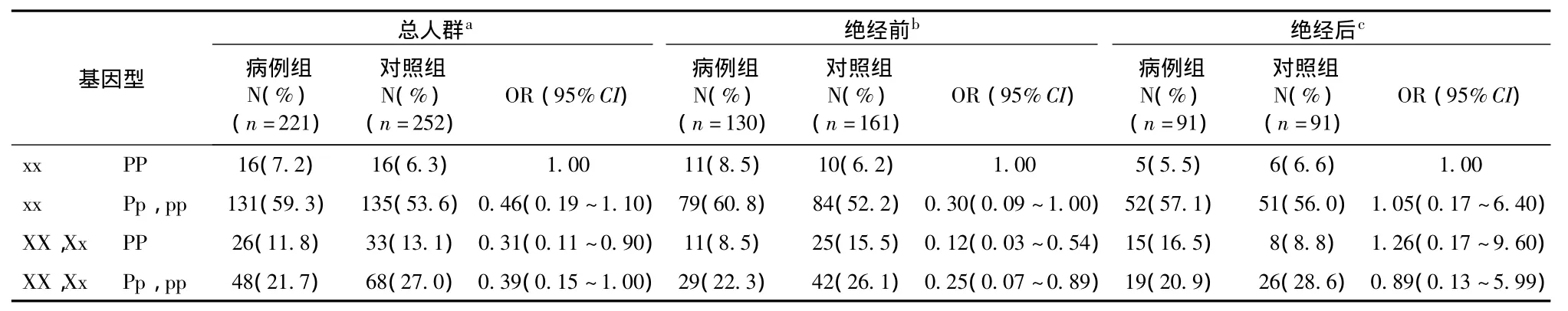
表3 XbaⅠ、PvuⅡ对乳腺癌患病风险联合作用的分层分析结果
2.2 XbaⅠ、PvuⅡ基因型分布与比较
对照组XbaⅠ、PvuⅡ基因型频率均符合Hardy-Weinberg遗传平衡定律(Xba Ⅰ:χ2=0.001,P=0.98;Pvu Ⅱ:χ2=1.23,P=0.27)。Hapmap 数据库中中国人群XbaⅠ各基因型携带率分别为0.65(xx)、0.25(Xx)和 0.10(XX);Pvu Ⅱ各基因型携带率为0.20(PP)、0.40(Pp)和 0.40(pp),与本次研究样本人群中基因型分布基本一致。多因素Logistic回归结果显示,在总人群、绝经前及绝经后女性中,各位点以野生纯和型为参照,突变杂合型及突变纯和型与乳腺癌风险无关(P>0.05)。显性遗传模型(Xx+XX vs.xx;Pp+pp vs.PP)也未发现 XbaⅠ、PvuⅡ突变等位基因与乳腺癌患病风险的关系(P >0.05)(表2)。
2.3 XbaⅠ、PvuⅡ基因多态性联合作用分析结果
多因素Logistic回归结果显示,以xxPP野生基因型组合为参照,在总人群中,只携带p等位基因与乳腺癌患病风险无统计学关联(OR=0.46,95%CI:0.19~1.10),而只携带 X等位基因能明显降低乳腺癌患病风险(OR=0.31,95%CI:0.11~0.90),其效应大小与同时携带X、p等位基因效应接近(OR=0.39,95%CI:0.15~1.00)。在绝经前亚组中,只携带 X 等位基因(OR=0.12,95%CI:0.03~0.54)以及 X、p 联合暴露(OR=0.25,95%CI:0.07~0.89)均能降低乳腺癌风险。(详见表3)。
3 讨论
XbaⅠ、PvuⅡ位点存在于ERα第一内含子内,并不直接参与ERα基因转录翻译过程。Maruyama等[15]将1.3kbp ERα基因序列插入萤光素酶报告基因载体(pGL3)中,发现携带x等位基因的荧光素酶活性高于 X等位基因。Herrington[16]等发现 P等位基因与ERα蛋白髓细胞瘤(B-myb)转录因子结合位点暴露有关,可提高下游外显子区转录活性。
本次研究在总人群、绝经前及绝经后女性中未观察到XbaⅠ、PvuⅡ基因多态性影响乳腺癌患病风险的独立效应。这与此前来自中国和欧洲的部分人群研究结论一致[2,4-8]。但也有研究观察到乳腺癌患病风险与XbaⅠ基因多态性的关系。陆旭[9]等在中国北方汉族女性中、Shin[10]等在韩国女性中,Andersen[11]在挪威女性中均发现 X等位基因携带者乳腺癌患病风险明显降低。此外,有部分研究观察到乳腺癌患病风险与PvuⅡ基因多态性的关系。来自上海[12]和日本[13]的的大样本病例对照研究均发现,P等位基因对乳腺癌的保护作用。由此可见,XbaⅠ、PvuⅡ基因多态性与乳腺癌患病风险关系在各人种中仍得到不同的结论。研究间结论不一致的原因可能与各研究样本量差异和样本代表性有关。国内外多数人群研究发现的XbaⅠ、PvuⅡ易感基因型具有临界风险效应(OR<2,OR 95%CI下限接近1),说明这两个位点多态性对乳腺癌风险的贡献较弱。
本研究对两个位点的协同作用分析发现在总人群及绝经前人群中,与携带xxPP野生基因型组合相比,只携带X等位基因能明显降低乳腺癌患病风险,其效应与同时携带X、p等位基因非常接近。这提示X等位基因对乳腺癌患病风险具有保护效应,但两位点间可能并不存在交互效应。本研究观察到X等位基因的保护效应在绝经前女性中更为明显。可能的原因是ERα参与乳腺细胞雌激素应答调解,故ERα蛋白表达或功能的改变对绝经前女性影响更大。近年来有研究发现XbaⅠ、PvuⅡ位点之间存在遗传连锁不平衡,且xp单倍体可增高乳腺癌患病风险。因此,后续研究应进行连锁不平衡及单体型分析,探讨XbaⅠ、PvuⅡ对中国女性乳腺癌患病风险影响的作用模式,更加全面地揭示这两个位点与乳腺癌患病风险的关系。
[1] Khan SA,Rogers MA,Khurana KK,et al.Estrogen receptor expression in benign breast epithelium and breast cancer risk[J].J Natl Cancer Inst,1998,90(1):37-42.
[2] Wedrén S,Lovmar L,Humphreys K,et al.Oestrogen receptor alpha gene haplotype and postmenopausal breast cancer risk:a case control study[J].Breast Cancer Res,2004,6(4):R437-449.
[3] Kobayashi S,Inoue S,Hosoi T,et al.Association of bone mineral density with polymorphism of the estrogen receptor gene[J].J Bone Miner Res,1996,11(3):306-311
[4] Shen Y,Li DK,Wu J,et al.Joint effects of the CYP1A1 MspⅠ,ERαlpha PvuⅡ,and ERαlpha XbaⅠPolymorphisms on the risk of breast cancer:results from a population-based case-control study in shanghai,China [J].Cancer Epidemiol Biomarkers Prev,2006,15(2):342-347.
[5] Han J,Jiang T,Bai H,et al.Genetic variants of 6q25 and breast cancer susceptibility:a two-stage fine mapping study in a Chinese population [J].Breast Cancer Res Treat,2011,129(3):901-907.
[6] Sakoda LC,Blackston CR,Doherty JA,et al.Selected estrogen receptor 1 and androgen receptor gene polymorphisms in relation to risk of breast cancer and fibrocystic breast conditions among Chinese women[J].Cancer Epidemiol,2011,35(1):48-55.
[7] Dunning AM,Healey CS,Baynes C,et al.Association of ESR1 gene tagging SNPs with breast cancer risk [J].Hum Mol Genet,2009,18(6):1131-1139.
[8] Onland-Moret NC,van Gils CH,Roest M,et al.The estrogen receptor alpha gene and breast cancer risk(The Netherlands)[J].Cancer Causes Control,2005,16(10):1195-1202.
[9] 陆 旭,李 波,韦军民,等.雌激素α受体XbaⅠ和PvuⅡ基因多态性与乳腺癌相关性的研究[J].中华外科杂志,2005,43(5):290-293.
[10] Shin A,Kang D,Nishio H,et al.Estrogen receptor alpha gene polymorphisms and breast cancer risk[J].Breast Cancer Res Treat,2003,80(1):127-131.
[11] Andersen TI,Heimdal KR,Skrede M,et al.Oestrogen receptor(ESR)polymorphisms and breast cancer susceptibility[J].Hum Genet,1994,94(6):665-670.
[12] Cai Q,Shu XO,Jin F,et al.Genetic polymorphisms in the estrogen receptor α gene and risk of breast cancer:results from the shanghai breast cancer study[J].Cancer Epidemiol Biomarkers Prev,2003,12(9):853-859.
[13] Iwasaki M,Hamada GS,Nishimoto IN,et al.Isoflavone,polymorphisms in estrogen receptor genes and breast cancer risk in case-control studies in Japanese,Japanese Brazilians and non-Japanese Brazilians[J].Cancer Sci,2009,100(5):927-933.
[14]宋传贵,胡 震,袁文涛,等.ER-α基因多态性与无BRCA1/2基因突变的有遗传倾向的乳腺癌的关系[J].中华普通外科杂志,2006,21(9):637-640.
[15] Maruyama H,Toji H,Harrington CR,et al.Lack of an association of estrogen receptor alpha gene polymorphisms and transcriptional activity with Alzheimer disease[J].Arch Neurol,2000,57(2):236-240.
[16] Herrington DM,Howard TD,Brosnihan KB,et al.Common estrogen receptor polymorphism augment effects of hormone replacement therapy on E-selection but not C-reactive protein[J].Circulation,2000,105:1879-1882.

