氟尿嘧啶和奥沙利铂在胃癌中的体外化疗敏感性检测*
陈小东,赵 平,丁 志,周 祥,肖硕萌,唐令超
(四川省肿瘤医院·研究所胃肠外科,成都610041)
胃癌是我国常见恶性肿瘤之一,最新的癌症登记数据表明其年发病率为36.21/10万人(男性49.61/10万人,女性 22.50/10 万人),年新增病例约40.5万人,居恶性肿瘤第二位(构成比为12.67%);死亡率为 25.88/10 万人(男性 34.64/10万人,女性16.91/10万人),年死亡人数约32.5万人,居恶性肿瘤第三位(构成比为 14.33%)[1-2]。由于没有开展广泛的人群早期筛查,我国早期胃癌的诊断率很低,多数患者发现晚,确诊时已属进展期,部分患者甚至已属不能手术切除或有远处转移仅能行姑息性化疗的晚期病例,即使行了根治性切除的患者,大部分也需要辅助性化疗[3]。系统评价及Meta-分析显示根治术后的辅助化疗可以显著降低复发率、提高治愈率,而晚期胃癌的姑息化疗也可以延长生存期并改善生活质量[4-5]。然而,目前胃癌化疗的有效率较低,辅助化疗仅能提高治愈率10%左右,而姑息化疗的有效率也仅为10%~50%,其根本原因可能在于胃癌是高度异质性的一类肿瘤,建立在群体样本研究基础上的“标准化疗方案”没有考虑到个体的差异性[6]。因此,为进一步提高化疗的有效性就要求从“标准化”向“个体化”发展。目前,体外肿瘤化疗药物敏感性检测是实现个体化治疗的有效措施之一。本研究采用三磷酸腺苷肿瘤化疗药物敏感性检测法(ATP-TCA)对27例新鲜胃癌手术标本进行体外化疗敏感性检测,以期为术后化疗方案的选择提供指导。
1 材料与方法
1.1 患者
本研究纳入的患者为2014年1月至2014年6月在我院经胃镜活检初次确诊的胃癌患者,术前签署书面知情同意书,同意行化疗药物敏感性检测。排除行术前新辅助化疗或同时诊断患有其他恶性肿瘤的患者。所有患者均行胃切除术加D2淋巴结清扫术。使用设计好的数据表前瞻性录入患者的临床病理特征,包括年龄、性别、肿瘤位置、Bormann分型、组织学分类、术后TNM分期、脉管侵犯及神经侵犯等[7]。术前结合胃镜及CT按肿瘤主体所在部位判定肿瘤位置,并经术中证实或修正。
1.2 主要仪器和试剂
高灵敏度板式化学发光检测仪(OrionⅡ,德国Berthold Detection Systems公司)、低速大容量离心机、倒置显微镜、超净台、CO2培养箱、96孔细胞培养板;ATP生物荧光肿瘤药物敏感性检测试剂盒(湖州海创生物科技有限公司)、完全培养液(CAM)、肿瘤组织消化酶(TDE)、ATP抽提剂(TCE)、红细胞裂解液、荧光素-荧光素酶工作液和ATP标准液。
1.3 体外化疗药物敏感性检测
新鲜的胃癌标本取材后放入一次性的培养皿中,吹打标本并吸去浸泡液;加75%酒精浸没标本并吹打1~2分钟,吸去酒精,在含抗生素(青霉素200U/ml和链霉素200U/ml)的培养基中浸泡25分钟后,吸去浸泡液,用剪刀镊子剪成糊状,肉眼基本看不到颗粒,置于15ml离心管中,加入6ml含混合消化酶的培养基,于37℃消化2h。200目筛网过滤,获得单细胞悬液,用培养基洗涤2次。台盼蓝染色进行活细胞计数。
先加待测药物于96孔培养板,所用药物及100%TDC(测试药物浓度)参考药物在人体内的血浆浓度设定为:氟尿嘧啶(5-FU 25μg/ml)、奥沙利铂(OX 5μg/ml),联合用药的每个药物浓度与单药浓度相同[8-9]。每个药物设200%、100%、50%、25%、12.5%TDC五个浓度,每个浓度2个平行孔,并设2排(8孔)无药孔作对照,一排为无药对照(M0),一排为空白对照(MI),仅200ul完全培养基,作为检测本底值。接种肿瘤细胞,细胞数为2×104个/孔。在37℃、5%CO2条件下培养5天后,按试剂盒说明书操作测定荧光值。
1.4 结果参数及敏感性判定标准
检测系统软件自动分析每种测试药物浓度(Test Drug Concentration,TDC)的肿瘤生长抑制率(Tumor Growth Inhibition Rate,TGI),绘制药物浓度-肿瘤细胞生长抑制曲线(横坐标X轴为TDC,纵坐标Y轴为TGI),计算抑制曲线下面积(area under the curve,AUC)、化疗敏感指数(chemosensitivity index,CSI)、IC50 及 IC90,其计算方法如下:
TGI:(1-药物处理孔荧光均值/无药对照孔荧光均值)×100%。
AUC:按梯形法则进行X、Y轴坐标计算测试药物浓度(TDC)百分比VS抑制肿瘤生长(TGI)百分比,其值越大代表这个化疗药物对肿瘤细胞的抑制性越好。
CSI:CSI=500-各TDC的抑制率之和,其值越小表示这个化疗药物对肿瘤细胞的抑制率高。
IC90:抑制90%肿瘤细胞生长的TDC。IC50:抑制50%肿瘤细胞生长的TDC。
化疗敏感性根据以下三种进行分类:敏感:IC50≤25%TDC;轻度敏感:IC90≤100%TDC且IC50>25%,或CSI≤300;耐药:IC90>100%TDC且 IC50>25%且 CSI>300。
1.5 统计学方法
计数资料采用例数及百分比表示,不同化疗药物之间的比较采用两相关样本Wilcoxon符号秩检验(Two-Related-Samples Wilcoxon Signed Ranks test);计量资料采用均数±标准差(Mean±SD)表示,不同化疗方案之间的比较采用随机区组设计的方差分析,并采用LSD法进行两两比较;多因素分析采用Logistic回归分析,采用逐步向前法(Forward Stepwise)选择变量进入回归模型,并依据似然比(Likelihood Ratio)检验的结果剔除变量,在结果中仅将纳入回归模型的变量列出。以P﹤0.05为有统计学意义。所有统计学操作采用SPSS 16.0完成。
2 结果
2.1 纳入患者的临床病理特征
共纳入27例患者,其中老年患者14例(51.9%)、男性21例(77.8%)、肿瘤位于远侧部14 例(51.9%)、低分化及印戒细胞癌共20例(74.1%)、TNM Ⅲ+Ⅳ期21例(77.8%)(见表1)。
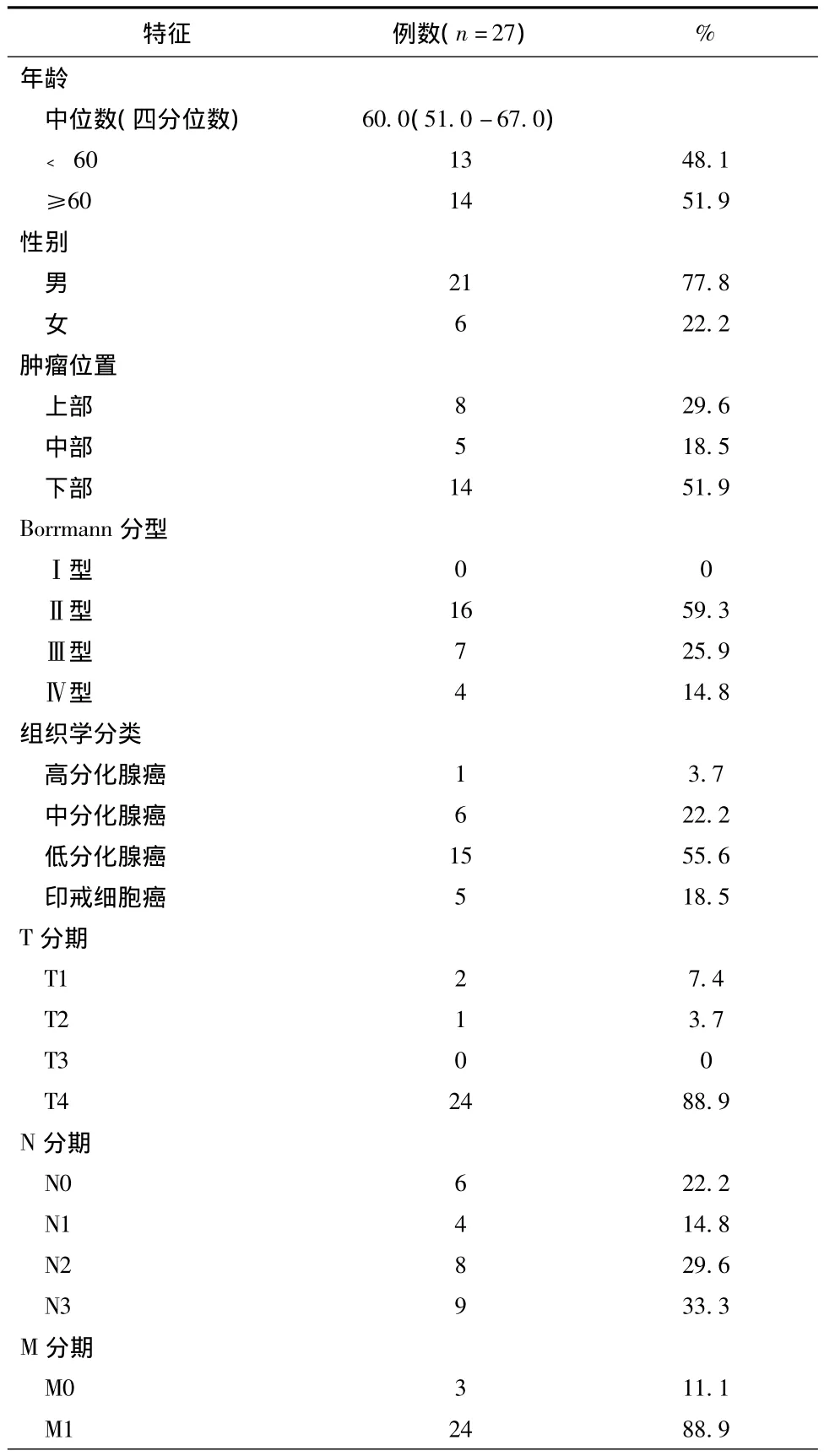
表1 患者的临床病理特征

特征 例数(n=27)%TNM 分期Ⅰ期 3 11.1Ⅱ期 3 11.1Ⅲ期 18 66.7Ⅳ期 3 11.1脉管侵犯否19 70.4是8 29.6神经侵犯否19 70.4是8 29.6
2.2 体外化疗敏感性检测结果
2.2.1 肿瘤生长抑制率(TGI) 三种化疗方案不同TDC对来自同一标本的肿瘤细胞生长具有抑制作用(见图1),抑制作用高低依次是5-FU+OX、OX和5-FU,而且后两条抑制曲线较为接近。
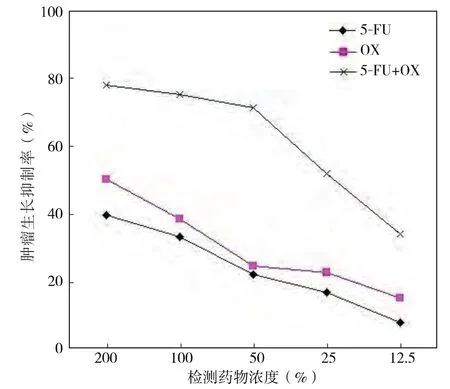
图1 肿瘤生长抑制曲线
三种化疗方案TDC越高对胃癌细胞生长的抑制率也越高,且5-FU+OX在各个TDC的TGI均显著高于5-FU或OX(见表2)。
2.2.2 TGI相关参数及化疗敏感性判定 5-FU+OX的AUC均显著高于5-FU或OX,而其CSI、IC90和IC50显著低于5-FU或OX。5-FU、OX及5-FU+OX的敏感性(敏感 +轻度敏感)依次为18.5%、14.8%及55.6%,5-FU+OX的敏感性显著高于5-FU 或 OX(5-FU+OX vs.5-FU:P=0.001 和5-FU+OX vs.OX:P=0.003)(见表 3)。
三种化疗方案的CSI频率直方图显示其分布近似于正态分布,敏感性较高的5-FU+OX的峰值更靠左(见图2)。
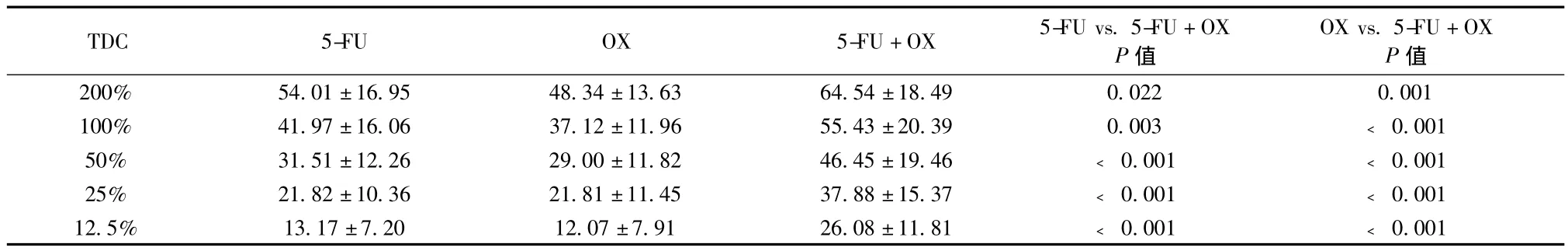
表2 四种化疗方案不同药物浓度(TDC)的肿瘤生长抑制率(TGI)
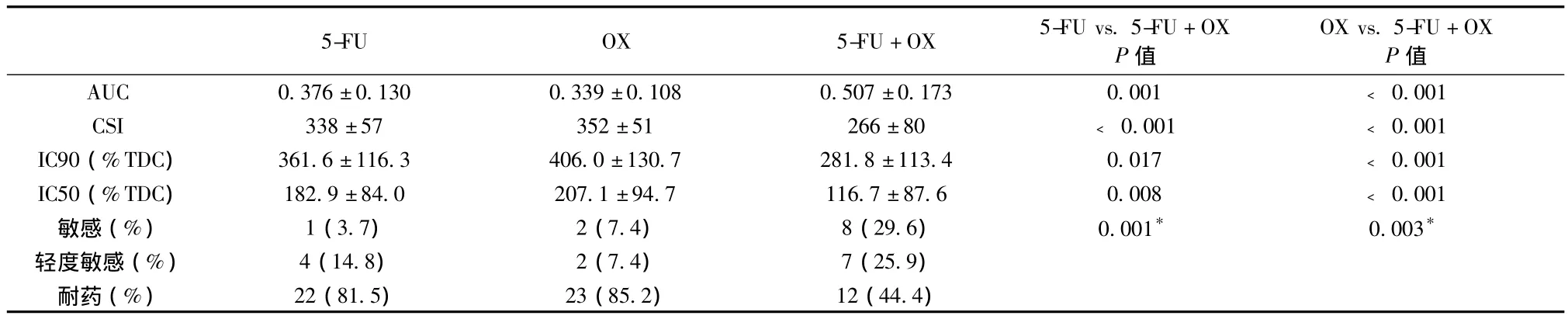
表3 TGI相关参数及化疗敏感性判定结果
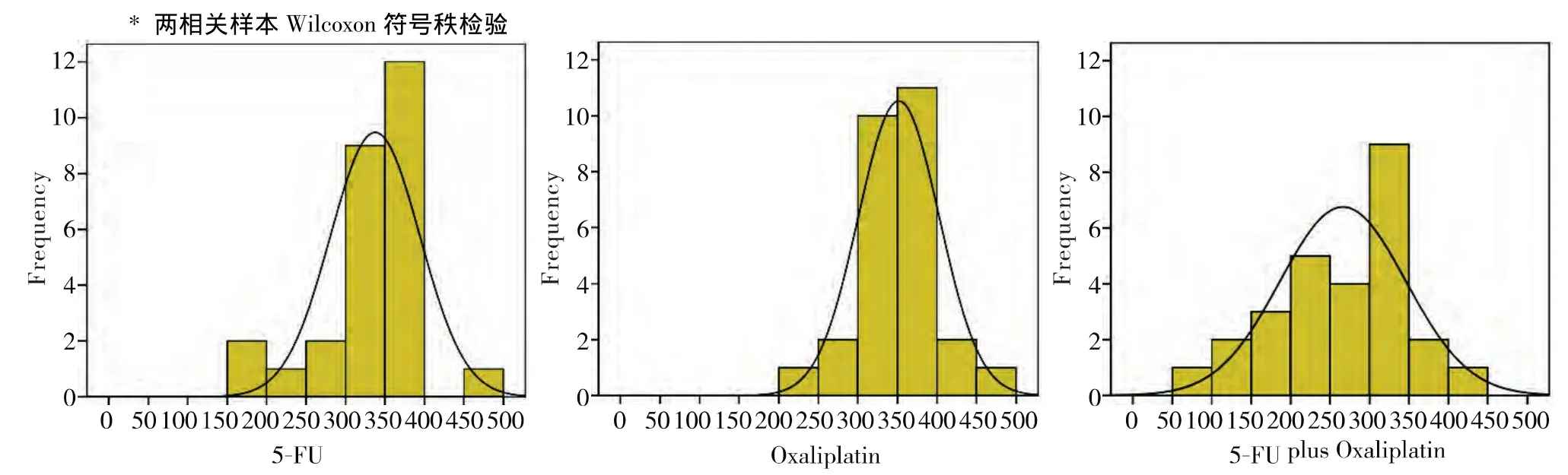
图2 三种化疗方案的CSI频率直方图
2.3 多因素回归分析
将表1所列临床病理特征纳入多因素回归分析显示,尽管对5-FU敏感的均为远侧部胃癌,但单因素分析(Fisher's Exact Test:P=0.078)及多因素分析(P=0.998)均显示无显著相关性;OX的敏感性与Borrmann分型有显著相关性(P=0.025),BorrmannⅢ、Ⅳ型高于Ⅱ型(OR=7.570);5-FU+OX的敏感性与肿瘤位置有显著相关(P=0.019),远侧部胃癌中的敏感性显著高于近侧部(OR=3.427)(见表4)。
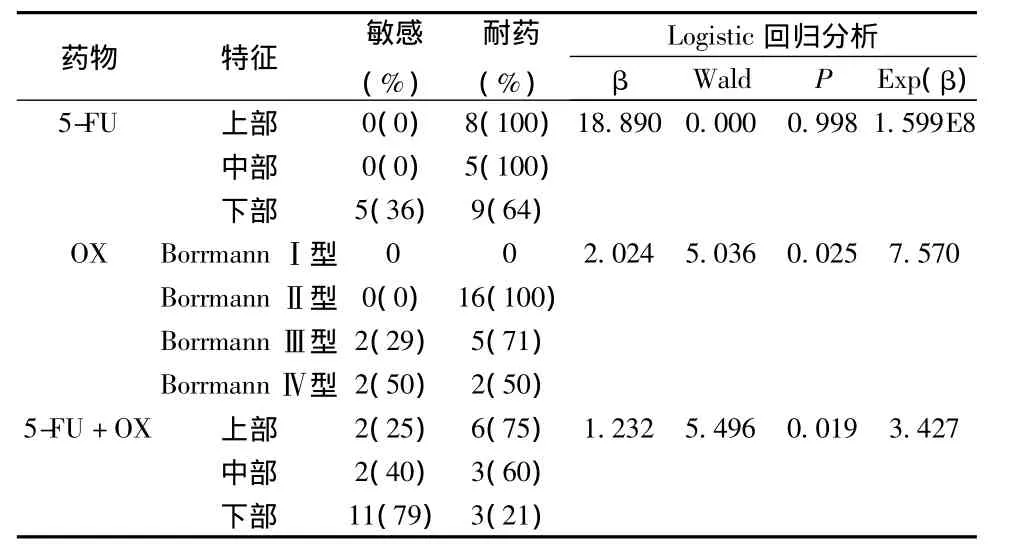
表4 化疗敏感性相关因素分析
3 讨论
尽管根治性手术仍是目前唯一有可能治愈胃癌的治疗措施,但是术后辅助化疗的作用也逐渐得到了广泛认可,其目的是为了防止微小残留肿瘤复发。一项国际协作的针对较早期的随机对照试验的meta-分析显示:辅助化疗使胃癌患者的5年无疾病生存率提高5.3%(从48.7% 到 54.0%),5 年和10年总生存率分别提高5.8%(从49.6%到55.3%)和 7.4%(从 37.5%到 44.9%),中位生存时间延长2.9 年(从 4.9 到7.8 年)[10]。
近年由于化疗新药的出现,辅助化疗的效果有了进一步提高。日本进行的ACTS-GC试验采用S-1单药辅助化疗,结果显示与单纯手术相比,3年和5年无疾病生存率分别提高12.6%(从59.6%到72.2%)和12.3%(从 53.1% 到 65.4%),3 年和 5年总生存率分别提高10.0%(从70.1% 到80.1%)和 10.6%(从 61.1% 到 71.7%)[11-12]。而中韩两国进行的CLASSIC试验采用卡培他滨加奥沙利铂的联合方案辅助化疗,结果显示与单纯手术相比,3年无疾病生存率提高15%(从59%到74%),3年总生存率提高5%(从78% 到83%)[13]。
基于大样本的Ⅲ期临床随机对照试验结果,美国国家综合癌症网络2014年NCCN指南推荐的辅助化疗方案为卡培他滨加奥沙利铂或顺铂的联合方案[14],日本胃癌学会2010年第三版胃癌治疗指南推荐的是S-1单药[15],而我国卫生部制定的2011年版《胃癌诊疗规范》推荐氟尿嘧啶类联合铂类的两药联合方案[16]。尽管目前胃癌辅助化疗取得了可喜的进步,但远未达到令人满意的程度,因为大量接受根治性手术及辅助化疗的患者仍然出现复发。除了进一步开发更敏感的化疗药之外,如何更充分有效地发挥现有药物的作用却是更现实的做法。分子靶向药物的广泛使用开启了肿瘤“个体化”治疗的大门,同样,在寻找“标准化疗方案”的同时,“个体化化疗”的理念也逐渐兴起。
体外化疗敏感性检测可以为化疗药物的个体化选择提供参考,多项临床研究证实其有较高的临床符合率,在多种肿瘤的治疗中取得了明显的效果[17-18]。数项来自韩国的研究也初步表明了ATP-TCA法在胃癌治疗中的价值[19-22]。基于前述指南推荐的术后辅助化疗方案及我们目前临床实践的实际情况,我们采用ATP-TCA法检测了5-FU、OX及5-FU+OX在胃癌中的敏感性,结果表明5-FU+OX显示出比5-FU或OX更高的体外化疗敏感性。然而,需要特别注意的是体外试验并不能完全模拟体内环境。实际上,药物的体内过程十分复杂,不同的给药途径(如静脉注射、滴注、持续泵入或口服给药)会影响药物的吸收及分布,药物进入体内后还要经历独特而复杂的药代动力学和药效动力学过程;体外试验模型则是高度理想化和简单化的体系,只能在一定程度上模拟体内的环境,在本研究中测试药物浓度即是对药物在人体内的血浆浓度值的等效转换,然而,这种等效转换却并不能直接等同于体内疗效。有鉴于此,我们也正在对体外试验的结果与体内疗效的相关性进行长期的临床观察。
影响胃癌预后的因素包括治疗措施、TNM分期、肿瘤位置、分化程度、脉管侵犯、种族、性别及年龄等,近侧部胃癌是不良预后因素,而亚洲人、女性及年轻为良好的预后因素[23]。本研究采用多因素回归分析发现OX和5-FU+OX的敏感性分别与Borrmann分型和肿瘤位置有显著相关性。因为本研究病例数较少,尚难以做出肯定的结论,因此需要增加病例数进一步验证。然而,值得注意的是,既往的临床研究表明近侧胃癌的预后比远侧胃癌差[24],而我们的研究也表明5-FU及5-FU+OX的化疗敏感性在远侧部胃癌中较高,这是否与临床预后相关也有待进一步验证。
[1] 赫 捷,陈万青.2012中国癌症登记年报[M].北京:军事医学科学出版社,2012:27-31.
[2] Ferlay J,Soerjomataram I,Ervik M,et al.GLOBOCAN 2012 v1.0,Cancer Incidence and Mortality Worldwide:IARC CancerBase No.11 [EB/OL].http://globocan.iarc.fr/Pages/fact_sheets_population.aspx.2014-06-17.
[3] 赖少清,鞠凤环,贺 舜,等.902例胃癌临床流行病学特征分析[J].中国肿瘤,2011,20(7):506-508.
[4] Knight G,Earle CC,Cosby R,et al.Neoadjuvant or adjuvant therapy for resectable gastric cancer:a systematic review and practice guideline for North America[J].Gastric Cancer,2013,16(1):28-40.
[5] Wagner AD,Grothe W,Haerting J,et al.Chemotherapy in advanced gastric cancer:a systematic review and meta-analysis based on aggregate data [J].J Clin Oncol,2006,24(18):2903-2909.
[6] Shah MA,Ajani JA.Gastric cancer-an enigmatic and heterogeneous disease[J].JAMA,2010,303(17):1753-1754.
[7] Bosman FT,Carneiro F,Hruban RH,et al.WHO classification of tumours of the digestive system[M].Fourth Edition.Lyon:IARC Press,2010:45-58.
[8] Knight LA,Di Nicolantonio F,Whitehouse P,et al.The in vitro effect of gefitinib('Iressa')alone and in combination with cytotoxic chemotherapy on human solid tumours [J].BMC Cancer,2004,4:83.
[9] Ling ZQ,Qi CJ,Lu XX,et al.Heterogeneity of chemosensitivity in esophageal cancer using ATP-tumor chemosensitivity assay[J].Acta Pharmacol Sin,2012,33(3):401-406.
[10] GASTRIC(Global Advanced/Adjuvant Stomach Tumor Research International Collaboration)Group,Paoletti X,Oba K,et al.Benefit of adjuvant chemotherapy for resectable gastric cancer:a meta-analysis[J].JAMA,2010,303(17):1729-1737.
[11] Sakuramoto S,Sasako M,Yamaguchi T,et al.ACTS-GC Group.Adjuvant chemotherapy for gastric cancer with S-1,an oral fluoropyrimidine[J].N Engl J Med,2007,357(18):1810-1820.
[12] Sasako M,Sakuramoto S,Katai H,et al.Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer[J].J Clin Oncol,2011,29(33):4387-4393.
[13] Bang YJ,Kim YW,Yang HK,et al.Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy(CLASSIC):a phase 3 open-label,randomised controlled trial[J].The Lancet,2012,379(9813):315-321.
[14] National Comprehensive Cancer Network.NCCN Clinical Practice Guidelines in Oncology(NCCN Guidelines R):Gastric Cancer.Version 1.2014.[EB/OL]:http://www.nccn.org/professionals/physician_gls/f_guidelines.asp#gastric.2014-06-17.
[15] Japanese Gastric Cancer Association.Japanese Gastric Cancer Treatment Guidelines 2010(ver.3)[J].Gastric Cancer,2011,14(2):113-123.
[16]中华人民共和国卫生部.胃癌诊疗规范(2011年版)[EB/OL]. http://www.nhfpc.gov.cn/zhuzhan/wsbmgz/201304/a70adc5053414844870-2b9f1ab3abcf7.shtml.2014-06-17.
[17] Ugurel S,Schadendorf D,Pfohler C,et al.In vitro drug sensitivity predicts response and survival after individualized sensitivity-directed chemotherapy in metastatic melanoma:a multicenter phase II trial of the Dermatologic Cooperative Oncology Group[J].Clin Cancer Res,2006,12(18):5454?5463.
[18] Moon YW,Sohn JH,Kim YT,et al.Adenosine triphosphatebased chemotherapy response assay(ATP-CRA)-guided versus empirical chemotherapy in unresectable non-small cell lung cancer[J].Anticancer Res,2009,29(10):4243-4249.
[19] Park JY,Kim YS,Bang S,et al.ATP-based chemotherapy response assay in patients with unresectable gastric cancer[J].Oncology,2007,73(5-6):439-440.
[20] Park S,Woo Y,Kim H,et al.In vitro adenosine triphosphate based chemotherapy response assay in gastric cancer[J].J Gastric Cancer,2010,10(4):155-161.
[21] Kim JH,Lee KW,Kim YH,et al.Individualized tumor response testing for prediction of response to Paclitaxel and Cisplatin chemotherapy in patients with advanced gastric cancer[J].J Korean Med Sci,2010,25(5):684-690.
[22] Lee JH,Kim MC,Oh SY,et al.Predictive value of in vitro adenosine triphosphate-based chemotherapy response assay in advanced gastric cancer patients who received oral 5-Fluorouracil after curative resection[J].Cancer Res Treat,2011,43(2):117-123.
[23] Edge SB,Byrd DR,Compton CC,et al.AJCC Cancer Staging Manual[M].Seventh Edition.New York:Spring,2010:117-126.
[24] Talamonti MS,Kim SP,Yao KA,et al.Surgical outcomes of patients with gastric carcinoma:the importance of primary tumor location and microvessel invasion[J].Surgery,2003,134(4):720-727.

