胎盘部位滋养细胞肿瘤一例并文献复习
徐洪海,卢林明
(皖南医学院 病理学教研室,安徽 芜湖 241002)
胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor,PSTT)是一种罕见的妊娠滋养细胞肿瘤,最初被认为是良性并命名为“假瘤”。1981年Twiggs和Scully等发现这种肿瘤具有恶性潜能,可以复发和转移,并首次将其命名为PSTT。我们最近在外检诊断中诊治1例,现结合近几年文献探讨该病的临床特征、病理特点、诊断与鉴别诊断以及预后等,旨在提高对本病的认识,从而正确及时地诊断和治疗,改善患者的预后。
1 资料与方法
1.1 临床资料 患者女性,23岁。1年前剖宫产娩出一活女婴后一直无月经来潮。于2013年6月阴道B超检查发现宫腔内容物,并在当地医院行宫腔镜探查+电切术,术中见宫腔右侧后壁至宫底前壁不规则隆起,范围广,占宫腔近一半容积,质中、暗红色,术后病理诊断为胎盘部位滋养细胞肿瘤,遂来我院进一步诊治。妇科检查示子宫增大如孕2月大,双附件及宫旁组织未见异常。盆腔MRI示子宫体偏右侧斑片状异常信号影,考虑滋养细胞肿瘤可能。临床生化检测血β-人绒毛膜促性腺激素(HCG)为24.66 IU/L(正常值<100 IU/L)。入院后于全麻下行腹腔镜辅助下阴式全子宫+左附件+右输卵管切除术。术中见子宫增大约孕2月大小,右输卵管积水增粗,右卵巢无异常,左卵巢囊性增大直径约4.0 cm,左输卵管无异常。台下剖视子宫标本见病灶位于前壁黏膜下直径约1 cm,侵入肌层深约1 cm。术后随访血HCG正常。
1.2 方法 标本经4%中性甲醛固定,石蜡包埋,4 μm常规切片,HE染色。免疫组化染色采用 PV-9000通用型两步法。所用一抗为PLAP、β-HCG、αinhibin、Vimentin、S-100、CK、EMA、Calponin、Desmin、Ki-67、p53和SMA,试剂均购自福州迈新生物技术公司。
2 结果
2.1 巨检 全子宫一枚,宫体大小约4.0 cm×4.0 cm×2.5 cm,部分已剖开,宫腔右侧后壁至宫底前壁部分区域粗糙呈暗红色,面积约1.8 cm×0.8 cm,从此处剖开,暗红色区域侵及子宫肌层,深度约1.0 cm。
2.2 镜检 肿瘤细胞散在或成片分布于子宫平滑肌间(图1),瘤细胞呈类圆形,体积较大,胞质丰富、透亮、嗜碱性或嗜双色性,细胞核大、染色深,可见双核或多核,核仁较明显,偶见核沟,核分裂像1~2个/10HPF。肿瘤所在部位血管丰富,肿瘤细胞多围绕血管并贴壁生长(图2、3),标本经多切片大范围取材,均未见绒毛组织。
2.3 免疫组化 肿瘤细胞表达 PLAP(图4)、β-HCG 局灶(图 5)、CK(图 6)、EMA、α-inhibin均阳性,Vimentin、S-100、P53、Calponin、Desmin、SMA 均阴性,Ki-67阳性率为60%。
3 讨论
3.1 发病率 PSTT是一种罕见的妊娠滋养细胞肿瘤,赵俊等[1]报道1985~2000年北京协和医院收治妊娠滋养细胞疾病(gestational trophoblastic disease,GTD)1 311例,PSTT仅4例,占 GTD的0.31%,而2000~2005年收治妊娠滋养细胞肿瘤(gestational trophoblastic neoplasm,GTN)635例,其中 PSTT 11例,占 GTN 的 1.73%。Hyman等[2]报道 1996~2012年美国纪念斯隆-凯特琳癌症中心收治的GTD 230例,其中PSTT 17例,占GTD的7.4%。分析发病率上升的原因主要是由于临床医师和病理医师对PSTT认识的提高以及各种诊断手段的合理应用。
3.2 临床特征 PSTT多见于育龄期妇女,中位年龄32 岁左右,潜伏期 3 ~15 个月[2-4],绝经期妇女罕见,偶见男性及幼年患者报道。PSTT多为良性病变,常发生在足月产或流产之后,也可继发于葡萄胎、异位妊娠,偶见合并妊娠患者。其临床表现不典型,多数病人表现为异常阴道出血和(或)闭经,少数可伴有肾病综合征,子宫体积可随肿瘤生长而增大,并有子宫破裂患者报道。约有10% ~15%的患者可出现远处转移,常见的转移部位依次为:肺、大脑、肝脏、脊柱、腮腺[5-6]。
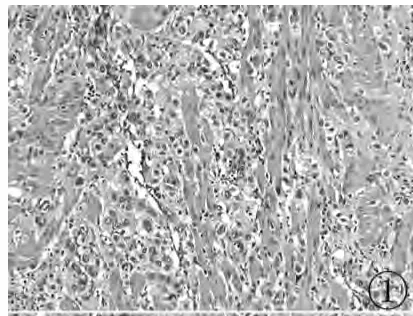
图1 HE染色 放大倍数:×400
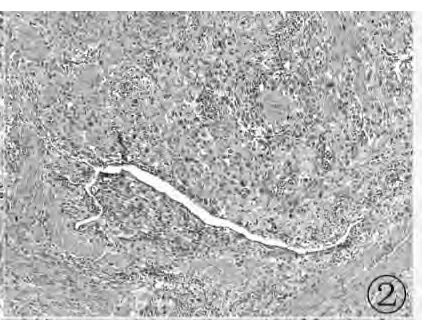
图2 HE染色 放大倍数:×100
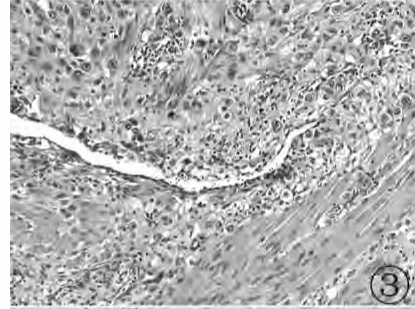
图3 HE染色 放大倍数:×400
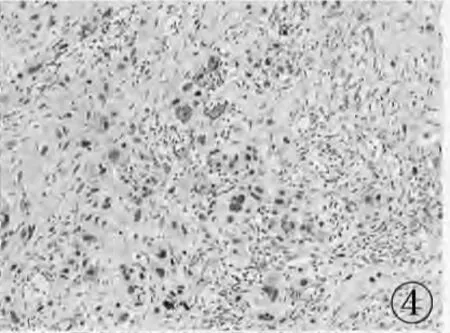
图4 免疫组化标记PLAP(++)

图5 免疫组化标记HCG(局灶+)

图6 免疫组化标记CK(+++)
3.3 病理特征 病理诊断是PSTT诊断的“金标准”。PSTT是中间滋养细胞增生形成的单一形态的肿瘤,肿瘤既可以内生性生长,也可以外生性生长,通常仅仅累及子宫体,但是偶尔延伸到宫颈,更为罕见的病变甚至原发并局限于宫颈[7]。光镜下PSTT由成片或散在分布的单一肿瘤细胞构成,肿瘤细胞多呈圆形、类圆形或梭形,胞质比较丰富,透亮、嗜双色性或嗜酸性。肿瘤细胞多为单核,核稍大,具有核沟、核仁,部分细胞核深染,核分裂像不等,低者每十个高倍视野少于5个,而高者可达20个以上[8]。偶见肿瘤细胞融合形成多核瘤巨细胞。
免疫组织化学研究显示PSTT肿瘤细胞表达上皮源性标志物如EMA和CK,而肌源性标志(SMA、Desmin)以及间叶源性标志(Vimentin)阴性。HPL常阳性,且程度常为中度以上,HCG多散在阳性,但也有阴性报道[3],近期有研究认为持续低水平的HCG提示患PSTT的可能[9]。P53在PSTT中的作用已经越来越受到重视,Nagai等[10]认为P53抑癌基因的失活在PSTT的发生发展过程中发挥着重要的作用,此外α-inhibin、PLAP均可阳性,Ki-67增殖指数的表达也可增加,这也与本例一致。
3.4 诊断与鉴别诊断 由于PSTT发病率较低,临床表现不具备典型特征,因此临床诊断较为困难,主要依靠病理学诊断确诊[4]。PSTT主要与上皮样滋养细胞肿瘤(epithelioid trophoblastic tumours,ETT)、上皮样平滑肌肉瘤、透明细胞癌、血管周上皮样细胞肿瘤、绒毛膜癌、胎盘部位超常反应等进行鉴别诊断。①ETT:Moutte等[11]认为ETT和 PSTT是最难以鉴别的妊娠滋养细胞肿瘤(GTN),ETT主要由单一的中间滋养细胞构成,瘤细胞小而一致,围绕但不破坏血管,可见大片“地图样”坏死,P63阳性;而PSTT镜下边界不清,弥漫穿插于子宫肌层,瘤细胞较ETT大,常侵犯血管并代替血管壁生长,大片坏死少见,P63阴性;②上皮样平滑肌肉瘤:肿瘤细胞胞质透亮,可伴有大片坏死,组织学中可见典型的平滑肌肉瘤区域,肌源性标记(SMA、Des等)阳性,而PSTT阴性且大片坏死区域少见,并可见特征性的血管壁侵犯;③透明细胞癌:原发于子宫的比较少见,瘤细胞呈巢状、条索状排列,可见腺管样结构,无血管壁侵犯,细胞较大、界清、胞质透亮,核卵圆形、核仁明显,肿瘤间质较少,可见较多淋巴细胞、浆细胞浸润,免疫组化CEA阳性、特殊染色PAS强阳性,而PSTT均阴性;④血管周上皮样细胞肿瘤(PEComas):是一种间叶源性肿瘤,肿瘤细胞呈束状或巢状生长,常围绕血管呈放射状排列,但不破坏血管壁,瘤细胞较PSTT小,呈上皮样或梭形,胞浆少、可透明或伴有细颗粒,细胞核小、卵圆形、核仁小,可有核不典型性,PEComas瘤细胞内含黑色素颗粒,免疫组化黑色素标记(HMB-45、S-100)和肌源性标记(SMA、Desmin等)均阳性,而PSTT均阴性;⑤绒毛膜癌:患者的血清 HCG明显升高(>2 000 mU/ml),肿瘤主要由细胞滋养细胞和合体滋养细胞来源的肿瘤细胞混合构成,肿瘤本身没有血管及绒毛,但多围绕宿主血管生长并侵犯血管,因此可伴有明显的出血及坏死,免疫组化 HCG、CK呈强阳性,HPL弱阳性或阴性,而PSTT患者血清HCG可正常且肿瘤细胞较为均一;⑥胎盘部位超常反应:来源于种植部位中间型滋养细胞的良性非肿瘤性疾病,病变范围较小,位置表浅而局限,不形成肿块,无大片坏死和出血,细胞无明显异型性,无核分裂像,HCG阳性,Ki-67指数低,通常经刮宫可去除,而PSTT为肿瘤性疾病,镜下边界不清,肿瘤细胞弥漫穿插于子宫肌层,Ki-67增殖指数常增高。
3.5 预后与治疗 PSTT患者的预后差别较大,主要的预后因素是从已知的最后一次妊娠到此次病变的间隔时间。Schimid等[3]回顾分析了62例PSTT患者,其中与先行妊娠间隔时间>4年的13例PSTT患者均死亡,而49例间隔时间<4年的仅有1例死亡,其预测特异性达93%,敏感性达100%。WHO把滋养细胞肿瘤根据预后指数积分分为高危组和低危组(表1),综合积分>7为高危组患者,预后较差[12]。

表1 WHO预后指数积分计算表
PSTT病程进展缓慢,转移发生较迟,手术仍是治疗PSTT的主要方法。单独采用子宫切除术就可以使2/3的非转移性PSTT患者得到治愈,但子宫切除术对广泛转移的PSTT患者效果较差[13]。一旦发生了转移,则需在手术的基础上联合放化疗。有推荐EMA-EP作为首选方案[14],尤其是转移或复发患者[3],也见 EMA-CO成功治疗 PSTT发生转移者[15],随着有效化疗药物的应用,患者的治疗效果有了明显改善,有报道治愈率可高达90%以上[16]。但总体来说,肿瘤复发及转移发生后病情进展迅速,且易发生耐药,转移性且耐药的PSTT仍然是目前死亡的重要原因[17]。
[1]赵俊,向阳.胎盘部位滋养细胞肿瘤及其诊治[J].实用肿瘤杂志,2008,23(1):5 -7.
[2]HYMAN DM,BAKIOS L,GUALTIERE G,et al.Placental site trophoblastic tumor:analysis of presentation,treatment,and outcome[J].Gynecol Oncol,2013,129(1):58 -62.
[3]SCHMID P,NAGAI Y,AGARWAL R,et al.Prognostic markers and longterm outcome of placental-site trophoblastic tumours:a retrospective observational study[J].Lancet,2009,374(9683):48 -55.
[4]VAN TROMMEL NE,LOK CA,BULTEN H,et al.Long-term outcome of placental site trophoblastic tumor in The Netherlands[J].J Reprod Med,2013,58(5-6):224 -228.
[5]BEHTASH N,ZARCHI MK.Placental site trophoblastic tumor[J].J Cancer Res Clin Oncol,2008,134(1):1 -6.
[6]王昀,孙璐,刘爱军.转移性胎盘部位滋养细胞肿瘤临床病理观察[J].诊断病理学杂志,2012,19(1):42 -45.
[7]肖萍,尹如铁,童龙霞,等.宫颈胎盘部位滋养细胞肿瘤一例并文献复习[J].华西医学,2012,27(3):363 -367.
[8]OHMARU T,YAMAKAWA H,NETSU S,et al.Placental site trophoblastic tumor(PSTT)with multiple metastases and extremely poor prognosis[J].Int J Clin Oncol,2009,14(5):452 -456.
[9]BEHNAMFAR F,MOUSAVI A,REZAPOURIAN P,et al.Placental site trophoblastic tumor,report of a case with unusual presentation[J].Placenta,2013,34(5):460 -462.
[10]NAGAI Y,KAMOI S,MATSUOKA T,et al.Impact of p53 immunostaining in predicting advanced or recurrent placental site trophoblastic tumors:a study of 12 cases[J].Gynecol Oncol,2007,106(3):446-452.
[11]MOUTTE A,DORET M,HAJRI T,et al.Placental site and epithelioid trophoblastic tumours:diagnostic pitfalls[J].Gynecol Oncol,2013,128(3):568 -572.
[12]BERKOWITZ RS,GOLDSTEIN DP.Current management of gestational trophoblastic diseases[J].Gynecol Oncol,2009,112(3):654-662.
[13]赵峻,向阳.妊娠滋养细胞肿瘤治疗中的过度与不足[J].中国实用妇科与产科杂志,2011,27(7):497 -500.
[14]LAN C,LI Y,HE J,et al.Placental site trophoblastic tumor:lymphatic spread and possible target markers[J].Gynecol Oncol,2010,116(3):430 -437.
[15]NAGAI Y,WAKAYAMA A,SUZUKI S,et al.Metastatic placental site trophoblastic tumour successfully treated with hysterectomy and EMA/CO chemotherapy[J].J Obstet Gynaecol,2011,31(1):99-101.
[16]LURAIN J R.Gestational trophoblastic disease Ⅱ:classification and management of gestational trophoblastic neoplasia[J].Am J Obstet Gynecol,2011,204(1):11 -18.
[17]KINGDON SJ,COLEMAN RE,ELLIS L,et al.Deaths from gestational trophoblastic neoplasia:any lessons to be learned[J]?J Reprod Med,2012,57(7-8):293-296.

