海马齿根际降解可溶性蛋白质的研究
杨 芳,李 凯,黄凌风,3*,朱小明
(1.厦门大学海洋与地球学院,福建 厦门361102;2.厦门大学深圳研究院,广东 深圳518057;3.滨海湿地生态系统教育部重点实验室(厦门大学),4.厦门大学环境与生态学院,福建 厦门361102)
植物修复(phytoremediation)是指利用植物及其根际微生物的代谢活动来吸收、积累或降解转化环境中的污染物以达到净化、修复环境的目的.植物修复方式包括植物萃取、根际过滤、植物固定、植物挥发、植物降解和根际降解.其中,根际降解又称为植物-微生物协同修复,是指绿色植物及其共存微生物体系,通过促进植物的根系和根系周围微生物的活性和生化反应,使污染物释放、吸收和转化而降低或去除其毒性,达到净化环境的一种污染治理技术.
植物根际环境存在着胞外酶(extracellular enzymes),胞外酶可能由植物根系释放,也可能由根际微生物分泌.在海洋生态系统中,只有小部分的溶解有机物(DOM)可以直接通过细胞膜被异养微生物所利用,但这远远无法满足微生物的营养需求.约80%~90%的DOM以高聚物(如蛋白质等)的形式存在,但无法被直接吸收利用,只有通过胞外酶的解聚作用才能使它们转变为小分子有机物,从而被异养微生物吸收[1-3].大部分已知的亮氨酸氨基肽酶能以胞外酶的形式出现,并能通过水解那些不能直接穿透进入有机体的多肽和蛋白质,释放出游离的氨基酸,从而供细菌利用.已有的研究表明,胞外酶的分解作用是有机质降解的关键因素,胞外酶活性的大小能从一定程度上反映有机物的降解速率.胞外酶在有机质的矿化过程中发挥着关键作用,控制着生态系统的物质循环,在一定程度上决定着生态系统的净化功能[4].胞外酶活性还可以作为反映水体富营养化程度的指标[5].因此,胞外酶的研究对于全面理解生态系统的物质循环、评估水域环境质量和探讨生态修复机制等都具有重要意义.
海马齿(Sesuvium portulacastrumLinn.)又名滨水菜,为番杏科(Aizonaceae)海马齿属(Sesuvium)植物,是生长在海边沙地或盐碱地的多年生匍匐性肉质草本植物,在我国主要分布于福建、广东、海南、台湾及澎湖列岛的海岸[6],浮床种植海马齿可在海水环境中正常生长.海洋滩涂耐盐植物海马齿作为一种应用于海水生态浮床技术的重要修复植物,其对富营养化水体的氮、磷营养盐和有机质的去除能力已得到了一定的认识和肯定[7],但关于其修复机制,尤其是根圈系统对海水环境中蛋白质等有机质降解的相关酶学机制的研究报道还很少.牛血清白蛋白(bovine serum albumin,BSA)是常用的蛋白质标准品,在可溶性蛋白质含量的测定等蛋白质研究领域中有广泛的应用[8-10].本文报道了水培海马齿对以BSA为代表的可溶性蛋白质的根际降解作用及其与根际微生物胞外水解酶活性有关的影响因素,旨在探讨海马齿根系及其根际微生物在蛋白质等有机质降解中所发挥的重要作用,为更好地利用海马齿生态浮床修复海水环境中的有机氮提供理论依据.
1 材料与方法
1.1 材 料
实验用海马齿植株为本实验室从西沙群岛引种并在温室中通过水培方法建立的植株,培养用水为厦门西海域海水.单株平均鲜质量为(15.0±0.5)g,根系发育良好.
1.2 实验设置
取同一批预培养的海马齿植株,剔除枯黄叶片并清洗后称量,选择长势均匀、鲜质量为每株(15.0±0.5)g的植株,在经0.22μm滤膜过滤并灭菌的海水中暂养7d,以获得含根际微生物的预培养水.
设置了抑菌和不抑菌2组实验,每组又分为种植海马齿的植物组、不种植海马齿的细菌组和空白对照组.每组分别设置3个平行样.
抑菌实验根据 Weinberger[11]的方法采用3种抗生素,分别是氨苄霉素(ampicillin)、头孢噻肟(cefotaxime)和万古霉素(vancomcin),添加质量浓度均为100mg/L.这3种抗生素既可以同时抑制G+和G-菌形成细胞壁,又不会对植物的生理活动产生影响[12].预实验表明该抗生素浓度能抑制水中微生物的繁殖,但不影响植物的正常生长.不抑菌实验不添加抗生素.
每个样品的培养液初始体积是500mL.植物组和细菌组的培养用水是400mL经0.22μm滤膜过滤的灭菌海水和100mL根际预培养水混合而成.对照组的培养用水是400mL经0.22μm滤膜过滤的灭菌海水和100mL经0.22μm滤膜过滤并灭菌的根际预培养水混合而成.每组加入营养盐以满足植物生长的需要,各种营养盐按照Hoagland配方添加.
不抑菌实验中,对照组用于反映非生物因素在蛋白质降解中的作用,细菌组用于反映根际细菌和非生物因素在蛋白质降解中的作用,植物组用于反映植物、根际细菌和非生物因素在蛋白质降解中的作用.抑菌实验中的植物组用于反映植物根系和非生物因素在蛋白质降解中的作用.利用差减法计算的结果可以分别显示植物与根际细菌联合作用、植物根系以及根际细菌对蛋白质根际降解的贡献率.
实验装置由柱状玻璃容器(Ф:5.0cm,L:30 cm)、日光灯光源和取样管组成.柱状玻璃容器外表面和瓶口紧密包裹铝箔,以防止外源微生物污染、蛋白质的光解和藻类的生长.日光灯置于柱状玻璃容器上方约50cm 处,在室温(28±2)℃,12h光照(6 000lx)和12h黑暗交替条件下培养.为了减少取样时根际水体的扰动,用一次性无菌注射管作为取样管,放置于柱状玻璃瓶中,外用橡皮筋固定,并用止水夹保持培养体系密闭以防止外源微生物污染和工作液中溶解氧的改变.
每隔12h取样一次,每次取样时用一次性注射管吸取10mL水样用于BSA浓度、细菌密度和亮氨酸氨基肽酶活性的测定.分别在36和72h取样后,再次添加BSA(质量浓度为10mg/L)、Hoagland营养盐和3种抗生素(质量浓度均为100mg/L,仅在抑菌实验组中添加).
1.3 主要分析指标和方法
1.3.1 BSA含量的测定
采用考马斯亮蓝法.取125mg考马斯亮蓝G-250充分溶解在100mL 95%(体积分数)的乙醇中,另取15mL 37%(质量分数)的 HCl和5.06g NaCl溶解在适量水中后,与考马斯亮蓝乙醇液混合并定容至1 000mL,用0.45μm 滤膜过滤,即为显色液.测定时,取5mL显色液与1mL水样混合,放置5min后用Spectum 756PC型紫外可见分光光度计在波长595nm下测定吸光值.
同时,配制质量浓度为0,2,4,6,8,10,12,14,16,18,20μg/mL的BSA溶液,绘制标准曲线.
1.3.2 亮氨酸氨基肽酶活性的测定
采用荧光模拟底物法(fluorogenic model substrate,FMS)[13].如图1所示,荧光模拟底物包含一个荧光生色团和一个小分子,荧光生色团采用4-甲基-7-氨基香豆素(MCA),小分子为氨基酸,两者之间通过肽键相连.在氨基肽酶的作用下,复合分子发生断裂,荧光基团显色.胞外酶的活性越高,复合分子断裂的越多、越快,因此荧光强度越高.这种模拟底物的胞外酶水解作用符合米氏方程,检测限低,适合短时间条件下的胞外酶测定.该方法以其高度的灵敏度已经广泛应用于各种水体的胞外酶活性测定中[14-17].

图1 荧光模拟底物水解方程式Fig.1 Reaction equator of model substrate
标准曲线的绘制:配制100μmol/L MCA的乙二醇单甲醚溶液,再用过滤灭菌海水稀释成0.000 5,0.001,0.002 5,0.005,0.007 5,0.01,0.025,0.05,0.075,0.1,0.25,0.5,0.75,1μmol/L 14个浓度的溶液.用岛津RF5301PC荧光分光光度计迅速测定各溶液的荧光强度.MCA激发光和发射光的波长分别为380和440nm.狭缝宽Ex=3nm,Em=3nm.
酶活性的测定方法如下:移取3mL水样到5个5 mL的冻存管中(2个空白样和3个平行样),立即往平行样中加入0.5mmol/L荧光模拟底物工作液120 μL,使其终浓度为20μmol/L;同时在空白样中加入80μL浓度为100mmol/L的HgCl2溶液使胞外酶失活,在20℃下避光培养2h.培养结束后在空白样中加入等量的荧光模拟底物工作液,并用HgCl2溶液终止平行样中的反应.用岛津RF5301PC荧光分光光度计迅速测定样品的荧光强度.按下式计算水样中的胞外酶活性:

式中,V 为胞外酶水解底物的速率(μmol/(L·h));F为平行样品的荧光强度(平均值,μmol/L);Fb为空白样品的荧光强度(平均值,μmol/L);S为单位浓度标准荧光物质的荧光强度(S=79.807),即标准工作曲线的斜率;t为培养时间(h).
1.3.3 细菌密度测定
采用DAPI染色的荧光显微计数法[18],测定前将孔径为0.22μm的硝酸纤维滤膜用苏丹黑B染液(500mg Sudan Black B溶于200mL 2%(质量分数)乙酸中)染色4h以上,使之变黑.取1mL水样加入2 mL灭菌离心管中,加入40μL 25%(体积分数)戊二醛溶液固定,再加入20μL DAPI染液(质量浓度为20 μg/mL),避光染色5min后,在小于7 093Pa负压下过滤,滤干后取滤膜制片,用Leica DM 4500B型荧光显微镜进行荧光显微计数.按下式计算水样中的细菌密度
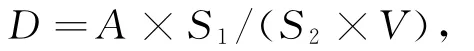
式中,D为细菌密度(mL-1);A 为10个视野的细菌平均数(cell);S1为视野面积(cm2);S2为滤膜的有效过滤面积(cm2);V 为过滤水样体积(mL).
1.4 数据分析
测量数据取3次重复的平均值,数据用Origin 8.1和SPSS 16.0软件进行分析,处理组间差异的显著性采用最小显著差异(least significant difference,LSD)检验法进行检验.
2 结果与分析
2.1 BSA的降解
不抑菌实验中,每次添加蛋白质后,植物组的蛋白质浓度下降最快(图2).细菌组的变化趋势与对照组相似,并且其水体中蛋白质浓度都是随着添加次数的增多而逐渐积累升高.36h后,植物组、细菌组和对照组蛋白的平均降解率分别是97%、41%和26%,细菌组的蛋白降解率低于植物组.利用差减法扣除非生物因素作用(26%),海马齿与根际微生物联合作用下的降解率(71%)是根际微生物作用(15%)的4.73倍.表明单独的根际微生物可以降解蛋白质,但是其降解率不高,要实现蛋白质的高效降解必须以海马齿根系为依托.
在抑菌实验中,植物组、细菌组和对照组的变化趋势一致,都是随着添加次数的增多,蛋白质浓度逐渐升高(图3).植物组并没有表现出明显高于其他组的降解效率.表明单独的海马齿根系无法实现蛋白质的高效降解.蛋白质的浓度在每次添加后期有所升高,呈现“V”型的变化特点,推测原因可能是部分吸附在瓶壁上的蛋白质由于室温变化等原因发生了解吸,导致后期浓度有所上升.
以上结果说明,单独的根际微生物或海马齿根系都无法实现蛋白质的高效降解.海马齿根系与根际微生物联合在蛋白质的根际降解中发挥着极为重要的作用.
2.2 BSA降解过程中细菌密度的变化

图2 不抑菌实验中BSA质量浓度随时间的变化Fig.2 Changes of BSA concentration in the experiment groups without antibiotic addition
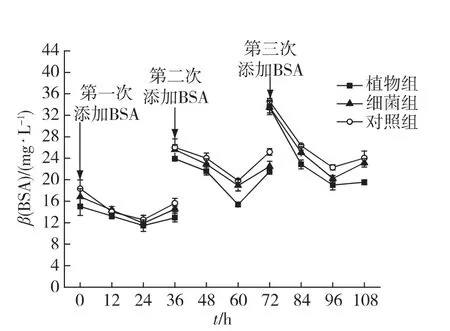
图3 抑菌实验中BSA质量浓度随时间的变化Fig.3 Changes of BSA concentration in the experiment groups with antibiotic addition
在不抑菌实验中,在0到36h内,植物组蛋白质的高效降解为细菌生长提供营养,其细菌密度的增长速度明显快于细菌组.植物组和细菌组的细菌密度基本都是呈现初期快速增长、中期下降和后期基本稳定的单峰型变化趋势(图4).而整个实验过程中,对照组没有检测到细菌的存在,可以有效反映非生物因素的作用.
在抑菌实验中,对照组没有检测到细菌的存在.植物组和细菌组的细菌密度基本都呈下降趋势(图5),细菌密度分别从开始时的3.0×105和2.8×105mL-1逐渐下降到结束时的0.7×105和0.5×105mL-1,其数量与不抑菌实验相比,可以忽略不计.表明实验所采用的抗生素可以有效抑制细菌数量的增长,抑菌实验中的植物组可以较好地反映单纯海马齿根系在蛋白质降解中的作用.
2.3 BSA降解过程中亮氨酸氨基肽酶活性的变化

图4 不抑菌实验中细菌密度随时间的变化Fig.4 Changes of bacterial density in the experiment groups without antibiotic addition

图5 抑菌实验中细菌密度随时间的变化Fig.5 Changes of bacterial density in the experiment groups with antibiotic addition
在抑菌实验中,虽然细菌组和植物组的细菌密度在0~12h时可达105mL-1,但是对照组、细菌组和植物组都没有检测到亮氨酸氨基肽酶活性,表明抑菌实验的抗生素抑菌效果良好,细菌活性受到了全面抑制,而单纯的海马齿根系不分泌亮氨酸氨基肽酶.由此可以推断,在不抑菌实验中检测到较高活性的亮氨酸氨基肽酶完全是由根际微生物所分泌.
不抑菌实验中,对照组没有检测到亮氨酸氨基肽酶活性,只有植物组和细菌组有明显的酶活(图6).这2组的酶活性变化趋势较为相似,而植物组的酶活性始终高于细菌组.实验开始的24h内,植物组的酶活性急剧上升,24h时达到最高值0.75μmol/(L·h),此后酶活性呈下降趋势,到实验结束时,酶活性下降到0.22μmol/(L·h).细菌组的酶活性最高值出现在60 h,达到0.43μmol/(L·h),在实验结束时,酶活性检测不到.从整体上看,植物组和细菌组的酶活性也是基本呈现先升高后降低的趋势.
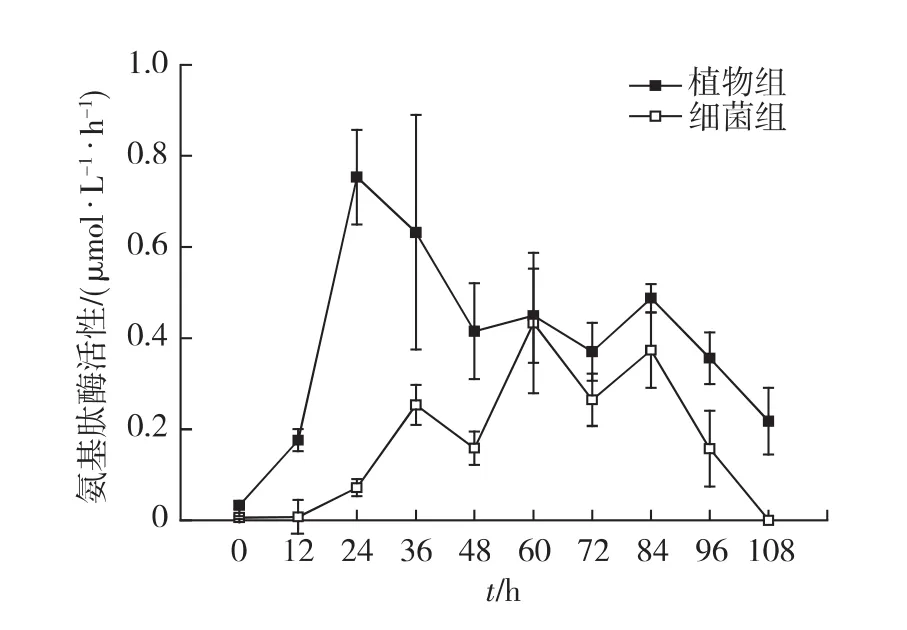
图6 不抑菌实验中亮氨酸氨基肽酶活性随时间的变化Fig.6 Changes of leucine amino peptidase activity in the experiment groups without antibiotic addition
与细菌组相反,植物组的酶活性最高值出现时间(24h)早于细菌密度最高值(36h).说明在海马齿根系和根际微生物联合作用下,植物组蛋白质的高效降解过程伴随着酶活性的升高和细菌密度的增加,且酶活性的升高先于细菌数量的增长.
3 讨 论
抑菌实验中的植物组没有检测出亮氨酸氨基肽酶活性,表明该蛋白酶完全由根际微生物分泌,海马齿根系不分泌该种胞外酶.大部分水环境中的研究表明亮氨酸氨基肽酶活性主要是由异养细菌产生的[19-21].而也有研究者认为蛋白酶可以由植物根系释放,如Gramms等[22]研究发现,豆科、禾本科和茄科的一些植物种类能够向根系区域大量释放氧化酶和水解酶,这些酶包括蛋白酶、过氧化物酶、漆酶、单酚氧化酶、脂肪酶以及酯酶等.另有研究表明,亮氨酸氨基肽酶是植物体内广泛存在的一种金属蛋白酶[23],可以有效切割N端的亮氨酸、精氨酸和蛋氨酸残基[24],可能对蛋白半衰期具有重要的调节作用,关系细胞的生长和凋亡[25].
从整体上看,不抑菌实验中的植物组和细菌组的酶活基本呈现先升高后降低的趋势,这一趋势基本上符合目前比较流行的胞外酶活性调控机制——“抑制-诱导”假说[26-27].该学说认为当海水中存在大量初级代谢产物以及光合作用产物时,这些易于被吸收利用的低分子质量产物(UDOM)容易进入细胞内,以维持细菌的正常生长及新陈代谢.同时这些UDOM(如氨基酸、单糖和有机酸等)限制了胞外酶的活性(产物抑制)并且抑制了酶的合成(代谢抑制).而当海水中的UDOM降低到临界值,藻类细胞通过裂解释放出大量的高分子化合物(如蛋白质、多糖、酯类或核酸等)时,胞外酶的抑制被解除,酶活性显著升高.
在不抑菌实验中,植物组的酶活性最高值和细菌密度最大值的出现时间均早于细菌组,并且植物组的酶活始终高于细菌组.表明海马齿根系可以促进根际细菌的生长和亮氨酸氨基肽酶活性的升高.也有其他研究证实植物根系可以增强根际胞外酶活性[28-30],如棉花、小麦、水芹、西红柿和水葫芦等植物能向根际环境中提供氨基酸、糖类和维生素等养料,改善根际微生态环境,间接促进胞外酶活性的升高.
由于亮氨酸氨基肽酶完全由根际细菌分泌,根际细菌在蛋白质的根际降解过程中起着主要的作用,但是不抑菌实验的细菌组的降解率不高且明显低于植物组,说明根际细菌的高效降解必须以海马齿根系为依托.海马齿根系和根际细菌的协同作用使得蛋白质的降解效率明显提高,其原因一方面可能是植物可以通过根系将氧气释放进入水体,保证微生物有充足的氧气对蛋白质进行降解.另一方面是根系分泌物可以改变根系周围环境的pH值[31]、可能为微生物提供共代谢的底物[32-33].许多实验已经证实,向土壤中添加根系分泌物同样能刺激微生物的活性.Abdel-Nasser[34]证实向土壤中添加人工合成的大麦根系分泌物可以刺激土壤中放线菌、真菌和细菌的数量.向土壤中添加燕麦的根系分泌物可以促进菲的降解[35],而向土壤中添加玉米的根系分泌物可以显著提高14C-芘的矿化率[36].由此可以看出根系分泌物在有机物根际降解中的重要作用.
4 结 论
1)本研究的不抑菌实验结果表明海马齿的根际微生物具有降解蛋白质的能力,其降解效率在有植物根系存在时明显高于无根系时的降解效率,说明植物根系对于根际微生物降解蛋白质有重要促进作用.
2)抑菌实验表明氨苄霉素-头孢噻肟-万古霉素的抗生素组合能有效抑制海马齿根际微生物的生长.在有效抑菌的情况下,整个实验过程中,植物组与细菌组都未检测到亮氨酸氨基肽酶的活性,说明能高效降解可溶性蛋白质的亮氨酸氨基肽酶完全来源于根际微生物,而非由海马齿根系所分泌.
3)以上表明,在可溶性蛋白质的根际降解中,根际细菌是降解的执行者,但是根际细菌的高效降解是以植物根系为依托的,植物根系和根际细菌构成互惠共生的关系.这为更好利用海马齿生态浮床修复富含有机氮的海水环境提供了理论依据.
[1]郑天凌,王斐,徐美珠,等.台湾海峡水域的β-葡萄糖苷酶活性 [J].应用与环境生物学报,2001,7(2):175-182.
[2]Hoppe H.Use of fluorogenic model substrates for extracellular enzyme activity(EEA)measurement of bacteria[M]∥ Handbook of methods in aquatic microbial ecology.Boca Raton:Lewis Publishers,1993:423-431.
[3]王斐,郑天凌,洪华生.细菌胞外酶的生态作用 [J].海洋科学,1999,3(3):33-36.
[4]Sinsabaugh R,Antibus R,Linkins A,et al.Wood decomposition:nitrogen and phosphorus dynamics in relation to extracellular enzyme activity [J].Ecology,1993,74(5):1586-1593.
[5]Wright R R,Hobbie J E.Use of glucose and acetate by bacteria and algae in aquatic ecosystem [J].Ecology,1966,47:447-464.
[6]唐昌林.中国植物志[M].北京:科学出版社,1996:30-32.
[7]张志英,黄凌风,姜丹,等.浮床种植海马齿对富营养化海水氮、磷移除能力的初步研究 [C]∥中国环境科学学会2009年学术年会论文集.北京:北京航空航天大学出版社,2009:50-55.
[8]陆建良,梁月荣,张凌云.考马斯亮蓝法在茶汤可溶性蛋白含量分析中的应用和改良 [J].茶叶,2002,28(2):89-93.
[9]曲春香,沈颂东,王雪峰,等.用考马斯亮蓝测定植物粗提液中可溶性蛋白质含量方法的研究 [J].苏州大学学报:自然科学版,2006,22(2):82-85.
[10]袁燕,段玲燕,郭丽红,等.BCA法测定新的植物毒素——蒜头果蛋白质量浓度 [J].昆明学院学报,2009,31(3):60-61.
[11]Weinberger F,Hoppe H,Friedlander M.Bacterial induction and inhibition of a fast mecrotic response in Gracilaria conferta (Rhodophyta)[J].Journal of Applied Phycology,1997,9(3):277-285.
[12]de Souza M,Chu D,Zhao M,et al.Rhizosphere bacteria enhance selenium accumulation and volatilization by Indian mustard [J].Plant Physiology,1999,119(2):565-574.
[13]宋福行,焦念志.细菌胞外酶活性的调控因素 [J].海洋科学,2001,25(9):16-18.
[14]Martinez J.Variability in ecohydroytic enzyme activities of pelagic marine bacteria and its significance for substrate processing in the sea[J].Aquatic Microbial Ecology,1996,10(4):223-230.
[15]Hoppe H.Significance of exoenzymatic activities in the ecology of brackish water:measurements by means of methylumbelliferyl-substrates[J].Marine Ecology Pro-gress Series,1983,11(1):299-308.
[16]Ecology A.Coupling between bacterioplankton species composition,population dynamics,and organic matter degradation[J].Aquatic Microbial Ecology,1999,17(1):13-26.
[17]Hoppe H,Kim S,Gocke K.Microbial decomposition in aquatic environments:combined process of extracellular enzyme activity and substrate uptake[J].Applied and Environmental Microbiology,1988,54(3):784-790.
[18]郑天凌,王斐,徐美珠,等.台湾海峡海域细菌产量、生物量及其在微食物环中的作用[J].海洋与湖沼,2002,33(4):415-423
[19]Rosso A L,Azam F.Proteolytic activity in coastal oceanic waters:depth distribution and relationship to bacterial populations[J].Marine Ecology Progress Series,1987,41:231-240.
[20]Jacobsen T R,Rai H.Determination of aminopeptidase activity in lakewater by a short term kinetic assay and its application in two lakes of differing eutrophication[J].Archiv Fur Hydrobiologie,1988,113:359-370.
[21]Fabiano M,Danovaro R.Enzymatic activity,bacterial distribution,and organic matter composition in sediments of the Ross Sea (Antarctica)[J].Applied and Environmental Microbiology,1998,64:3838-3848.
[22]Gramss G,Voigt K D,Kirsche B.Oxidoreductase enzymes liberated by plant roots and their effects on soil humic material [J].Chemosphere,1999,38 (7):1481-1494.
[23]Bartling D,Weiler E W.Leucine aminopeptidase from Arabidopsis-thaliana-molecular evidence for a phylogenetically conserved enzyme of protein-turnover in higher-plants [J].European Journal of Biochemistry,1992,205(1):425.
[24]Gu Y Q,Walling L L.Specificity of the wound-induced leucine aminopeptidase (LAP-A)of tomato-activity on dipeptide and tripeptide substrates[J].European Journal of Biochemistry,2000,267(4):1178.
[25]Varshavsky A.The N-end rule:functions,mysteries,uses[J].Proceedings of The National Academy of Sciences of the United States of America,1996,93(22):12142.
[26]Chróst R.Characterization and significance ofα-glucosidase activity in lake water[J].Limnology and Oceanography,1989,34(4):660-672.
[27]Chróst R.Microbial enzyme in aquatic environments[M]∥Aquatic microbial ecology,biochemical and molecular approaches.New York:Springer,1990:47-79.
[28]李传荣,许景伟,宋海燕,等.黄河三角洲滩地不同造林模式的土壤酶活性 [J].植物生态学报,2006,30(5):802-809.
[29]Garcia C,Roldan A,Hernandez T.Ability of different plant species to promote microbiological processes in semiarid soil[J].Geoderma,2005,124(1/2):193-202.
[30]Siegel B.Plant peroxidases:an organismic perspective[J].Plant Growth Regulation,1993,12(3):303-312.
[31]Dakora F,Phillips D.Root exudates as mediators of mineral acquisition in low-nutrient environments[J].Plant and Soil,2002,245(1):35-47.
[32]Shann J.The role of plants and plant/microbial systems in the reduction of exposure[J].Environmental Health Perspectives,1995,103(Sup.5):13-15.
[33]Walton B,Anderson T.Microbial degradation of trichloroethylene in the rhizosphere:potential application to biological remediation of waste sites [J].Applied and Environmental Microbiology,1990,56(4):1012-1016.
[34]Abdel-Nasser M,Moawad Hassan.Changes in numbers of microorganisms during decomposition of root exudates in soil[J].Zentralbl Bakteriol Parasitenkd Infektionskr Hyg,1975,130(8):738-744.
[35]Miya R,Firestone M.Enhanced phenanthrene biodegradation in soil by slender oat root exudates and root debris[J].Journal of Environmental Quality,2001,30(6):1911-1918.
[36]Yoshitomi K J,Shann J R.Corn(Zea mays L.)root exudates and their impact on14C-pyrene mineralization[J].Soil Biology and Biochemistry,2001,33(12/13):1769-1776.

