衰变加速因子在神经病理性疼痛中的作用
朱海娟,王金保
(解放军白求恩国际和平医院,河北石家庄050082)
前期研究证实神经病理性疼痛(CNPP)大鼠脊髓背角发生补体异常活化,并且证实此处活化的补体蛋白在模型动物痛觉过敏的形成和发展中发挥重要作用[1]。那么,衰变加速因子(DAF,CD55)作为重要的补体调节蛋白,它在NPP的发病过程中是否发挥作用呢?本研究制作2种NPP大鼠模型(CCI、SNI),采用热刺激和机械刺激两种手段评估模型的可靠性后,于建立模型第7天,采用Western-blot和免疫组织化学染色两种技术测定大鼠脊髓中的DAF蛋白表达变化,旨在为NPP大鼠脊髓背角补体激活寻找“激发点”。
1 实验资料
1.1 实验动物及分组 成年健康SD大鼠,雄性,体质量200~250 g,河北医科大学动物实验中心提供。每4只饲养于一笼中,笼底铺有锯末,室温(20±2)℃,严格12 h明暗交替光照,给予充足的水源和饲料。适应环境1周后进行实验。所有实验均在白天进行,大鼠的使用和喂养严格遵照河北医科大学伦理委员会和动物保护协会所规定的有关条款。60只大鼠随机分为假手术组(A组)、CCI组(B组)及SNI组(C组)3组,每组20只。按照分组进行处理后,分别在术前(t0)、术后1 d(t1)、术后3 d(t2)和术后7 d(t3)进行痛阈值测定,于术后7 d处死大鼠取L4—6段脊髓背角,测定CD55蛋白含量。
1.2 主要仪器和试剂 仪器:RTY-1型热痛刺激仪,第四军医大学生理教研室研制;BME-403型Von frey机械刺激仪,中国医学科学院生物工程研究所提供;BB16uv型CO2恒温培养箱,德国Heraeus公司生产;恒温摇床,重庆医用器材厂生产;Gel Doc2000凝胶成像分析系统,美国Bio-Rad公司生产。试剂:兔抗大鼠CD55多克隆抗体(CD55(H-319),批号:sc-9156),美国Santa Cruz公司生产;辣根酶标记的山羊抗兔IgG(H+L)亲和纯化二抗,购自北京中山生物技术有限公司。
1.3 CCI、SNI模型的制作 参考文献[2]制作CCI和SNI模型。CCI模型:大鼠俯卧位捆绑,从后肢上部切开皮肤,分离肌肉,暴露坐骨神经主干,使用羊肠线环绕坐骨神经,单结固定,环绕的羊肠线应能够在坐骨神经主干上滑动。SNI模型:于大鼠后肢上缘切开皮肤,分离肌肉,暴露坐骨神经主干及其下的分支—胫神经、腓总神经和腓肠神经,结扎并剪断胫神经和腓总神经,保留细小的腓肠神经,应避免任何损伤。
1.4 行为学测定
1.4.1 热痛阈测定 用RYT-1型热痛刺激仪测大鼠热缩足潜伏期(PWTL)。按 Hargeaves等[3]方法,于 8:00—12:00测定,先将大鼠在热刺激仪的玻璃操作台上适应5 min,调节光强度,单次照射时间不超过30 s,以免造成热辐射损伤,每肢照射3次,取其平均值。为避免或减少1次刺激对随后刺激效应造成的影响,同一部位刺激的间隔时间为5 min。
1.4.2 机械痛阈测定 参照Dixon[4]的方法:将大鼠置于升高的金属网上,并盖以透明的有机玻璃罩,适应20 min,用不同压力的纤维丝(从小到大)垂直刺激其足底2,3跖趾间皮肤敏感处,逐渐加压使之成为S形持续6~8 s,观察是否出现缩足反应,大鼠在刺激时间内或在移开von frey纤维时立即出现快速的缩足反应,记为阳性反应,而身体活动所引起的缩足反应不记作阳性反应。每次间隔5 s,连续10次,诱发4~6次缩足反应作为50%反应率,其压力值即为阈值。
1.5 免疫组织化学染色 采用SP法对大鼠脊髓标本进行免疫组化染色。腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉后,经左心室灌注200 mL生理盐水和300 mL 4%多聚甲醛溶液,充分固定后,纵向剖开椎管,取脊髓L4—6阶段组织,固定24 h,经脱水、透明、浸蜡包埋后,切片机连续切片厚度为4 μm。石蜡切片经二甲苯透明,常规梯度乙醇脱蜡,浸入0.01 mol/L,pH 6.0枸橼酸盐溶液中,加热至98℃后进行抗原修复,30 min后冷却至室温,3%H2O2去离子水室温孵育20 min,正常兔血清封闭液室温孵育20 min。滴加一抗(兔抗大鼠CD55多克隆抗体)4℃孵育过夜,同时用PBS代替一抗作为阴性对照。PBS液充分洗涤后,加入二抗(辣根酶标记兔抗山羊IgG)37℃孵育30 min。DAB显色,苏木精复染,透明、封片。在OLYPUS显微镜下观察,胞膜和胞质中有棕黄色颗粒者为阳性细胞。
1.6 Western-blot检测 于术后7 d处死大鼠取L4—6段脊髓背角,采用Western-blot技术测定CD55蛋白含量。取每样40 μg蛋白样品按常规方法完成8%(w/v)SDS-PAGE电泳,将含有目的蛋白和内标actin的凝胶切割,并经半干法电转移至聚偏(二)氟乙烯(PVDF)膜上。印迹膜片用5%脱脂奶粉封闭1 h,大膜片加入抗大鼠CD55单克隆抗体,小膜片加入羊抗actin抗体,4℃过夜。用 Tris/0.05%吐温 -20(TBST)洗膜(5 min×3),加入辣根过氧化物酶(HRP)标记二抗(山羊抗鼠IgG),37℃孵育1 h,TBST充分洗膜(5 min×3),TBS洗膜10 min。最后印迹膜片与强化学发光试剂ECL温浴1 min,X线胶片曝光30~60 s,经显影和定影显示特异的蛋白信号。大膜片经膜再生液再生(37℃孵育30 min)后孵育鼠抗NR2B抗体,程序同前。信号条带扫描后,用Quantity one 4.5.0图像分析软件进行定量分析。
2 结 果
2.1 各组大鼠痛阈值情况 与术前相比,术后1 d 3组大鼠PWTL和PWMT都有所降低,但B组、C组较A组更明显(P<0.05)。术后3,7 d CCI组SNI组大鼠痛阈值持续降低,而A组大鼠痛阈值逐渐恢复到术前水平。见表1。
2.2 脊髓背角免疫组织化学染色结果 A组脊髓背角阳性细胞明显多于B组和C组,B组和C组相比无显著性差异。见图1~3。
表1 各组大鼠痛阈比较(±s)

表1 各组大鼠痛阈比较(±s)
注:①与 t0相比,P <0.05;②与 A 组相比,P <0.05。
组别 n PWT/s t0 t1 t2 t 3 PWM/g t0 t1 t2 t 3 A 组 20 17.3 ±2.5 13.7 ±1.7① 16.6 ±2.3 16.8 ±2.2 14.2 ±1.9 9.5 ±3.1①13.8 ±2.8 13.7 ±2.5 B 组 20 17.5 ±1.9 12.8 ±3.2① 11.6 ±2.1①② 11.9 ±3.0①② 14.8 ±3.2 7.6 ±1.9① 8.8 ±2.5①② 8.2 ±1.4①②C 组 20 17.7 ±2.9 14.0 ±2.2① 12.8 ±1.8①② 13.4 ±3.5①② 13.9 ±2.0 7.8 ±1.5① 7.4 ±2.2①② 7.8 ±1.7①②
2.3 3组Western-blot实验结果 采用Western-blot技术检测了3组大鼠脊髓背角CD55的表达情况。用Quantity one 4.5.0图像分析软件分析,β-actin条带的积光分密度(IOD)一致,反映了总蛋白上样量一致,B组、C组大鼠脊髓背角CD55表达量较A组显著降低。见图4。
3 讨 论
衰变加速因子是一种补体调节蛋白,可制止补体级联反应,保护自身细胞免受伤害。近来研究表明,DAF通过表达的改变,逃避机体免疫监视,在肿瘤形成中发挥重要作用[5-6]。那么,在NPP形成过程中脊髓背角发生异常的补体活化,许多补体蛋白表达发生改变,DAF的表达是否发生变化?它的表达改变在NPP的发生发展中发挥什么样的作用呢?
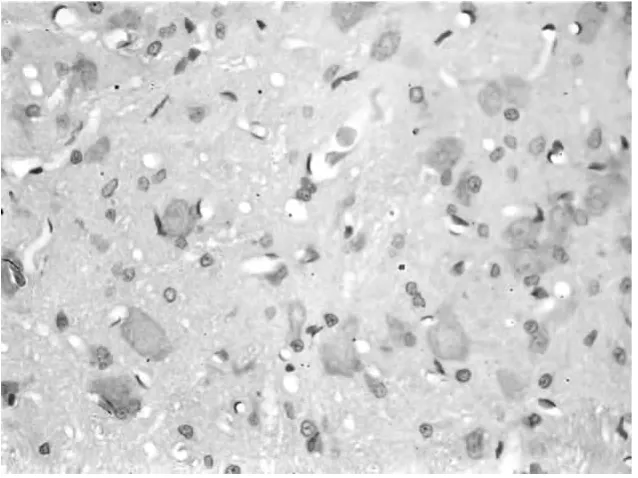
图1 A组大鼠脊髓背角CD55阳性细胞表达情况
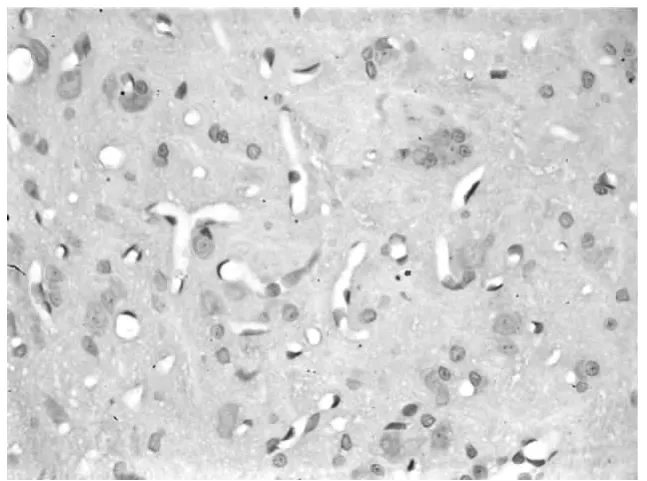
图2 B组大鼠脊髓背角CD55阳性细胞表达情况

图3 C组大鼠脊髓背角CD55阳性细胞表达情况
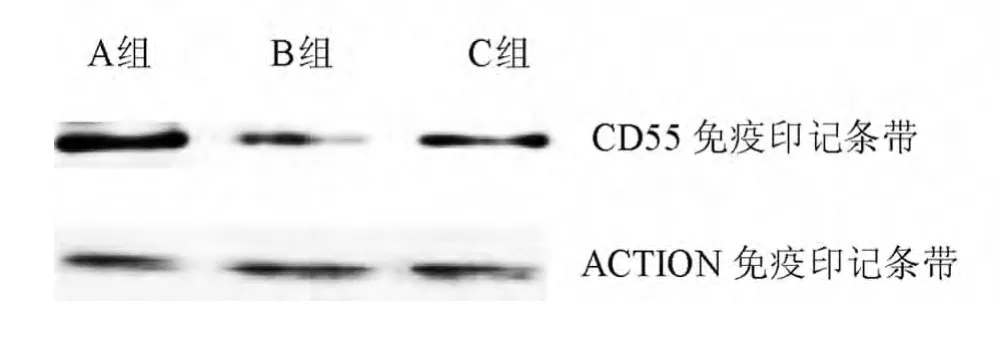
图4 不同处理组大鼠脊髓背角CD55蛋白的表达情况
本研究建立了2种NPP模型,采用测定大鼠痛阈值可靠技术-冷刺激方法和机械刺激方法评估动物模型的稳定性后,于术后第7天处死大鼠,采用免疫组织化学技术和免疫印迹技术2种手段对模型大鼠脊髓中的CD55进行检测。结果显示,2种不同外周神经损伤模型脊髓中CD55在建模后表达发生了不同程度的降低,与假手术组比较有显著性差异。这个结果与笔者前期研究NPP时脊髓背角发生级联反应是一致的[1]。那么,CD55是如何在NPP的形成中发挥作用的呢?外周神经损伤时,脊髓背角胶质细胞活化,表达补体蛋白量增加,进而触发级联反应[7]。正常情况下,由于细胞膜上表达的CD55分子可干扰C3转化酶和C5转化酶,以致不能形成膜攻击复合,补体级联反应被阻断,保护自身细胞免受补体的活化和攻击。当CD55缺乏或表达下调时,补体级联反应得以实现,膜攻击复合物大量形成。此处的神经元不断遭受补体蛋白的攻击,内部结构发生改变,从而将伤害性信号上传中枢,经过中枢的信息分析和整合,表现为痛觉过敏和异常疼痛。因此,可以推测,NPP模型大鼠脊髓中CD55的表达下降可能是此处发生补体异常活化的原因,至少是触发因素之一。
关于CD55在NPP中的研究目前还比较少,本研究只是为探索NPP发病机制提供一个思路。相信随着研究的深入,NPP必将为人类所攻克。
[1]王金保,王琪,聂发传,等.脊髓补体C3蛋白在大鼠神经病理性痛维持中的作用[J].中华麻醉学杂志,2008,28(1):49-52
[2]金小高,罗爱林,王金韬,等.脊髓神经元和胶质细胞激活在三种神经病理性疼痛大鼠模型脊髓水平致痛机制的作用[J].中华麻醉学杂志,2006,26(1):71 -74
[3]Hargeaves K,Dubner R,Brown F,et al.A new and sensitive method for mearing thermal nociception in cutaneous hyperalgesia[J].Pain,1988,32(1):77 -78
[4]Dixon WJ.Efficient analysis of experimental observation[J].Ann Rev Pharmacol Toxicol,1980,20:441 -462
[5]张海谱,单保恩,艾军,等.ALDHI和CD55表达在乳腺癌预后评估中的意义[J].解放军医学杂志,2010,35(1):20-23
[6]王芹,张玲,张维东,等.胃癌组织衰变加速因子表达及其临床意义的研究[J].中华肿瘤防治杂志,2008,15(9):683-686
[7]Robert SG,Michael C,Gary JB,et al.Complement induction in spinal cord microglia results in anaphylatoxin C5 a-Mediated pain hypersensitivity[J].J Neurosci,2007,27(32):8699 - 8708

