阿尔茨海默病临床前期患者的感觉门控能力
梁 超 王朝阳 武 鑫 闫治丰 张 磊
轻度认知功能障碍(MCI)是介于正常老龄化和痴呆之间的一种认知功能损害状态,被认为是阿尔茨海默病(AD)患者的临床前期阶段,但尚未达到AD 的诊断标准[1]。大量研究显示,MCI 患者存在高风险转化为AD 的可能[2-3]。感觉门控(SG)是大脑一种正常功能,指大脑能抑制无关的感觉刺激输入。广义的解释为大脑对传入感觉刺激敏感性的调节能力[4]。此过程通过滤掉无关刺激使大脑更高级的功能不被感觉刺激所超载。感觉门控的缺损能导致无关刺激超载,大脑受到大量无关刺激的超载可导致与注意有关的各种症状。国内外己有报道MCI 存在多模态认知功能受损[5],但是感觉门控能力未见报道。根据神经认知心理学信息加工理论,感觉门控能力高级认知加工的早期阶段,感觉门控异常是否是MCI 向AD 转化的早期特异指标未见报道。目前常用听感觉门控(ASG)P50 定量测定SG 的大小。本研究旨在探讨AD临床前期MCI 患者听感觉门控P50 的变化特征,以便为AD的早期诊断、治疗及预防提供生物学标记。
1 对象与方法
1.1 对象 选择2013年1月-2014年2月本院神经内科收治的门诊或住院AD 临床前期MCI 患者32例,男18例,女14例,平均年龄(66.8±7.3)岁,平均病程(2.5±1.5)年,平均受教育年限(12.8±4.6)年。入组标准[1]:①主诉存在记忆障碍,病程≥6月;②客观记忆功能损害,AVLT 的20分钟延迟回忆评分≤相应年龄组的划界分(60~69岁,3分;70~79岁,2分);③总体认知功能正常:MMSE≥24;④日常生活能力正常;⑤无痴呆,不符合美国神经病学、语言障碍和卒中、老年性痴呆和相关疾病有关痴呆的诊断标准(NINCDS);⑥排除精神性与血管性因素所致的认知障碍:皮层无病灶,皮层下无症状的腔梗病灶直径≤1cm,且不位于海马、尾状核头与丘脑背内侧。
另选与患者生活在相同区域、同一时期的健康体检者(对照组)28名,男16名,女12名,平均年龄(67.9±6.5)岁,平均受教育年限(13.2±4.6)年。MMSE 评分≥28分,GDS评分1~2分,CDR 评分0分。躯体检查和实验室检查结果均正常,排除神经、精神疾病,无严重烟、酒过量等情况。两组被试年龄、性别、受教育年限上差异不显著(P>0.05)。所有受试者和(或)监护人知情同意并签署同意书,本研究经医院伦理委员会批准。
1.2 方法
1.2.1 神经心理学测验 采用听觉言语记忆测试-延迟回忆(AVMT-DR),连线测试-A,B(TMT-A,B),数字广度测验(DST)分别评估受试者的情节记忆、执行功能、注意转换能力。
1.2.2 条件-测试刺激模式 用E-Prime 2.0 软件实现。在安静、微暗的环境下(相对隔音、温度约24℃),受试者坐于与显示器(17 英寸彩色显示器,刷新频率75 Hz)距离约70 cm 软椅中,要求受试者在实验中一直注视着屏幕中央[6-8]。受试者先了解指导语,然后练习,E-Prime 2.0 软件产生耳机输出成对clicks 短声,刺激声持续0.1ms,声强90dB。成对条件(S1)—测试(S2)刺激间隔500 ms,每对刺激间隔10S,共呈现32 对刺激对[6]。
1.2.3 电生理测定 实验采用事件相关电位脑电系统,受试者戴32 导电极帽记录脑电,记录电极参照国际脑电学会10/20 标准系统[9-10],测定电极置于Cz 点,双耳TP9,TP10为参考电极,AFz 接地,采样率为500 Hz,头皮阻抗<5kΩ,灵敏度5 μV,带通低频滤波0.1Hz,高频滤波30Hz,被试者脑诱发电位叠加32 次[11-12]。分析时程为刺激呈现后600 ms,基线为刺激前100ms,离线矫正眨眼等伪迹,单次测试值波幅>±70μV 者视为伪迹被剔除。测定成对刺激诱发的S1、S2 波幅及潜伏期。
P50 波为刺激后30~90 ms 间的最大正相波,波幅是指测量该波波峰与前一个波谷间的电位差。潜伏期是指从刺激开始到P50 波最大波幅处的时间差[6]。由S1 刺激诱出的P50 波称为条件刺激波(S1-P50),S2 刺激诱出的P50 波称为测试刺激波(S2-P50),计算S2-P50/S1-P50 的比值(以下简称S2/S1)。S1 波若有1个以上的相似波则取第2个波;若S1 波不明显则排除。S2 波幅为零或负,则认为S2 波被完全抑制,假如S2-P50 波大于或等于S1-P50 波,则认为S2-P50 波脱抑制,S2/S1 波幅比值最大值设为2。以S2/S1 表示SG 的强弱,比值越大表示抑制功能越差[6]。
1.3 统计处理 采用SPSS 17.0 统计学软件包处理,计量资料用(±s)表示,采用独立样本t 检验比较两组年龄、教育程度、神经心理学分差异、S1、S2 波幅、S2/S1 及潜伏期,χ2检验比较组间性别差异。以P<0.05为显著性水平。
2 结果
2.1 两组人口学资料及神经心理学数据比较 与对照组相比,MCI 组MMSE分(t=3.21,P<0.05)、情节记忆(t=10.26,P<0.05)、注意转换(t=5.21,P<0.05)显著降低,执行功能分显著升高(注:TMT-A,B 测试分越高执行功能越差;t=-5.83,-6.79;P<0.05),见表1。
2.2 MCI 组与对照组P50 潜伏期、波幅比较 与对照组相比,MCI 组S1-P50,S2-P50 潜伏期延迟,差异有统计学意义(t=-3.06,-2.62;P<0.05)。MCI 组S1-P50 波幅降低,差异有统计学意义(t=5.27,P<0.05);S2-P50 波幅差异无统计学意义(t=1.58,P>0.05),见表2。
2.3 MCI 组与对照组S2/S1 波幅比值比较 与对照组相比,患者组S2/S1 波幅比值升高,差异有统计学意义(t=-2.69,P<0.05),见表2。
表1 阿尔茨海默病与正常对照组的人口学和临床测量数据比较(±s)
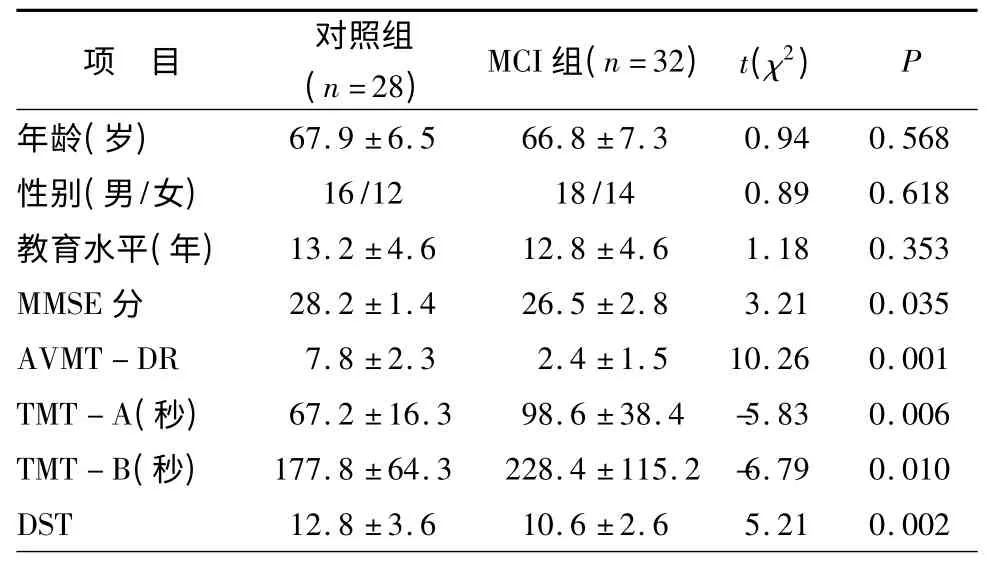
表1 阿尔茨海默病与正常对照组的人口学和临床测量数据比较(±s)
表2 MCI 组与对照组P50 波幅、潜伏期的比较(±s)

表2 MCI 组与对照组P50 波幅、潜伏期的比较(±s)
3 讨论
MCI 患者处于AD 的临床前期阶段,存在一个高的转化AD 的风险。国内外研究均显示,MCI 患者存在多领域认知功能受损,如情节记忆、执行功能、注意功能等[5],本研究结果也证实前人研究结论。正常大脑对外界信息有一个选择和过滤过程,表现为接受重复刺激时P50 波幅的变化,反映了大脑排除掉无关刺激传入的早期前驱注意处理能力。本研究旨在探讨MCI 患者的认知功能早期的感觉门控信息加工阶段异常是否可能是MCI 向AD 转化的前期标记。
本研究结果显示,对照组S1-P50 波幅均高于S2-P50波幅,与国内外研究一致[4,6,13],提示健康被试的正常感觉门控机制被激活,即S1 激活大脑兴奋性的信息流输入装置产生了P50 反应,同时也激活了感觉信息流过滤的抑制性神经通路。而感觉信息过滤的抑制性神经通路被激活得太晚,从而导致对S1-P50 无影响,但对S2 所引起的P50 反应产生抑制作用[6,14]。MCI 组S1-P50、S2-P50 潜伏期延迟,说明MCI患者对外界感觉信息流进行过滤的时间出现异常,或感觉门控机制被激活或启动的时间延迟,导致激活或启动异常;又因为感觉门控的加工涉及一种早期注意参与,一种自动化加工过程,提示MCI 患者的早期注意机制可能存在异常。国内外研究显示,早期注意机制包含两个亚成分,一是注意开关,二是注意朝向反应[15]。MCI 患者具体是哪个成分,或两个成分均存在异常有待于进一步深入研究。本研究发现MCI 组S1-P50 波幅降低、S2-P50 波幅差异不显著,提示MCI 患者早期注意的前驱加工机制的大脑兴奋性输入装置激活的出现紊乱,以致影响其产生P50 反应,并且其抑制性神经通路被激活的程度出现缺陷。国内外研究显示,额叶-颞叶神经环路参与早期注意的信息加工[15];神经病理学研究显示,MCI 患者颞叶体积降低[16],海马的CA 区和S 区的神经元丢失,并且联系了AD 的早期神经病理机制[2]。因此,本研究提示MCI 患者的早期感觉门控能力受损可能是联系了AD 的早期神经病理机制,即P50 受损指标可能是一个MCI 向AD 转化的潜在生物学标记。
本研究还发现,与对照组相比,MCI 组S2/S1 波幅比值显著升高,说明MCI 患者的感觉门控能力下降,即大脑对外界信息的选择和过滤能力出现了缺陷,大量的无关感觉信息流进入从而导致无关刺激超载,进一步导致大脑排除无关刺激传入的早期前驱注意能力受损。根据神经认知的信息序列加工理论,信息加工的前一阶段受损,随着神经传递将导致下一阶段更高级的认知功能受损[17],从而导致多领域认知功能受损,与前面的神经心理测试结果保持一致。也进一步说明MCI 患者的大脑对这样重复刺激的反应出现了障碍。这可能是因为MCI 患者对早期信息加工认知资源的分配机制出现了异常,从而导致大脑兴奋性输入装置的激活时需要的认知资源与抑制性神经通路激活时的认知资源之间分配出现失衡。只有这个两天神经通路的认知资源分配比例可能控制着对外界的感觉信息的选择和过滤。比例失调可能导致MCI患者对“有关信号”反应同步性不足,不能精确处理长时间间隔后重新出现的刺激信息[4]。因此,本研究提示感觉门控神经通路受损可能是MCI 神经病理机制进程或MCI 向AD 转化的早期潜在生物学标记。
本研究由于横断面研究,下一步将扩大样本量,并结合具有高空间定位技术fMRI 对MCI 患者进行随访研究,以便临床上对MCI 患者进行早期干预、药物治疗及康复制订有效策略,减少MCI 患者向AD 的转化。
[1]Petersen R C,Negash S.Mild cognitive impairment:An overview[J].CNS Spectr,2008,13(1):45-53
[2]Scheff S W,Price D A,Schmitt F A,et al.Synaptic alterations in CA1 in mild Alzheimer disease and mild cognitive impairment[J].Neurology,2007,68(18):1501-1508
[3]Dickerson B C,Sperling R A.Functional abnormalities of the medial temporal lobe memory system in mild cognitive impairment and Alzheimer's disease:Insights from functional MRI studies[J].Neuropsychologia,2008,46(6):1624-1635
[4]Fuerst D R,Gallinat J,Boutros N N.Range of sensory gating values and test-retest reliability in normal subjects[J].Psychophysiology,2007,44(4):620-626
[5]Bai F,Zhang Z,Yu H,et al.Default-mode network activity distinguishes amnestic type mild cognitive impairment from healthy aging:A combined structural and resting-state functional MRI study[J].Neurosci Lett,2008,438(1):111-115
[6]黄平,陈玖,唐英.产后与非产后抑郁症患者听感觉门控的对比[J].中国健康心理学杂志,2013,21(9):1311-1313
[7]陈玖,杨来启,宁雅童,等.首发与复发抑郁症患者视觉空间旋转的事件相关电位P500 研究[J].中国心理卫生杂志,2013,27(1):75-79
[8]贾婷,陈玖,杨来启,等.难治性与一般性抑郁症患者冲突性负波的对比研究[J].中国健康心理学杂志,2013,21(11):1619-1621
[9]陈玖,杨来启,马文涛,等.重性抑郁障碍患者心理旋转任务诱发电位P500 研究[J].中华精神科杂志,2013,46(2):78-84
[10]邓自和,陈玖,杨来启,等.精神分裂症患者事件相关电位P300及其与发病次数的关系[J].中国健康心理学杂志,2014,22(4):481-483
[11]Chen J,Yang L Q,Zhao J,et al.Hemispheric dominance during the mental rotation task in patients with schizophrenia[J].Shanghai Archives of Psychiatry,2012,24(2):76-82
[12]Chen J,Yang L Q,Liu G X,et al.Event-related potentials during mental rotation tasks in patients with first-episode depression[J].Shanghai Archives of Psychiatry,2012,24(4):208-216
[13]Wang Yong,Li Zezhi,Huang Jia,et al.Correlational study between auditory sense P50 and cognitive function in treatment-resistant depression and first episode depression patients[J].China Medical Herald,2012,9(22):16-19
[14]Clementz B A,Blumenfeld L D.Muhichannel electroencephalographic assessment of auditory evoked response suppression in schizophrenia[J].Exp Brain Res,2001,139(4):377-390
[15]Hermens D F,Ward P B,Redoblado Hodge M A,et al.Impaired MMN/P3a complex in first episode psychosis:Cognitive and psychosocial associations[J].Prog Neuro-Psychopharmacol Biol Psychiatry,2010,34(6):822-829
[16]Apostolova L G,Thompson P M,Green A E,et al.3D comparison of low,intermediate,and advanced hippocampal atrophy in MCI[J].Hum Brain Mapp,2010,31(5):786-787
[17]Friston K.A theory of cortical responses[J].Philos Trans R Soc Lond B Biol Sci,2005,360(1456):815-836

