泛素连接酶MDM2促进外源NOLC1的泛素化和降解
王小蓉,郭正光,高友鹤
(中国医学科学院 基础医学研究所 生理与病理生理系 医学分子生物学国家重点实验室, 北京 100005)
泛素连接酶MDM2促进外源NOLC1的泛素化和降解
王小蓉,郭正光*,高友鹤*
(中国医学科学院 基础医学研究所 生理与病理生理系 医学分子生物学国家重点实验室, 北京 100005)
目的研究泛素连接酶MDM2对其调节因子NOLC1的泛素化和降解。方法克隆原核表达了NOLC1全长蛋白和其核定位信号区域,在体外泛素化体系中利用有泛素连接酶活性的重组MDM2研究其对NOLC1的泛素化。在哺乳动物细胞中,研究MDM2对外源转染的NOLC1的降解。结果在体外泛素化体系中MDM2泛素化NOLC1全长和其核定位信号区域;在哺乳动物细胞中,MDM2促进外源NOLC1降解超过70%,且NOLC1的降解通过蛋白酶体途经实现。结论MDM2促进外源NOLC1的泛素化和降解,为研究MDM2-TP53-NOLC1之间的相互调节提供了新的线索。
泛素连接酶;泛素化;MDM2;NOLC1
MDM2是一种重要的RING FINGER类单亚基泛素连接酶。MDM2基因最早从NIH3T3细胞系中分离出来,在小鼠肿瘤细胞中高表达[1-2]。研究发现MDM2作为一种泛素连接酶, 参与著名抑癌基因P53/TP53的泛素化,并导致其通过蛋白酶体途经降解[3-4]。 除了P53/TP53之外,近年研究还鉴定到更多MDM2的底物,包括CDKN1A、 HIPK2、RB1、CDH1、DLG4、IGF1R、APEX1、ADRBK1、ARRB、ARRB2、CREBBP、EID1、IRS1、JMY、KAT2B、KAT5、MDM4、NFATC2、NOL3、RPL26和MDM2自身[5]。MDM2作为一个癌基因,通过与其他蛋白相互作用,和泛素化它的底物参与许多细胞的生理和病理过程,包括细胞周期、细胞凋亡和肿瘤发生。
NOLC1是一个具有类转录因子活性的蛋白,参与细胞核组装[6]和前体rRNA剪切[7],参与细胞周期和细胞生长的调节[8]。NOLC1参与多种信号传导通路,如NF-kB信号通路、PKA信号通路[9]和CK2的激活[10]。研究表明,NOLC1和P53协同作用激活MDM2的转录因子,从而激活MDM2的表达[8]。
这项实验研究了MDM2作为泛素连接酶是否能够调节NOLC1的泛素化和降解。实验利用有活性的重组人MDM2蛋白,在体外泛素化体系中研究其对NOLC1的泛素化,进而在细胞内研究MDM2对外源转染的NOLC1的泛素化和降解,为深入研究MDM2和NOLC1的调节提供了重要线索。
1 材料与方法
1.1 实验材料
1.1.1 质粒、菌种和细胞:原核表达的载体:pET 32b+(Novagen,69016)。真核表达的质粒载体:pEGFP-N1-NOLC1-GFP(Genechem),它的DNA序列分别由BC006769模板获得,克隆至pEGFP-N1载体中,编码C末端GFP标签的NOLC1全长蛋白。 Flag-MDM2(GeneCopoeia),它的DNA序列由IMAGE: NM_002392.1模板获得,克隆至pReceiver-M11载体中,编码N末端Flag标签的MDM2全长序列。HA-ubiquitin载体由原医科院基础所李汇华教授惠赠。大肠杆菌菌株BL21(DE3)(全式金公司)。HEK293T细胞由本实验室保存。
1.1.2 试剂、抗体和酶:MagExtractor (His-tag)(NPK-701)(Toyobo公司);E1(重组人UBE1)(E-305)、E2(重组人UbcH5b蛋白)(E2-622)、E3 (重组人GST-Hdm2)(E3-202)、His-ubiquitin(U530)和Myc-ubiquitin(U-115)(Boston Biochem公司)。GST蛋白为本实验室表达纯化。转染试剂:I’ma Fect (IMA201101)(Imagen公司);MG132(Beyotime, S1748)(碧云天公司);RIPA lysis缓冲液(Applygen, P1053)(普利莱公司)。
抗体:anti-S-tag (Abcam, ab18616)、anti-Flag-tag (DYKDDDDK) (M20008)、anti-Myc-tag(M20002)、anti-GFP-tag (M20004)、anti-HA-tag(M20003)和anti-β-actin (M20010)(Abmart公司)。
1.2 实验方法
1.2.1 表达载体的构建:设计引物:以IMAGE克隆IMAGE: NM_002392.1为模板,将MDM2全长(1~491aa)和MDM2ΔRing(1~435aa)PCR扩增出来,PCR产物用BamHⅠ/XhoⅠ双酶切,连接到pcDNA6载体上。设计引物,以pEGFP-N1-NOLC1-GFP为模板,将NOLC1全长和NOLC1的核定位信号区域(386~605aa)PCR扩增,PCR产物用EcoRⅠ/HindⅢ双酶切,连接到PET32b+载体上。上述连接产物分别转化到大肠杆菌中,挑取单克隆,PCR鉴定,最后送交公司测序确定编码序列和读码框架无误。
1.2.2 潜在底物NOLC1的表达和纯化: 分别将底物的表达质粒与PET32b+转化到BL21(DE3)感受态细胞中,分别挑取单克隆,37 ℃振荡过夜,再取200 μL加入到4 mL新鲜培养基中,37 ℃培养3 h至指数生长期,再加入0.2 mmol/L 异丙基硫代半乳糖苷(IPTG)诱导剂30 ℃诱导蛋白表达4~6 h,离心,收集细胞,用PBS洗1次,菌体超声破碎(160 W,10 s/10 s),离心去沉淀,上清液用Mag Extractor (His-tag) 试剂盒富集表达蛋白。富集后的蛋白用考马斯亮蓝法(Bradford法)定量。
1.2.3 体外泛素化反应:体外泛素化体系包括以下成分:110 ng E1(Boston Biochem, 662070)、0.5 μg E2(重组UbcH5b)(UpState, 14~871)、0.83 μg E3(重组GST-MDM2/或GST)、3 mmol/L ATP、4 μg His-ubiquitin(Boston Biochem,U5507)、50 mmol/L Tris-HCl(pH 7.4)、2.5 mmol/L MgCl2、1 mmol/L DTT和200 ng底物。反应体系用去离子水补齐至20 μL。在30 ℃反应90 min后,用5×SDS上样缓冲液终止反应。反应产物95 ℃处理5 min,反应混合物用SDS-PAGE胶分离,湿式转膜,用anti-S-tag 抗体进行蛋白免疫印迹,显色分析。
1.2.4 细胞培养和转染:真核表达质粒用I’ma Fect转染试剂转染至HEK293T细胞中。转染后24~48 h收获细胞,用RIPA裂解液裂解(含2 mmol/L苯甲基磺酰氟PMSF),澄清的细胞裂解液通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)胶分离,用相应的抗体免疫印迹。在需要蛋白酶体抑制剂的实验中,转染的细胞在收获前用10 μmol/L的MG132处理12 h。NOLC1和内参分别Image J定量并计算标准化比值。
2 结果
2.1 泛素连接酶活性测定
有活性的RING finger类的E3可以在含有E1和E2的体外泛素化反应体系中,催化游离的泛素聚合成不同分子质量大小的泛素链。重组 GST-MDM2确实具有泛素连接酶活性(图1)。

图1 重组MDM2具有泛素连接酶活性Fig 1 Recombinant MDM2 has ubiquitin ligase activity
2.2 体外泛素化实验
在体外泛素化体系中,MDM2可以促进NOLC1核定位信号区域(386~605aa)的多聚泛素化(图2A);MDM2同样可以促进NOLC1的全长产生泛素化条带,但泛素化程度较NOLC1片段低(图2B); MDM2不能使阴性对照(PET32b+空载体表达产物)泛素化(图2C)。
2.3 MDM2促进NOLC1通过蛋白酶体途经降解
细胞内泛素化的蛋白质通常通过蛋白酶体途经降解。在HEK293T细胞中,NOLC1主要以截断体形式存在。MDM2的过表达导致外源转染的NOLC1的降解超过70%,10 μmol/L蛋白酶体抑制剂MG132处理细胞12 h后,可以明显抑制NOLC1的降解(图3)。
3 讨论
这项研究利用体外泛素化体系和哺乳动物泛素化体系,发现MDM2可以泛素化NOLC1并导致外源转染的NOLC1通过蛋白酶体途径降解。在体外泛素化的实验中,发现商品化的人重组MDM2蛋白具有E3活性,可以用于后续研究。研究还发现,人重组MDM2可以泛素化NOLC1全长蛋白和NOLC1的核定位信号区域。这一研究结果提示,MDM2可能通过识别NOLC1的核定位信号区域并导致NOLC1泛素化。而MDM2对NOLC1全长的泛素化程度比NOLC1片段低,这可能是NOLC1全长的其他区域产生了空间位阻效应,阻碍了其与NOLC1的相互识别。MDM2对NOLC1的泛素化具体机制需要进一步深入研究,如MDM2与NOLC1的相互作用位点的确定,MDM2泛素化NOLC1的泛素化修饰位点的确定。
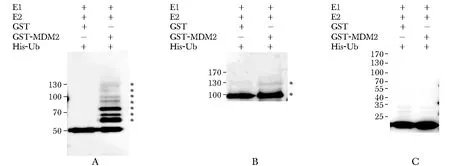
A.MDM2 promoted the ubiquitinaition of the nuclear localization signal of NOLC1; B.MDM2 promoted the ubiquitination of NOLC1 full-length protein; C.MDM2 could not ubiquitinate the negative control
图2在体外泛素化体系中MDM2促进NOLC1泛素化
Fig2MDM2promotedtheubiquitinationofNOLC1ininvitroubiquitinationsystem

图3 MDM2促进外源转染的NOLC1通过蛋白酶体途径降解Fig 3 MDM2 promotes the proteosomal degradation of exogenous NOLC1
MDM2是一种非常重要的泛素连接酶,已有发现它可以泛素化多种底物,包括:TP53[3-4]和RB1[11-13]等,参与多种细胞的生理和病理过程,包括细胞周期、细胞凋亡和肿瘤发生。在NPC细胞中,NOLC1和TP53协同作用,共同激活MDM2的启动子,促进MDM2的表达,进而参与NPC细胞的肿瘤发生和调节[8]。然而MDM2对NOLC1的调节尚不清楚。NOLC1是一个具有类转录因子活性的蛋白,参与细胞核组装[6]和前体rRNA剪切[7],参与细胞周期和细胞生长的调节。
这项研究发现MDM2可以促进外源的NOLC1的泛素化和降解,推测MDM2很有可能通过对NOLC1的泛素化抑制NOLC1,这一现象为MDM2-TP53-NOLC1之间的相互调节提供了新的线索。
[1] Cahilly-Snyder L, Yang-Feng T, Francke U,etal. Molecular analysis and chromosomal mapping of amplified genes isolated from a transformed mouse 3T3 cell line[J]. Somat Cell Mol Genet,1987,13: 235-244.
[2] Fakharzadeh SS, Trusko SP, George DL. Tumorigenic potential associated with enhanced expression of a gene that is amplified in a mouse tumor cell line[J]. EMBO J,1991,10: 1565-1569.
[3] Haupt Y, Maya R, Kazaz A,etal. Mdm2 promotes the rapid degradation of p53[J]. Nature,1997,387: 296-299, doi: 10.1038/387296a0.
[4] Kubbutat MH, Jones SN, Vousden KH. Regulation of p53 stability by Mdm2[J]. Nature,1997,387: 299-303.
[5] Han Y, Lee H, Park JC,etal. E3Net: a system for exploring E3-mediated regulatory networks of cellular functions[J]. Mol Cell Proteomics,2012,11: O111 014076, doi: 10.1074/mcp.O111.014076
[6] Tsai YT, Lin CI, Chen HK,etal. Chromatin tethering effects of hNopp140 are involved in the spatial organization of nucleolus and the rRNA gene transcription[J]. J Biomed Sci,2008,15: 471-486.
[7] Thiry M, Cheutin T, Lamaye F,etal. Localization of Nopp140 within mammalian cells during interphase and mitosis[J]. Histochem Cell Biol,2009,132: 129-140.
[8] Hwang YC, Lu TY, Huang DY,etal. NOLC1, an enhancer of nasopharyngeal carcinoma progression, is essential for TP53 to regulate MDM2 expression[J]. Am J Pathol,2009,175: 342-354.
[9] Chiu CM, Tsay YG, Chang CJ,etal. Nopp140 is a mediator of the protein kinase A signaling pathway that activates the acute phase response alpha1-acid glycoprotein gene[J]. J Biol Chem,2002,277: 39102-39111.
[10] Kim YK, Lee KJ, Jeon H,etal. Protein kinase CK2 is inhibited by human nucleolar phosphoprotein p140 in an inositol hexakisphosphate-dependent manner[J]. J Biol Chem,2006,281: 36752-36757.
[11] Uchida C, Miwa S, Kitagawa K,etal. Enhanced Mdm2 activity inhibits pRB function via ubiquitin-dependent degradation[J]. EMBO J,2005,24: 160-169.
[12] Sdek P, Ying H, Chang DL,etal. MDM2 promotes proteasome-dependent ubiquitin-independent degradation of retinoblastoma protein[J]. Mol Cell,2005,20: 699-708.
[13] Miwa S, Uchida C, Kitagawa K,etal. Mdm2-mediated pRB downregulation is involved in carcinogenesis in a p53-independent manner[J]. Biochem Biophys Res Commun,2006,340: 54-61.
Ubiquitin ligase MDM2 promotes ubiquitination and degradation of exogenous NOLC1
WANG Xiao-rong, GUO Zheng-guang*, GAO You-he*
(National Key Laboratory of Medical Molecular Biology, Dept. of Physiology and Pathophysiology,Institute of Basic Medical Sciences, CAMS amp; PUMC, Beijing 100005, China)
ObjectiveTo study the role of MDM2 in the ubiquitination of NOLC1, a regulator of MDM2.MethodsFull-length NOLC1 proteins and its nuclear localization signal region were cloned and expressed in E.coli. Recombinant human MDM2 with ubiquitin ligase activity was used to study the ubiquitination of NOLC1 by MDM2 ininvitroubiquitination system. The degradation of exogenous NOLC1 by MDM2 was studied in mammalian cells.ResultsMDM2 promoted the ubiquitination of full-length NOLC1 proteins and its Nuclear localization signal region ininvitroubiquitination system. MDM2 promoted the proteasome dependent degradation of exogenous NOLC1 by over 70% in mammalian cells.ConclusionsUbiquitin ligase MDM2 promotes the ubiquitination and degradation of exogenous regulator NOLC1, which provides important clues for the rescarch on regulation of MDM2-TP53-NOLC1.
ubiquitin ligase; ubiquitination; MDM2; NOLC1
2013-09-26
2013-12-16
国家基础研究计划(973)(2012CB517606, 2011CB964901, 2013CB530805);国家高技术研究发展计划(863)(2011AA020116);高校长江学者创新研究团队(IRT0909);111计划(B08007)
*通信作者(correspondingauthor):gaoyouhe@pumc.edu.cn ;gzg0625@gmail.com
1001-6325(2014)03-0314-04
研究论文
R34
A

