HIF-1α转染方法的优化及其对间充质干细胞存活及分化功能的影响
张 扬,辛畅泰
(沈阳医学院 附属奉天医院 手外科, 辽宁 沈阳 110024)
HIF-1α转染方法的优化及其对间充质干细胞存活及分化功能的影响
张 扬*,辛畅泰
(沈阳医学院 附属奉天医院 手外科, 辽宁 沈阳 110024)
目的探索应用脂质体作为载体将低氧诱导因子-1α(HIF-1α)转染至间充质干细胞(MSCs)的转染方法。方法应用脂质体作为载体将HIF-1α转染至P3代MSCs,荧光观察绿色荧光蛋白(GFP)表达,评估转染效率。比较在不同情况下细胞的转染效率。将转染的MSCs、空质粒转染的MSCs和未转染的MSCs置于缺氧环境下(CoCl2模拟缺氧),比较3种细胞HIF-1αmRNA、HIF-1α蛋白的表达。鉴定转染的MSCs向成骨细胞和脂肪细胞的分化能力,及在缺氧环境中的存活率。结果应用脂质体法可以成功将pcDNA3.0-HIF-1α-eGFP转染至MSCs。当细胞汇合度在80%以上,DNA与质粒的比为(μg/μL)1∶1.25,且转染时间为4 h时转染效率最高,为21%。转染HIF-1α的MSCs在缺氧环境中可被成功向脂肪细胞和成骨细胞诱导分化,HIF-1α转染可以提高缺氧时MSCs存活率(Plt;0.05)。在缺氧条件下pcDNA3.0-HIF-1α-eGFP瞬时转染的MSCs较空质粒(pcDNA3.0-eGFP)转染的MSCs和未转染的MSCs能高表达HIF-1αmRNA及HIF-1α蛋白(Plt;0.05)。结论应用脂质体作为载体可以将HIF-1α转染至MSCs,HIF-1α转染的MSCs在缺氧时高表达HIF-1αmRNA及蛋白。
骨髓间充质干细胞;低氧诱导因子-1;脂质体;转染
低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)是一种关键的平衡氧稳态和调节低氧反应的转录因子,广泛存在于低氧条件下的哺乳动物和人体内,可以调控多种靶基因的转录,在许多低氧性疾病的病理生理过程中都发挥着重要作用。由于它是在低氧条件下诱导而产生,因此被命名为低氧诱导因子。HIF-1由120 ku的α亚基(HIF-1α)和91/93/94 ku的β亚基(HIF-1β)组成,HIF-1α是HIF-1的活性单位。HIF-1的靶基因表达后参与红细胞生成,血管形成,核苷、氨基酸、糖的代谢,细胞存活、凋亡以及药物抵抗等生物学效应,以维持组织、细胞在缺氧条件下内环境稳定和适应缺氧。
低氧环境有利于间充质干细胞(mesenchymal stem cells, MSCs)向软骨细胞、骨细胞和脂肪细胞分化,在体内低氧环境下的细胞亦表现出较强的修复能力[1]。这些现象可能与HIF-1α的作用相关[2]。但亦有研究表明干细胞虽可存在于生理低氧的环境下,但在氧浓度为0%~0.5%的缺氧环境下MSCs存活率明显下降[3-4]。若能将HIF-1α转染至MSCs, 可能对MSCs缺氧环境中功能改善带来益处。本研究的目的是观察应用脂质体的方法可否将HIF-1α转染至MSCs,为MSCs研究提供技术条件。
1 材料与方法
1.1 大鼠MSCs分离培养
鼠龄3~4周,SPF级Wistar大鼠,体质量100~120 g,雌雄不限[中国医科大学动物部,SCXK(辽)2008-0005]。直接贴壁法分离大鼠MSCs[5]。原代获得细胞后24 h首次半量换液。此后每3~4天换液1次。换液培养时采用少量换液方法,即用吸管吸弃原有培养液时原瓶内留有0.3~0.5 mL原有培养液,再加入新鲜完全培养液。当MSCs 70%~80%铺满培养瓶底时,进行传代培养。所得细胞记为P1,同样方法获得P2、P3代细胞。
1.2 大鼠MSCs鉴定
1.2.1 细胞免疫表型测定:取培养的P3代MSCs,胰蛋白酶消化,PBS调整细胞悬液浓度,取2×106个细胞分别加入到7个微量离心管中,1号管为对照管加入4 μL IgG1-FITC,2、3、4、5、6和7管分别加入3 μL抗CD45-FITC抗体、3 μL 抗CD90-FITC抗体,3 μL抗CD14-FITC抗体, 3 μL 抗CD73-PE抗体,3 μL抗CD105-FITC抗体和20 μL抗CD34-FITC抗体,4 ℃避光孵育30 min,用预冷的PBS洗涤,4 ℃、1 000r/min离心5 min,弃上清,加入0.5~1.0 mL PBS重悬后进行流式细胞仪检测,EXPO32.V1.2软件分析。
1.2.2 MSCs向脂肪细胞诱导分化鉴定:取P3代MSCs,消化细胞,以8×103个/cm2密度接种于6孔培养皿内置盖玻片上(盖玻片高压灭菌处理后再用多聚赖氨酸处理,烘干备用)。待细胞完全贴壁后更换成脂诱导分化条件培养液(DMEM/F12培养基,0.1 mmol/L 3-异丁基-1-甲基黄嘌呤(IBMX),10 mg/L胰岛素,0.1 mmol/L吲哚美辛,1 μmol/L地塞米松,10%胎牛血清)进行成脂肪细胞诱导,连续处理5 d。2周后取诱导组和对照组盖玻片,PBS洗3遍。4%多聚甲醛固定15 min,PBS洗3遍。60%异丙醇稍清洗1次,滴加适量油红O工作液染色30 min。蒸馏水洗3遍,甘油封片,显微镜下观察。
1.2.3 MSCs向成骨细胞诱导分化鉴定:取P3代MSCs,消化细胞,以8×103个/cm2密度接种于6孔培养皿内置盖玻片上(盖玻片高压灭菌处理后再用多聚赖氨酸处理,烘干备用)。待细胞完全贴壁后更换成骨诱导分化条件培养液(DMEM/F12培养基,0.01 μmol/L地塞米松,10 mmol/L β-甘油磷酸钠,50 μmol/L 维生素C,10% FBS)进行成骨细胞诱导,连续处理5 d。2周后取诱导组和对照组盖玻片,PBS洗2遍。95%乙醇固定10 min,蒸馏水洗3遍。加入0.1%茜素红-Tris-HCl(pH=8.3),37 ℃孵育30 min。蒸馏水冲洗后显微镜下观察。
1.3 HIF-1α扩增及测序
感受态细菌(大肠杆菌DH5α)冰上解冻。融解后轻柔混合均匀,取50 μL菌液移入高压灭菌的1.5 mL EP管中。加入pcDNA3.0-HIF-1α-eGFP(本实验室保存,人HIF-1α),冰上放置30 min。42 ℃放置90 s,立即移入冰中放置1~2 min。加入到预先保存至37 ℃的250 μL无抗生素溶菌肉汤中,37 ℃振荡培养1 h。3 000r/min离心5 min,弃上清,加入100~200 μL无抗生素LB培养基轻柔吹打,吸出后涂平板。37 ℃放置15 h。用无菌牙签挑取单菌落接种到5 mL含抗生素的溶菌肉汤中,37 ℃振荡培养过夜。按质粒小提试剂盒说明书步骤操作提取质粒,核酸蛋白测定仪测定DNA浓度及纯度,DNA纯度为260/280 1.7~1.9, -20 ℃冰箱保存。标本送至大连Takara生物公司测序。
1.4 质粒转染至MSCs
转染前1 d,将MSCs用0.05%胰蛋白酶消化后,一部分细胞接种在加有洁净灭菌圆形盖玻片的12孔板中,约2×105个/孔,每孔加入无抗生素、无血清的LG-DMEM培养液1 mL,置于37 ℃、5% CO2、饱和湿度培养箱中培养,备转染后荧光观察用;另一部分接种于25 cm2培养瓶中,加入无抗生素、无血清的LG-DMEM培养,置于37 ℃、5% CO2、饱和湿度培养箱中培养,备转染后目的基因mRNA和蛋白的检测用。取4孔作为实验组转染pcDNA3.0-HIF-1α-eGFP质粒,4孔转染pcDNA3.0-eGFP空质粒作为对照组,4孔不转染。分别取pcDNA3.0-HIF-1α-eGFP质粒和脂质体,各稀释于400 μL DMEM-LG中, 脂质体混合液室温放置5 min后,与质粒混合液混合(lipofectamine2000使用前轻柔混匀),将混合液平均加入4孔中,每孔200 μL。同样方法行pcDNA3.0-eGPF空质粒转染。将细胞放入孵箱内培养,弃去原有培养液,更换为含11%胎牛血清的DMEM-LG继续培养。倒置荧光显微镜下选择激发波长490观察荧光表达情况,计数GFP阳性细胞率。
1.5 转染条件的优化
1.5.1 转染时间的优化:当细胞达70%以上汇合时进行转染,分别行转染反应1、2、3、4、5和6 h,每组设3个复孔,转染后24 h在荧光显微镜下观察,计算转染效率。
1.5.2 细胞汇合度的优化:将MSCs以相同数目接种于12孔板中,分别于细胞达到50%、60%、70%、80%和90%以上汇合时进行转染4 h,每组设3个复孔,转染后24 h于荧光显微镜下观察,计算转染效率。
1.5.3 质粒质量与脂质体体积比例的优化:将MSCs接种于24孔板中,分别以质粒与脂质体(μg/μL)比例为1∶1、1∶1.25、1∶1.5、1∶2、1∶3和1∶4进行转染4 h,每组设3个复孔,转染后24h于荧光显微镜下观察,计算转染效率。
1.6 转染后MSC分化功能的鉴定
选取HIF-1α转染的MSCs在缺氧环境中(CoCl2模拟缺氧,浓度200 μmol/L),缺氧处理24 h后行向成骨细胞、成脂肪细胞诱导分化,方法如前述。
1.7 细胞分组及处理
随机选取空质粒转染细胞(a组)、目的质粒转染细胞(b组)和未转染细胞(c组)各4瓶,各取2瓶采用CoCl2模拟缺氧(浓度200 μmol/L)。缺氧处理24 h后检测目的RNA、蛋白,缺氧处理组分别记为ao、bo、co。
1.8 锥虫蓝染色检测细胞存活率
缺氧处理24h后检测各组细胞存活率。各组细胞消化后制成单细胞悬液,PBS稀释至106个/mL,加入适量0.4%锥虫蓝(台盼蓝)溶液[细胞悬液∶锥虫蓝溶液(v/v)=9∶1],混匀,染色3 min,吸取少量经过染色的细胞用血细胞计数板计数,至少计数500个细胞。根据死细胞胞质蓝染而活细胞不着色的原理检测细胞存活率。可随机选择6~8个视野,计算细胞存活率:细胞存活率%=(细胞总数-蓝色细胞数)/细胞总数×100%。
1.9 实时PCR检测HIF-1α mRNA
缺氧处理24 h后检测各组细胞HIF-1αmRNA。Trizol 法提取细胞总RNA,核酸蛋白测定仪测定DNA浓度及纯度,RNA纯度为260/280 1.7~1.9,应用 TaKaRa公司RNA PCR Kit(AMV)Ver.3.0 进行反转录,反应体系为MgCl22.0 μL;10×RT缓冲液 1.0 μL;无RNA酶dH2O 3.75 μL;dNTP混合物(各10 mmol/L)1.0 μL;RNA酶抑制剂0.25 μL;AMV反转录酶0.5 μL;随机引物(Random 9 Mers)0.5 μL;待测样品 RNA 1.0 μL;共10 μL/样本,94 ℃ 40 s,56 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。cDNA置-20 ℃保存备用。以SYBRGreen Ⅰ法行实时荧光定量PCR。目的基因HIF-1α,内参GAPDH,所设计的引物能进行良好扩增。HIF-1α基因上游引物:5′-AGCCAGACGATCATGCAGCTACTA-3′,下游引物:5′-TGTGGTAATCCACTTTCATCCATT G-3′;GAPDH上游引物:5′-GGCACAGTCAAGGCTGA GAATG-3′, 下游引物:5′-ATGGTGGTGAAGACGCC AGTA-3′。荧光定量PCR反应参数:HIF-1α95 ℃ 10 min;95 ℃ 30 s,54 ℃ 45 s,72 ℃ 45 s,共45个循环;72 ℃ 5 min,荧光定量PCR仪自带软件自动给出各样本Ct 值, 实验重复3 次。ΔCt=CtHIF-1α-CtGAPDH。ΔΔCt定义为ΔΔCt不同处理组-ΔCt未转染组,计算2-ΔΔCt进行相对定量。
1.10 Western blot法检测HIF-1α蛋白表达
缺氧处理24 h后检测各组细胞HIF-1α蛋白表达。收集细胞,加入细胞裂解液300 μL及3 μL蛋白酶抑制剂,冰上静置5 min,4 ℃、15 000r/min离心10 min,用Broadorf法测蛋白浓度后,取30 μg蛋白用于 Western blot 实验。HIF-1α用10% 的SDS-聚丙稀酰胺凝胶分离胶。湿式电转移法将蛋白转移至PVDF膜,取出PVDF膜,用洗涤缓冲液在摇床上洗膜10 min,封闭液封闭2 h。加入稀释好的一抗(1∶200),4 ℃过夜。加入辣根过氧化物酶标记的二抗 (1∶1 000稀释) 室温下杂交2 h。TBST洗膜 3次,用ECL试剂盒进行发光反应,曝光,显影。以Scion Image软件分析电泳带的灰度值,以目的片段的灰度值与相应的β-actin的灰度值的比值作为二者的蛋白质的相对水平。
1.11 统计学分析
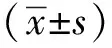
2 结果
2.1 细胞形态学观察
原代细胞接种24 h已大部分贴壁, 贴壁后MSCs呈棒状或纺锤状,随着换液次数增加,瓶内大部分红细胞等不贴壁细胞被清除,贴壁细胞数量逐渐增加,少数伸展成长梭形,其余主要为短棒状,多角形或星形。随着换液次数的增,胞质清晰,折光性好,细胞克隆增大,细胞呈鱼群样生长,与其他克隆逐渐汇合(图1)。

MSCs are spindle-shaped and they gathered like stock of fish图1 MSCs原代培养Fig 1 MSCs primary culture(×200)
2.2 细胞免疫表型测定
流式细胞表面抗原检测结果表明P3代的MSCs表达CD90(97%),CD73(96.9%),CD105(98.6%),基本不表达CD45(0.83%),CD14(0.33%),CD34(0.41%)。诱导分化实验证明MSCs可成功分化为脂肪细胞(图2A)和成骨细胞(图2B)。
A.oil red O staining MSCs after adipogenic induction demonstrated intracellular lipid droplets(×200); B.Alizarin red staining MSCs after osteogenic induction demonstrated mineralized nodules(×100)
图2MSCs成脂诱导和成骨诱导
Fig2AdipogenicandosteogenicinductionofMSCs
2.3 测序
参照GenBank NM_001530的基因序列测序结果证实扩增后的目的基因(HIF-1α)无碱基突变。
2.4 荧光观察瞬时转染
转染后12 h即可在荧光显微镜下观察到微弱荧光出现(图3A);24 h后可见绿色荧光(图3B);48~72 h阳性细胞增多,荧光强度增强;72 h达到高峰可明显观察到较为明亮的绿色荧光(图3C);此后荧光逐渐减弱。
2.5 转染条件的优化
在细胞达80%以上汇合、转染反应时间4 h、DNA和脂质体比为(μg/μL)l∶1.25时,即用2 μL Lipo2000介导1.6 μgHIF-1α基因转染,转染效率最高,约为21%(图4)。
2.6 转染后MSC分化功能的鉴定
转染HIF-1α的MSCs在缺氧环境中可被成功向脂肪细胞和成骨细胞诱导分化,因此它仍具有干细胞的多向分化潜能,这说明转染前后MSCs的性质没有改变(图5)。

A.faint green fluorescence could be watched in nuclei of a small quantity of MSCs after 12 hours transfection; B.more green fluorescence could be watched in some MSCs,most in nuclei,after 24 hours transfection than 12 hours; C.more green hyperfluorescence could be watched in major MSCs,most in nuclei,after 72 hours transfection than 24 hours
图3MSCs瞬时转染后荧光观察
Fig3FlourescenceobservationaftertransienttransfectionofMSCs(×100)

A.when the cells reached confluence of 70%,transfection was conducted; the average transfection efficiencys were 5%,13%,16%,21%,14% and 10% after the transfection duration of 1,2,3,4,5 and 6 hours separately; when the transfection time was 4 hours,the transfection efficiency was the highest; B.MSCs with the same density were inoculated into 12 cell culture plate, transfection was conducted when the cell confluence came to above 50%,60%,70%,80%,90% and the transfection efficiency were 10%,13%,16%,21% and 18% seperately; when the cell confluence was above 80%,the transfection efficiency was the highest; C.MSCs were inoculated into 24 cell plate with plasmid and liposome (μg/μL) ratio of 1∶1(goup a), 1∶1.25(group b), 1∶1.5(group c),1∶2(group d),1∶3(group e)and 1∶4(group f)seperately, and the transfection was conducted; the transfection efficiency were 15%,21%,17%,17%,16% and 14% separately; when the ratio was 1∶1.25,the transfection efficiency was the highest
图4转染条件的优化
Fig4Optimizationoftransfectioncondition
2.7 锥虫蓝染色检测细胞存活率
CoCl2模拟缺氧24 h后,未转染组细胞存活率10.0%±0.7%,空质粒转染组9.0%±0.8%,HIF-1α转染组41.0%±1.1%,后者显著高于未转染组和空质粒转染组(Plt;0.05)。而未转染组与空质粒转染组间细胞存活率比较无显著差异。
2.8实时PCR检测不同组细胞间HIF-1αmRNA表达的差异
缺氧时空质粒转染组HIF-1α在mRNA水平相对表达量为1.11±0.01, 与未转染组比较无显著差异,HIF-1α转染组为8.89±0.55,较未转染组和空质粒转染组表达明显增加(Plt;0.01);常氧时空质粒转染组HIF-1α在mRNA 水平相对表达量为0.95±0.03, 与未转染组比较无显著差异,HIF-1α转染组为4.26±0.48,较未转染组和空质粒转染组表达明显增加(Plt;0.01)。
2.9 Western blot法检测HIF-1α蛋白表达
pcDNA3.0-HIF-1α-eGFP转染组细胞缺氧时显著高表达HIF-1α蛋白(Plt;0.05),空质粒pcDNA3.0-eGFP转染组及未转染组细胞间HIF-1α蛋白表达量无显著差别(图6)。

A.oil red O staining MSCs transfected withHIF-1αafter adipogenic induction demonstrated intracellular lipid droplets(×200); B.2 Alizarin red staining MSCs transfected withHIF-1αafter osteogenic induction demonstrated mineralized nodules(×100)
图5转染HIF-1α的MSCs成脂诱导和成骨诱导
Fig5AdipogenicandosteogenicinductionofMSCstransfectedwithHIF-1α

Under hypoxia condition, the expression of HIF-1α protein among every group is significantly higher than that under normoxia condition(Plt;0.05);under hypoxia condition, the expression of HIF-1αprotein in the HIF-1α-transfected group is significantly higher than that in the other two groups(Plt;0.05); there is no difference about the HIF-1α protein expression between the group a and c either under normoxia condition or hypoxia condition; 1.empty plasmid transfected under normoxia condition; 2.empty plasmid transfected under hypoxia condition; 3.HIF-1α transfected under normoxia condition; 4.HIF-1α transfected under hypoxia condition; 5.non-transfected under normoxia condition; 6.non-transfected under hypoxia condition;*Plt;0.05 compared with normoxia
图6转染HIF-1α对MSCs细胞HIF-1α蛋白表达的影响
Fig6TheeffectofHIF-1α-transfectionintoMSCsontheexpressionofHIF-1αprotein
3 讨论
目前,MSCs被认为是骨组织工程中最理想的种子细胞。研究证明基因修饰干细胞,可实现骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)在体外长期扩增并维持某些干细胞的多向分化潜能特性[6]。基因转染的方法常见的有病毒转染法和非病毒转染法。其中,病毒法造成感染的风险性较大,且病毒的免疫原性高、容量小、制备困难、成本较高[7-8]。脂质体是由磷脂双层构成的具有水相内核的脂质微囊。脂质体较病毒载体转染效率低,但具有安全性高、可生物降解,可重复转染、操作简便、无免疫原性、能感染分裂细胞也能感染非分裂细胞、携带外源基因大小不受限制的特点,有可能成为今后基因治疗领域内最有希望的基因转染载体[9-10]。因此,本实验中选择的是阳离子脂质体lipofectmin2000作为转染载体。
阳离子脂质体介导基因转染的效率与脂质体结构、质粒浓度、脂质体与DNA 的比例、细胞状态、转染时间以及靶细胞的选择性作用有关[11]。不同的实验条件会对脂质体介导的基因转染效率产生影响。通过对实验条件的对比,研究中发现,优化的lipo2000与质粒的比例、转染时间和细胞汇合度可以提高转染效率。当质粒(g)与脂质体(μL)之比为1∶1.25,细胞汇合达80%~90%时,转染4 h时能获得较高的转染效率。
采用lipo2000介导的HIF-1α转染MSCs后经缺氧诱导,RT-PCR结果显示转基因MSCs含有HIF-1α的mRNA,显著高于其他各组。转染细胞表达目的产物HIF-1α蛋白,与对照组相比均显著升高。因此,证明应用脂质体进行HIF-1α转染的MSCs能够强化表达目的基因和目的蛋白。
[1] Tsai CC, Chen YJ, Yew TL,etal. Hypoxia inhibits senescence and maintains mesenchymal stem cell properties through down-regulation of E2A-p21 by HIF-TWIST[J]. Blood, 2011, 117: 459-469.
[2] Wagegg M, Gaber T, Lohanatha FL,etal. Hypoxia promotes osteogenesis but suppresses adipogenesis of human mesenchymal stromal cells in a hypoxia-inducible factor-1 dependent manner[J]. PloS One, 2012,7:e46483. doi: 10.1371/journal.pone.0046483.
[3] Geng YJ. Molecular mechanisms for cardiovascular stem cell apoptosis and growth in the hearts with atherosclerotic coronary disease and ischemic heart failure[J]. Ann NY Acad Sci, 2003,1010:687-697
[4] Zhu W, Chen J, Cong X,etal. Hypoxia and serum deprivation-induced apoptosis in mesenchymal stem cells[J].Stem Cells, 2006,24:416-425.
[5] Li xueyuan, Zhang yang, Qi guoxian. Evaluation of isolation methods and culture conditions for rat bone marrow mesenchymal stem cells[J]. Cytotechnology, 2013,65:323-334. doi: 10.1007/s10616-012-9497-3.
[6]Abdallah BM, Haack-Sørensen M, Burns J S,etal. Maintenance of differentiation potential of human bone marrow mesenchymal stem cells immortalized by human telomerase reverse transcriptase gene despite of extensive proliferation [J]. Biochem Biophy Res Commun, 2005, 326: 527-538.
[7] Zhang SB, Xu YM, Wang B,etal. Cationic compounds used in lipoplexes and polyplexes for gene delivery [J]. J Control Release, 2004, 100: 165-180.
[8] Nicolazzi C, Garinot M, Mignet N,etal. Cationic lipids for transfection [J]. Curr Med Chem, 2003, 10: 1263-1277.
[9] Zandi E,Chen Y,Karin M. Direct phosphorylation of IκB by IKKα and IKKβ: discrimination between free and NF-κB-bound substrate[J]. Science, 1998,281:1360-1363.
[10] May MJ, D’Acquisto, F,Madge LA,etal. Selective inhibition of NF-κB activation by a peptide that blocks the interaction of NEMO with the IκB kinase complex[J].Science,2000,289:1550-1554.
[11] Kim YJ, Kim TW, Chung H,etal. The effects of serum on the stability and the transfection activity of the cationic lipid emulsion with various oils [J]. Int J Pharm, 2003, 252:241-252.
Method optimization ofHIF-1αtransfection and its effects on survival rate and differentiation of mesenchymal stem cells
ZHANG Yang*, XIN Chang-tai
(Dept. of Hand Surgery, Feng Tian Hospital Affiliated to Shenyang Medical College, Shenyang 110024,China)
ObjectiveTo investigate a method of MSCs transfection withHIF-1αgene-recombined liposome.MethodsHIF-1αwas transferred into the third generation of MSCs by liposome. The expression of green flouresence protein (GFP) was observed and the efficiency of transfection was assessed. The three groups of cells, which were MSCs transfected withHIF-1αgene-recombined liposome, with control vector or with no transfection, were cultured in the hypoxia environment simulated through CoCl2. The expressions ofHIF-1αmRNA, HIF-1αprotein of the different groups of MSCs were compared.ResultspcDNA3.0-HIF-1α-eGFP could be transfected into MSCs by the liposome method successfully and the efficiency of the transfection is 21%. MSCs transfected withHIF-1αcan be induced to differentiate to osteoblast and lipoblast successfully andHIF-1αtransfection may increase MSCs survival rate under hypoxia condition(Plt;0.05).The group ofHIF-1α-transfected cells express much moreHIF-1αmRNA and HIF-1α protein than the other two(Plt;0.05).ConclusionsThe study shows that the liposome can be used to transfectHIF-1αinto MSCs successfully and MSCs transfected byHIF-1αgene-recombined liposome can strongly expressHIF-1αmRNA and HIF-1α protein.
mesenchymal stem cell(MSC); hypoxia inducible factor-1(HIF-1); liposo-me; transfection
2013-01-24
2013-10-09
*通信作者(correspondingauthor): paulzhang_ 1979@hotmail.com
1001-6325(2014)03-0365-07
研究论文
Q 2-33
A

