胞浆轻链测定在多发性骨髓瘤的微小残留病变检测中的价值
朱 杰,高艳飞
(1.大连医科大学第二临床学院 检验科,辽宁 大连116027;2.辽河油田第二医院 检验科,辽宁 盘锦12400)
多发性骨髓瘤(multiple myeloma,MM)是以克隆性恶性浆细胞(骨髓瘤细胞)在骨髓中异常增殖,并伴有单克隆免疫球蛋白(monoclonal immunoglobulin)增多为特征的疾病,多发于中老年人,临床表现多种多样,主要表现为骨髓瘤细胞增生、浸润和破坏骨组织及髓外其他组织,出现骨痛、病理性骨折、贫血、出血,以及骨髓瘤细胞产生大量单克隆免疫球蛋白而出现感染、高钙血症、肾脏病变、高粘滞血症、淀粉样变等。经典的化疗方案缓解率低,随着新药问世、联合化疗和骨髓造血干细胞移植等新技术的应用,MM患者的缓解率不断提高。近年来研究表明,多参数流式细胞术免疫表型分析有助于MM诊断,缓解后患者体内MRD分析是判断疗效和预后的重要指标,目前国内有关MRD的报道多是应用于骨髓瘤细胞的膜表面免疫表型。本研究应用多参数流式细胞术进行胞浆轻链的测定来建立MRD分析方案,并探讨其临床意义。
1 材料与方法
1.1 研究对象
样本来源:选取2010年1月至2012年11月大连医科大学附属第二医院住院确诊MM患者中经化疗后完全缓解病例45例,其中女性12例,男性33例,中位年龄60岁;初诊骨髓细胞学检查瘤细胞占(15-95%),其中分泌型为37例(IgG型为27例,IgA型为10例)轻链型为5例(λ链型4例,κ链型1例),不分泌型3例,其完全缓解后形态学及血清学均为阴性。
1.2 仪器
流式细胞仪:FACSCalibur美国BD公司。
1.3 试剂
CD38-FITC/CD56-PE/CD19-Percp、 CD138-PE、CD45-APC、κ-FITC/λ-PE/ CD19-Percp、κ-FITC/λ-PE、IgG2a-FITC、IgG1-PE,溶 血 素、破 膜剂,以上试剂均购自美国BD公司。
1.4 标本的采集
无菌操作抽取0.2ml骨髓液涂片作显微镜形态学检查。另抽取2ml置于EDTA-K2抗凝血常规管作微小残留病变检测,48h内完成检验。
1.5 标本的处理
骨髓涂片行瑞氏-吉姆萨染色,显微镜下观察并分类计数200个有核细胞。抗凝的骨髓液l ml,加3 ml PBS液,混匀后,在水平离心机上离心(1 500r/min,5min),弃去上清液,加1ml PBS液,计数白细胞数,调节至5×106/ml,制成细胞悬液备用。
1.6 实验方法
1.6.1 胞膜的标记及胞浆内轻链的标记
①胞膜的标记:每管100μl细胞悬液分别加入(IgG2a-FITC、IgG1-PE、CD45-APC)、(CD38-FITC/CD56-PE/CD19-Percp、CD45-APC)、 (CD138-PE、CD45-APC)、(κ-FITC/λ-PE/CD19-Percp、CD45-APC)各20μl,混匀避光15min,加配置好的溶血素2ml,避光10min,在水平离心机上离心(1 500r/min,5min),弃去上清液,加1ml PBS液,混匀备用。
②胞浆内轻链的标记:取两只试管,每管100μl细胞悬液分别加入CD45-APC 20μl,避光15min,再加入破膜剂A液100μl,避光10min,加溶血素2 ml,避光10min,在水平离心机上离心(1 500r/min,5min),弃去上清液,加入破膜剂B液50μl,分别加 入 (IgG2a-FITC、IgG1-PE)、(κ-FITC/λ-PE),避光15min,加2ml PBS洗涤,在水平离心机上离心(1 500r/min,5min),弃去上清液,加1ml PBS液,混匀备用。
1.6.2 流式细胞仪测定 用荧光微球校准仪器及补偿后,用Cellquset软件收取200000-400000个细胞,通过CD45/SSC和CD38/CD56联合设门,确定瘤细胞的位置及抗原表达情况。
1.6.3 MRD分析 以胞浆κ/λ抗体为核心,组合CD38、CD56、CDl9、CD45、CD138进行四色 MRD分析。根据此前的免疫分型,本研究设计了以下2种瘤细胞的免疫组合:CD19-CD38+CD56+CD45-CD138+和CD19-CD38+CD56-CD45-CD138+,来寻找浆细胞的位置,最后根据异常胞浆κ/λ的表达,来确定MRD的阳性率,其目的主要是排除正常浆细胞和其他有核细胞干扰。结果判断:目标细胞异常轻链表达>0.1%[1-4],即为 MRD阳性。
1.6.4 数据分析 应用SPSS11.1软件包进行统计学分析,对应两组应用t检验。
2 结果
2.1 45例形态学及血清学完全缓解的多发性骨髓瘤患者确诊前免疫表型及胞浆轻链表达见表1,其中免疫表型为CD38+CD56-CD138+CD19-CD45-主要见于轻链型和不分泌型。
2.2 两种免疫表型的 MRD阳性率见表2,其中CD38+CD56-CD138+CD19-CD45-的MRD的阳性率明显高于CD38+CD56+CD138+CD19-CD45-,两者比较P<0.05。
2.3 两种胞浆轻链的MRD阳性率见表3,两者比较无显著性差异,P>0.05。
2.4 45例MM患者缓解后进行MRD检测,其中14例MRD阳性,31例MRD阴性。对此45例患者进行随访,病例随访时间最长为24个月,最短为2个月。MRD阴性组4例复发(13%),MRD阳性组10例复发(71%),两组复发率差异有统计学意义,P<0.05。MRD阴性组的累积无病生存时间中位数为15.53(9.35-21.62)个月,明显长于 MRD阳性组的9.75(3.69-14.24)个月,两组比较差异有统计学意义,P<0.05。结果见表4。

表1 45例多发性骨髓瘤细胞确诊时免疫表型及胞浆轻链的表达

表2 不同免疫表型骨髓瘤的MDR的阳性率
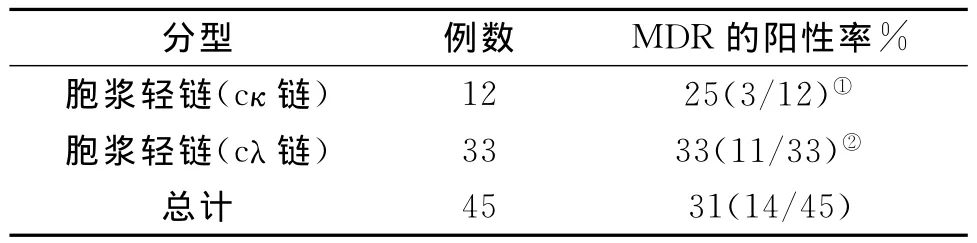
表3 不同胞浆轻链型骨髓瘤的MDR的阳性率

表4 不同MDR表现的复发率和生存期
3 讨论
MM传统意义上CR患者体内仍残留约1010个肿瘤细胞,被认为是疾病进展和复发的根源。传统的形态学检测和血、尿蛋白电泳等方法分析MRD有一定的局限性。形态学是最普遍、最基础的检测手段,在一定程度上可反映治疗的效果。但骨髓瘤细胞常呈灶状或斑点状分布,穿刺部位不同、骨髓稀释、制片不佳导致骨髓瘤细胞堆积在片尾或边缘都会降低瘤细胞的比例,且形态学上不易与正常浆细胞区分,也难以反映缓解期内肿瘤负荷的变化,且灵敏度仅能达到5×10-2水平。血、尿蛋白电泳可间接反映肿瘤负荷量,但特异性较低,敏感度也不高。我们采用流式细胞术研究MM细胞的免疫表型特征及胞浆轻链的表达,以期建立更好的监测MRD的方法,为MM的预后判断和个体化治疗提供可靠依据[5-8]。
根据文献报道CD138(Syndecan-1)是浆细胞特异性抗原,新近欧洲骨髓瘤协作组(European MyelomaNetwork,EMN)在流式细胞术免疫分型方面达成共识,推荐 MM分型至少要用CD38、CD138、CD45中的一种抗体识别浆细胞,初诊设浆细胞门要基于CD38/CD138的共表达(应有文献支持)。我们在此基础上增加CD56、CD19、胞浆轻链(κ/λ)的检测,在45例的患者中,瘤细胞的免疫表型为两种CD38+CD56+CD138+CD19-CD45-和CD38+CD56-CD138+CD19-CD45-,并且都表达一种胞浆轻链,根据以上免疫表型,我们利用CD38、CD56、CD138、CD19、CD45来确定浆细胞的位置,并检测胞浆内轻链的含量来确定是否是骨髓瘤细胞的残余。这比其他的文献报道的仅仅利用浆细胞的膜表面的标志来确定瘤细胞的含量更加准确和客观。利用瘤细胞产生单克隆的胞浆轻链的特性,避免把一些正常的浆细胞记入为瘤细胞[9-11]。
在本研究中发现免疫表型为CD38+CD56-CD138+CD19-CD45-
的多发性骨髓瘤患者均为轻链型和不分泌型,并且MRD的检测均为阳性,提示此型的预后较差,但因收集的标本例数较少,此结果在今后的工作中收集到更多的标本再详述。
MRD阳性的患者其复发率高于阴性的患者,而生存期短于阴性的患者,这就为临床监测和治疗骨髓瘤疾病提供了可靠的依据。对于处于完全缓解期的骨髓瘤患者,如果发现MRD阳性,应该巩固治疗,以期望 MRD转为阴性,来获得更好的疗效[12,13]。
对于骨髓瘤MRD的检测,我们认为初诊时应全面分析MM患者免疫表型和胞浆轻链,特别是对一些轻链型和不分泌型的骨髓瘤患者,检测胞浆轻链显得尤为重要,这样才能为以后的MRD检测提供更可靠的依据。
尽管高剂量化疗联合自体造血干细胞移植已经可以使多数MM患者达到完全缓解,但复发仍是临床影响患者生存期的主要问题。多参数流式细胞术是目前敏感性和特异性都很高的检测MRD的方法[14,15]。应用四色免疫荧光流式细胞术,CD45-APC/SSC及 CD38/CD56/CD19 及 CD138联合设门,通过检测胞浆内轻链(cκ链、cλ链)对多发性骨髓瘤微小残留病变监测以及临床判断预后具有重要价值,并对临床开展相关治疗具有指导意义。
[1]陈葆国,罗文达,李伯利,等.多发性骨髓瘤流式细胞术免疫表型及微量残留病研究[J].中华检验医学杂志,2011,34:10.
[2]张之南.血液病诊断及疗效标准[M].第2版.北京:科学出版社,1998:373.
[3]J Pefetti V,Viguarelli MC,Palladini G,et al.Insights into the regulation of immunoglobulin light chain gene rearrangements via analysis of thekappa light chain locus in lambda myeloma[J].Immunology,2004,112:420.
[4]古 建,肖 平,陈焯文.微小残留病灶监测在多发性骨髓瘤的临床预后应用[J].中国热带医学,2012,12(7):848.
[5]Rawstron AC,Orfao A,Beksac M,et a1.Report of the European Myeloma Network on muhiparametric flow cyt0metry in muhiple myeloma andrelated disorders[J].Haematologica,2008,93:431.
[6]Gupta R,Bhaskar A,Kumar L,et a1.Flow Cytometric Immunophenotyping and Minimal Residual Disease Analysis in Multiple Myeloma.Am JClin Pathol,2009,132:728.
[7]J Lin P,Owens R,Tricot G,et a1.Flow Cytometrie immunophenotypic analysis of306cases ofmultiple myeloma[J].Am J Clin Pathol,2004,121:482.
[8]Cumova J,Kovarova L,Potacova A,et a1.Optimization of immunomagnetic selection of myeloma cells from bone marrow using magnetic activatedcell sorting[J].Int J Hematol,2010,92:314.
[9]秦 燕,丁润生,陆 伟.多参数流式细胞术在多发性骨髓瘤诊断中的价值[J].交通医学,2009,23(2):137.
[10]李金兰,刘艳荣,常 艳.多发性骨髓瘤细胞的免疫表型特点[J].中国实验血液学杂志,2002,10(3):226.
[11]Rawstron AC,OrfaoA,BeksacM,et a1.Report ofthe European-Myeloma Network on muhiparametric flow cometry in multiplemyeloma and related disorders[J].Haematologiea,2008,93:431.
[12]Gupta R,Bhaskar A,Kumar L,et a1.Flow CytomemcImmunophenotyping an d Minimal Residual Disease Analysis inMultiple Myeloma[J].Am J Clin Pathol,2009,l32:728.
[13]Carlo-Stella C,Guidetti A,Dinicola M,et a1.CD52antigenexpressed by malign an t plasma cells can be targeted byalemtuzumab in vitro in NOD/SCID mice[J].Exp Hematol,2006,34:721.
[14]庞 妍,李 力,邝丽萍,等.多发性骨髓瘤免疫表型研究进展[J].中国实验血液学杂志,2011,19(6):1518.
[15]朱永梅,陈赛娟.微小残留病检测方法及其临床应用[J].中国实验血液学杂志,2005,13(6):1131.

