连接蛋白Cx43参与冠状动脉平滑肌细胞的异质性促进冠脉再狭窄
张旭敏,马晓烨,王小东,姚义安
(同济大学附属东方医院 心内科,上海200120)
血管平滑细胞增殖及从中膜向内膜迁移是动脉粥样斑块演变和支架术后再狭窄形成的基本过程[1],其中内皮细胞损伤是再狭窄始动因素[2],血管平滑肌细胞的增值、迁移、凋亡及细胞外基质合成降解是病理基础。已有实验证实血管壁平滑肌细胞具有异质,当血管受到损伤后,释放炎症因子诱导血管中层特定种类平滑肌细胞迁移并聚集在血管内膜[3],增殖并分泌细胞外基质,并促进新生内膜形成参与血管重建[4];血管平滑肌细胞迁移是动脉粥样硬化、血管成形术以及冠状动脉支架术后再狭窄等临床常见血管病变共同病理基础[5,6],因此对于平滑肌细胞迁移机制的深入研究对于更好治疗血管疾病及预防冠状动脉支架术后再狭窄有重要意义。
缝隙连接是相邻的细胞间进行离子及小信号分子传导交换通道,它几乎存在于哺乳动物所有组织和细胞中,每一个通道、连接蛋白都有独特的成分[7],血管结构中可检测4种连接蛋白即:Cx37、Cx40、Cx43和Cx45,其分布主要取决于血管大小、血管树部位及动物种属[8];平滑肌细胞主要表达Cx43,有些平滑肌细胞表达Cx40,通过这些蛋白完成细胞间信息沟通[9]。已有实验观察到在鼠动脉硬化生长阶段血管内膜Cx43表达增加[10],减少Cx43表达限制动脉粥样硬化发展[11]。但目前有关Cx43在支架术后再狭窄中的作用尚不明确。
1 材料与方法
1.1 主要材料 超低温冰箱(日本SANYO公司)、细胞培养基(DMEM,美国GIBCO公司)、20%的胎牛血清(FCS,美国GIBCO公司、)PCR仪(Applied Biosystems 7900HT Fast Real-Time PCR System)、投射电镜 (日本olympus公司)、光镜(日本olympus公司)、胰酶(Gibco公司)、Cx40、Cx43、S100A4、α-SMA二抗山羊抗兔抗体,action二抗山羊抗小鼠抗体,均为Abcam公司生产,其他试剂均为国产。
1.2 血管平滑肌细胞培养
根据同济大学动物伦理委员会批准,将3月龄家猪雌雄不限,动物来源于复旦大学附属中山医院动物实验室,随机于前降支,回旋支或右冠状动脉血管置入裸支架一枚(微创Firebird),经1月后再次行冠状动脉造影证实再狭窄的麻醉后处死,取狭窄段冠状动脉,用冷D-Hanks液冲洗后放在另一玻璃平皿上,用眼科剪沿血管纵向剖开,用手术刀片背面轻轻刮除内皮层,取动脉中膜层,采用组织贴壁法培养冠状动脉中层平滑肌行原代细胞培养,正常3月家猪未经任何处理为对照组处死,分离冠状动脉前降支、回旋支、右冠状动脉,纵形破开分离出中层,进行原代细胞培养;2组平滑肌细胞培养基(DMEM,美国GIBCO公司)培养,加入20%的胎牛血清(FCS,美国GIBCO公司)放入37℃,体积分数5%的CO2培养箱(Thermo公司),逐日倒置显微镜观察,每隔3d换1次液。
1.3 正常冠脉平滑肌细胞PDGF诱导
经原代培养正常冠脉平滑肌细胞在细胞培养基(DMEM,美国GIBCO公司)培养,20%的胎牛血清(FCS,美国GIBCO公司),将贴壁90%细胞用胰酶消化1min后,依次铺入六孔板内,24h贴壁牢固后,加入 PDGF-BB (10ng/mL,Roche)共同培育,PDGF-BB浓度为10ng/mL[12],作用24h;电镜,光镜观察细胞形态及结构变化;PCR测定连接蛋白表达;然后加入连接蛋白阻断剂(18-a_glycyrrhetinic acid浓度100μmol/L)[12],阻断作用48h,后分别在24h、48h电镜观察细胞结构变化及连接蛋白变化。实验分为3组:正常对照组;诱导组:PDGF-BB(10 ng/ml);阻断组:PDFG-BB(10ng/ml)+Cx43阻断剂(100μmol/L)。各组细胞培养24h后收集用于以下各项指标检测。
1.4 光镜观察冠脉大体标本
冠状动脉大体标本,分为正常及支架组苏木精-伊红染色,光镜观察血管壁厚度及细胞形态。
1.5 电镜观察SMC细胞形态及结构
离心收集贴壁细胞,2.5%戊二醛固定2-3h,1%娥酸固定2-3h,脱水临界点干燥,包埋、固化,超薄切片机切片50-60nm,3%醋酸铀-枸橼酸铅双染色,投射电镜(日本olympus公司)观察平滑肌细胞形态与结构。
1.6 实时荧光定量PCR测定Cx43、Cx40mRNA的表达
Trizol一步法抽提正常组及支架组冠状动脉平滑肌细胞RNA。测定总RNA纯度、浓度及RNA完整性的检测,进行逆转录反应及cDNA合成(RT)和聚合酶链式反应(PCR)。放入荧光定量PCR 仪 (Applied Biosystems 7900HT Fast Real-Time PCR System),反应结束后,仪器自动进行溶解曲线分析,并计算得到每个样本的ct值,以GAPDH为内参照,计算得到目的基因mRNA的含量。
1.7 统计分析
统计采用均数±(SD),应用Prism Version 5.0软件(GraphPad Software Inc.,San Diego,CA),方差分析(ANOVA)。
2 结果
2.1 猪冠状动脉细胞原代培养
正常冠状动脉平滑肌细胞胰酶消化后分离,光镜下可见两种形态:纺锤型(spindle-shaped,SSMC)和长菱形(rhomboid,R-SMC),纺锤型细胞呈现谷峰生长模式,长菱形呈单层生长趋势,同文献所描述[1],而在支架植入再狭窄组分离类长菱形为主,见图1。
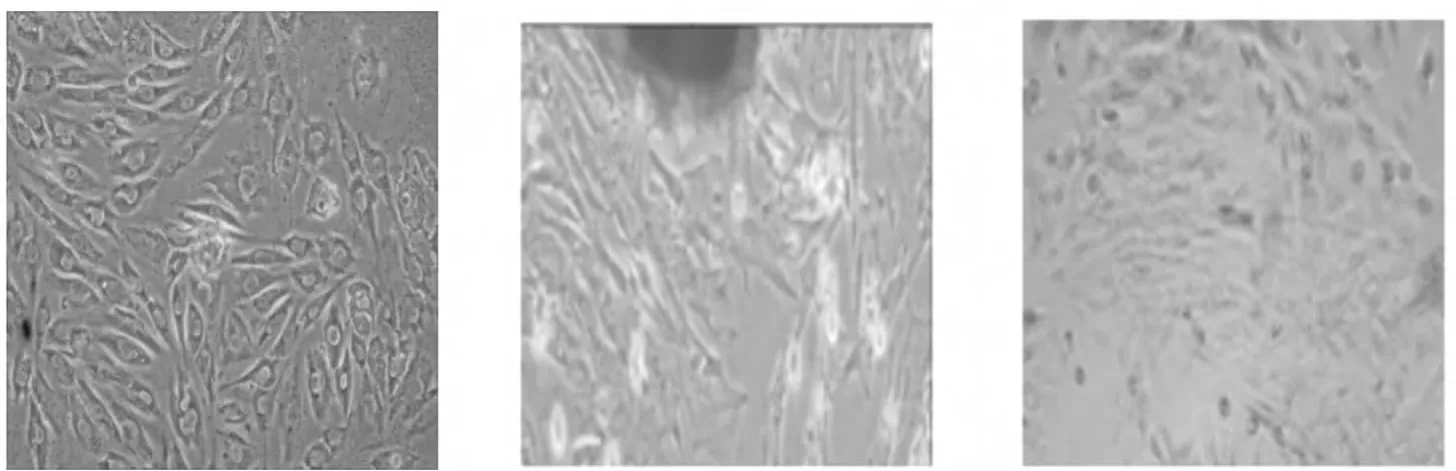
图1 正常R-SMC 正常S-SMC 支架组原代细胞
2.2 正常冠状动脉平滑肌细胞经PDGF诱导后细胞形态
在本实验中证实诱导猪冠状动脉平滑肌细胞表型转变与 Li[13]报道相同。
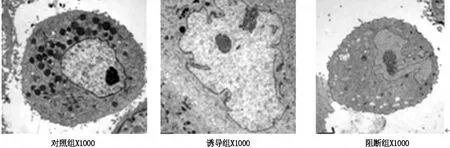
图2 透射电镜观察细胞超微结构
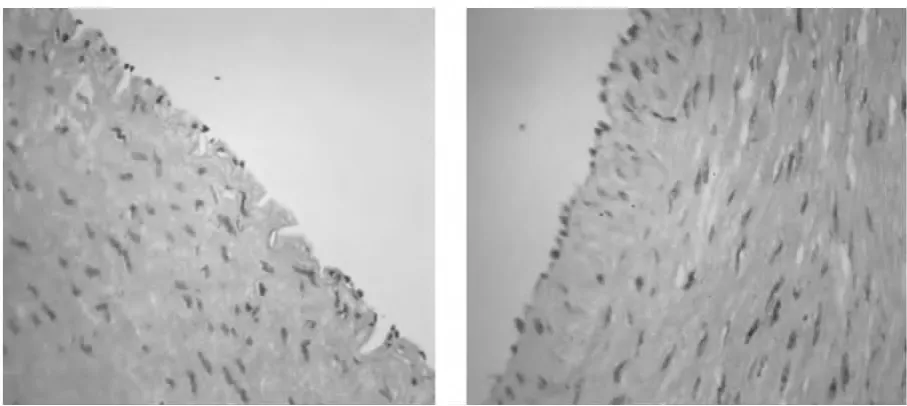
图3 正常组X400 支架组X400
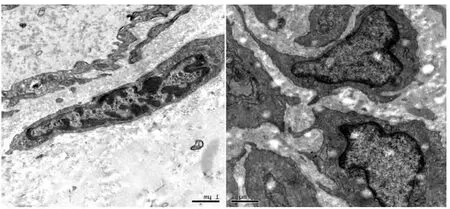
图4 正常10000X 支架术后10000X
如图加入10ng/mLPDGF-BB后,细胞增殖加速,抑制分化。故诱导组可以看出细胞核仁复制分裂,但是细胞膜分裂还未完成;当加入100μmol/LCX43阻断剂后,又抑制细胞分裂,见图2。
2.3 支架植入后
血管内膜明显增厚,光镜观察血管中层以RSMC细胞为主,免疫荧光检测Cx43表达明显增加,见图3。
透射电镜下见正常冠状动脉平滑肌细胞呈梭状形态,核呈锯齿状,胞浆内含平滑肌细胞特征性结构肌丝和密体,粗面内质网扩张,游离核糖体丰富,并含有大量高尔基体。支架组的冠状动脉平滑肌细胞质内出现有大的空泡状结构,且体内也有少量凋亡小体出现,细胞器线粒体、高尔基体、内质网等相对于正常组数量减少,见图4。
2.4 连接蛋白表达变化
正常冠状动脉平滑肌细胞Cx40表达为主,Cx43少量表达,当加入PDGF共同培育后可见细胞超微结构发生变化,并且细胞蛋白表达发生变化,诱导后以Cx43表达为主,Cx40少量表达,与Christos E[14]报道相同。支架植入术后Cx43表达增多,见图5,6。
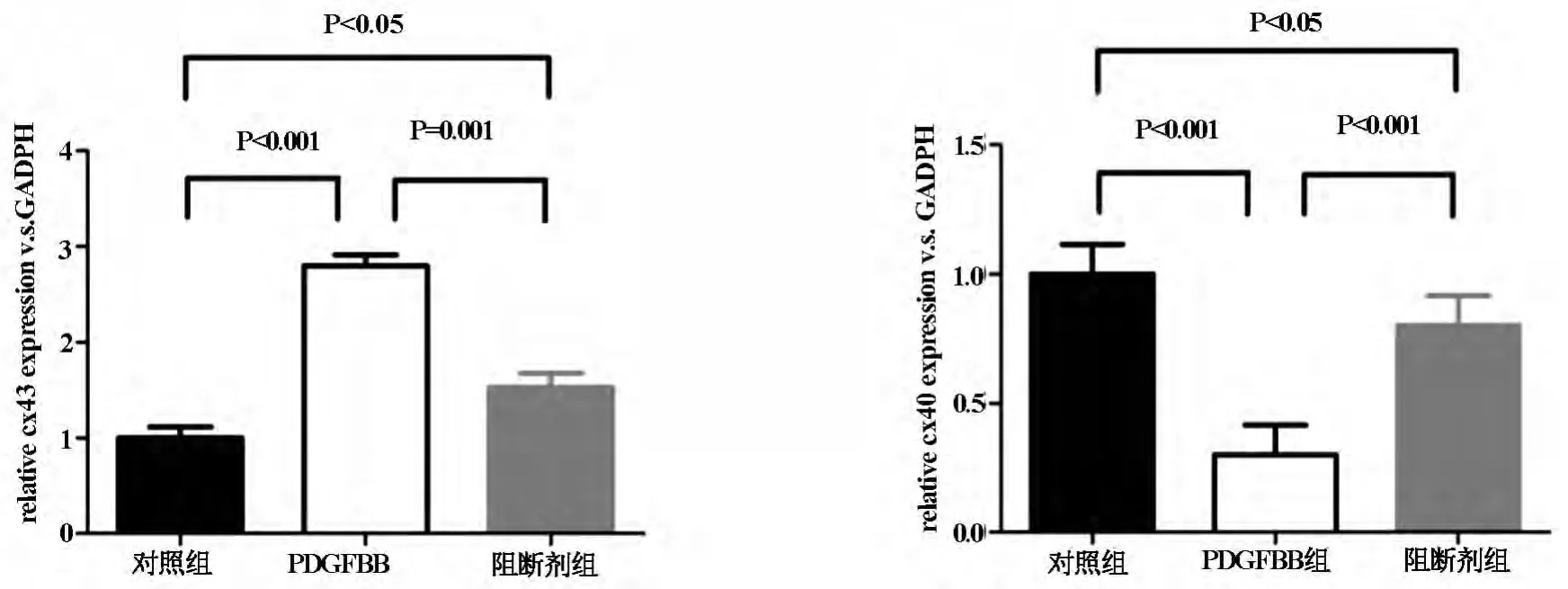
图5 PDGF-BB诱导及阻断Realtime PCR图
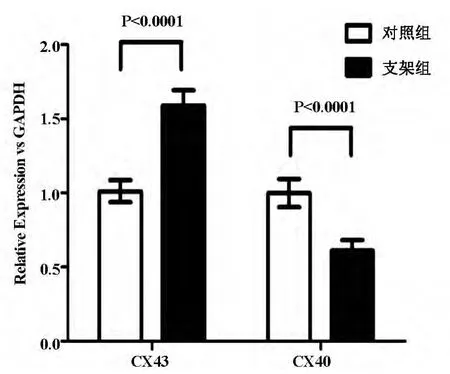
图6 支架植入术Realtime PCR图
3 讨论
冠状动脉支架术后再狭窄是血管损伤反应引起新生内膜增生与血管重塑的过程,正常血管平滑肌位于血管中层,周围被基质所包绕,基质与平滑肌接触从而发挥生物屏障和机械屏障作用,使平滑肌处于收缩型,限制其移动。在此研究中分离正常猪冠状动脉平滑肌细胞,体外显示两种不同类型:纺锤型(spindle-shaped,S-SMC)和长菱形(rhomboid,RSMC),以S-SMC占比率较高,R-SMC比率较少。当血管损伤后释放各种细胞因子、组织因子和炎症介质,在以上因素作用下中膜平滑肌细胞激活,发生表型改变,由收缩型变为合成型,大量分泌细胞外基质,细胞外基质增加促进平滑肌细胞向内膜迁移、增值[12];血小板源性生长因子(PDGF)是一种炎性因子,它可与细胞膜上PDGF受体结合,可促进细胞有丝分裂,我们将体外正常组平滑肌细胞经PDGF-BB诱导,使S-SMC变为R-SMC,同时伴有Cx43表达上调,过反义RNA降低Cx43表达,这种变化受抑制,S-SMC平滑肌细胞保持原有形态,同时表达a-肌动蛋白。因此,体外证实Cx43表达与平滑肌细胞表型及细胞增殖密切相关。
本实验成功制造冠状动脉支架植入术后再狭窄模型,狭窄的冠状动脉,经HE染色发现内膜明显较正常组增厚,在增厚内膜可见R-SMC占高比率,SSMC几乎很少,同时伴大量巨噬细胞,细胞培养RSMC比S-SMC有更强增值、迁移能力,同时与正常组比通过PCR检测Cx43表达明显增加,因此Cx43参与动脉损伤后修复和再狭窄过程。血管平滑肌细胞迁移、增值是血管重塑启动阶段重要的细胞学基础,是冠状动脉支架术后再狭窄主要原因[15]。
关于连接蛋白与再狭窄相关性研究主要涉及平滑肌细胞,在此研究中观察猪冠状动脉平滑肌细胞表型变化与连接蛋白变化相关性,我们观察到细胞表型与文献报导人主动脉细胞类型相类似[16]。我们研究从体外细胞培养后应用PDGF诱导,以及体内通过支架再狭窄后细胞形态研究均提示连接蛋白Cx43表达与平滑肌细胞表型变化和迁移密切相关。虽然目前机制尚不清楚,但是以连接蛋白Cx43为目标靶向治疗可能成为预防再狭窄新起点。
[1]Shu ZW,Yu M,Chen XJ,et al.Ghrelin Could be a Candidate for the Prevention of In-Stent Restenosis[J].Cardiovasc Drugs Ther,2013,27(4):309.
[2]Yuan JX,Rubin LJ.Pathogenesis of pulmonary arterial hypertension:the need for multiple kits[J].Circulation,2005,111(5):534.
[3]Hao H,Ropraz P,Verin V,et al.Heterogeneity of smooth muscle cell populations cultured from pig coronary artery[J].Arterioscler Thromb Vasc Biol,2002,22(7):1093.
[4]Kaiura TL,Itoh H,Kubaska SM,et al.The effect of growth fac-tors,cytokines,and extracellular matrix proteins on fibronectin production in human vascular smooth muscle cells[J].J Vasc Surg,2000,31(3):577.
[5]Turner EC,Huang CL,Govindarajan K,et al.Identification of a Klf4-dependent upstream repressor region mediating transcriptional regulation of the myocardin gene in human smooth muscle cells[J].Biochim Biophys Acta,2013,1829(11):1191.
[6]Schwartz SM.Smooth muscle migration in atherosclerosis and restenosis[J].Clin Invest,1997,100(11Suppl):S87.
[7]Kurtenbach S,Zoidl G.Gap junction modulation and its implications for heart function[J].Front Physiol,2014,27(5):82.
[8]Figueroa XF,Isakson BE,Duling BR.Vascular gap junctions in hypertension[J].Hypertension,2006,48(5):804.
[9]Figueroa XF,Duling BR.Gap junctions in the control of vascular function[J].Antioxid Redox Signal,2009,11(2):251.
[10]Kwak BR,Mulhaupt F,Veillard N,et al.Altered pattern of vascular connexin expression in atherosclerotic plaques[J].Arterioscler Thromb Vasc Biol,2002,22(2):225.
[11]Kwak BR,Veillard N,Pelli G,et al.Reduced connexin43expression inhibits atherosclerotic lesion formation in low-density lipoprotein receptor-deficient mice[J].Circulation,2003,107(7):1033.
[12]Ma X,Pearce JD,Wilson DB,et al.Loss of the hyaluronan receptor RHAMM prevents constrictive artery wall remodeling[J].J Vasc Surg,2013,59(3):801.
[13]Li P,Liu Y,Yi B,et al.MicroRNA-638is highly expressed in human vascular smooth muscle cells and inhibits PDGF-BB-induced cell proliferation and migration through targeting orphan nuclear receptor NOR1[J].Cardiovasc Res,2013,99(1):185.
[14]Chadjichristos CE,Morel S,Derouette JP,et al.Phenotypic Change in Porcine Coronary Artery Smooth Muscle Cells Targeting Connexin 43Prevents Platelet-Derived Growth Factor-BB_Induced[J].Circ Res,2008,102(6):653.
[15]Austin KM,Nguyen N,Javid G.Noncanonical matrix metalloprotease-1-protease-activated receptor-1signaling triggers vascular smooth muscle cell dedifferentiation and arterial stenosis[J].J Biol Chem,2013,288(32):23105.
[16]Li S,Fan YS,Chow LH,et al.Innate diversity of adult human arterial smooth muscle cells:cloning of distinct subtypes from the internal thoracic artery[J].Circ Res,2001,89(6):517.

