电化学生物传感器的研究进展
张义红 许文静 杨 坤
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学技术大学纳米科学技术学院 苏州 215123)
1 引 言
近年来,随着材料学、生物学、电化学等学科的快速发展,电化学传感技术取得了长足进步,大量的新型电化学传感器先后被报道。在生物医学领域,传统的检测方法因检测周期长、灵敏度低、操作繁琐,在临床应用中受到限制。因此开发快速简单、灵敏度高、特异性好的检测方法具有重大科学意义与应用价值。作为一种新型的检测手段,电化学生物传感器已广泛应用于生物医学与药学筛选等领域[1-4]。
电化学传感技术的核心是传感器。传感器是由活性识别物质和信号转换器组成的检测装置,它将感受到的信息按一定规律转换为电信号的信息输出,从而将信息转换成可测量信号[5]。电化学传感器具有制备简单、成本低、操作简单、快速、稳定性好、特异性强、灵敏度高及不破坏测试体系等诸多优点[1,5],在临床医学[6,7]、药物检验[8,9]、食品分析[10]和环境监测[11,12]等领域得到广泛应用,是目前发展最成熟的一种传感器件。
本文简单介绍了电化学生物传感器的工作原理和分类,重点综述了电化学生物传感器近年来的研究进展及其在生物医学中的应用,并对电化学生物传感器目前存在的问题和发展前景进行展望。
2 电化学生物传感器
2.1 基本原理
电化学生物传感器主要分为生物分子识别元件和信号转换元件两部分。生物分子识别元件由具有分子识别功能的生物敏感膜(如酶、微生物、组织、抗体抗原、核酸和细胞等)组成[13],用于检测样品中是否含有待测物质。识别元件检测到的信号进一步由信号转换元件转换为可测量的电化学信号。根据可测量电化学信号的不同可分为电导型电化学生物传感器、电位型电化学生物传感器、电流型电化学生物传感器与阻抗型电化学传感器等[14,15]。其中,电导型电化学生物传感器是测量溶液中一对电极间的电导变化;电位型电化学生物传感器是测量工作电极与参比电极间的电位变化;电流型电化学生物传感器是在恒电压条件下测量通过电化学池的电流;而阻抗型电化学传感器则是测量交流电势与电信号的比值随正弦频率的变化。
2.2 电化学生物传感器的分类
根据生物分子识别元件的生物敏感膜的不同,电化学生物传感器大致可分为酶传感器[16]、核酸适体传感器[17]、免疫传感器[18]与微生物传感器[19]等。因酶传感器、核酸适体传感器和免疫传感器在生物医学领域、食品检测和环境监测等领域具备广阔的应用前景,近年来的研究也多集中于此,因此这三种电化学生物传感器得到了更为显著的发展。
2.2.1 电化学酶传感器
电化学酶传感器将酶与底物相互作用和电化学分析功能相结合,是目前研究最广泛的电化学生物传感器[18],其典型应用为葡萄糖的检测。葡萄糖氧化酶和辣根过氧化酶在酶传感器的构建中被广泛应用。电化学酶传感器由 Clark 和 Lyons于 1962 年首次提出[20],此后得到了迅速发展,广泛应用于食品安全、环境监测、重金属和农药检测等领域[21-24]。近年来,新型的纳米技术和材料科学在电化学酶传感器上的成功应用,进一步推动了电化学酶传感器的进步。
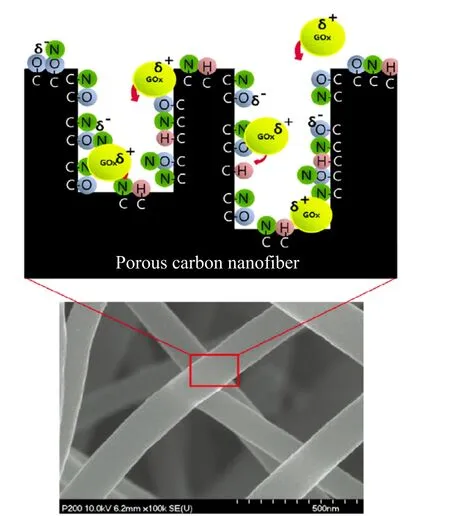
图1 亲水性基团与酶之间导电性及相互作用的概念模型Fig. 1. Conceptual model of the conductivity and interactions between the hydrophilic groups and the enzyme
图1 所示为典型的电化学酶传感器构建方法。KOH 活化电纺碳纤维能够提高葡萄糖氧化酶的吸附性,而活化的碳纤维与尿素反应则能增强传感器的亲水性。实验证明经过尿素处理的活性炭纤维的灵敏度比未经尿素处理的高 2~3倍,因而在基于活性炭纤维的聚丙烯腈表面引入亲水性含氮官能团,可以提高电化学酶传感器电极的灵敏度[25]。
石墨烯是一种由碳原子组成的呈蜂巢晶格状的平面薄膜,将葡萄糖氧化酶与石墨烯共价结合并固定到聚吡咯修饰的电极表面,组装的酶传感器可用来检测葡萄糖。实验结果表明聚吡咯-石墨烯-葡萄糖氧化酶电极的性能明显优于聚吡咯-石墨烯电极[26]。复位的氧化石墨烯片具有不同的缺陷密度、层面和含氧量,将之修饰到葡萄糖氧化酶电极上可建立一种酶传感器。通过优化和控制石墨烯的结构及其衍生物,这种酶传感器检测葡萄糖具有响应快、灵敏度高、亲和性好等优点[27]。
2.2.2 电化学核酸适体传感器
核酸适体具有易标记、高特异性、高选择性、小分子量、良好稳定性、适用范围广等优点。近年来,电化学核酸适体传感器成为电化学传感器研究的热门课题[28],广泛应用于蛋白质和核酸等小分子的检测[29-33]。另外,纳米材料和探针优化可显著提高核酸适体传感器的灵敏度与选择性。
碳纳米管能够促进生物分子与基底电极间的电子转移,在固定生物分子方面有广阔的应用前景。单壁碳纳米管具有比表面积大等独特性质,可应用于信号增强方面的研究。我们曾提出一种基于单壁碳纳米管的传感信号增强机制,将单壁碳纳米管与标记有亚甲基蓝的单链DNA 结合制备了一种纳米生物复合材料,这种复合材料作为信号增强平台可以促进电化学标记与电极间的电子转移(如图 2)。基于此纳米复合材料的电化学核酸适体传感器灵敏度高、线性范围广且检测限低(1.0 pM),甚至能够区分单碱基错配的 DNA[30]。
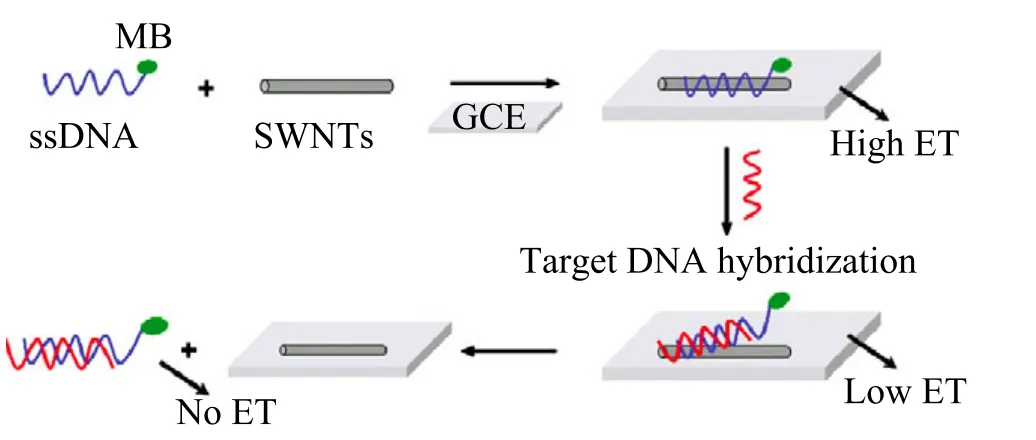
图2 基于单壁碳纳米管的电化学生物传感器检测 DNA 示意图Fig. 2. Scheme of the SWNT-based electrochemical biosensor for nucleic acids detection
附加探针能够增加游离状态的报告探针与电极表面的接触并促进电子转移。将附着在金电极表面的硫醇化功能捕获探针、与捕获探针互补的亚甲基蓝修饰的报告探针、以及附着于捕获探针附近的附加探针三者结合,构建了一种高灵敏度的电化学 DNA 传感器[32](如图 3)。该电化学 DNA 传感器对 DNA 和蛋白质的检测限分别为2.0 pM 和 20.0 pM。这种电化学 DNA 传感器还可用于检测其他生物分子,例如 RNA、蛋白质与可卡因等小分子。
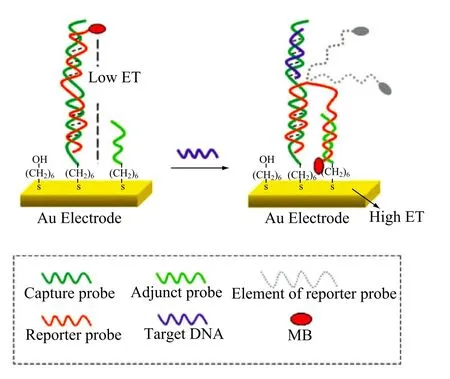
图3 电化学 DNA 传感器检测 DNA 示意图Fig. 3. Scheme of the electrochemical DNA biosensor for DNA detection
作为另一种被广泛应用的纳米结构材料,金纳米粒子具有比表面积大、吸附力强、适用性好以及导电性强等优点。DNA 功能化金纳米粒子与亲和素修饰的电极可构成一种信号放大的电化学 DNA 传感器(如图 4),此传感器灵敏度高、特异性强、检测方法简单,可检测皮摩尔级的目标DNA,并且能够区分单碱基错配的单链 DNA[33]。
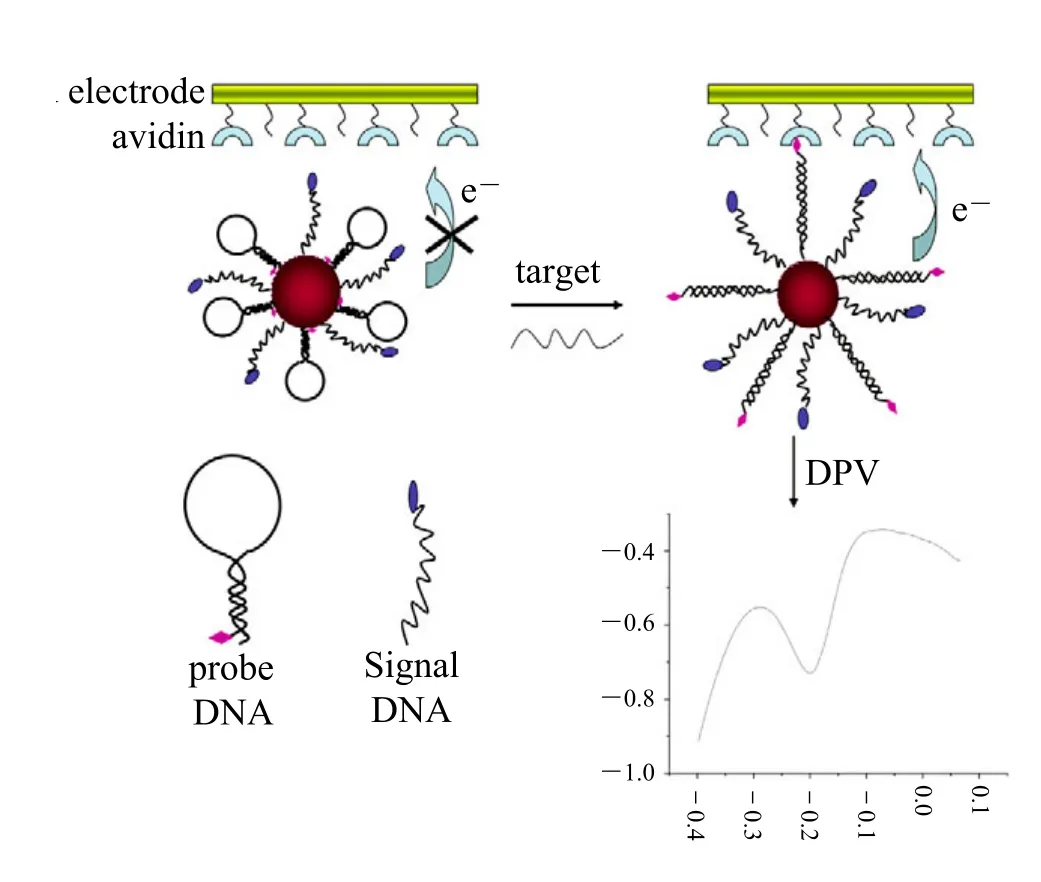
图4 DNA 功能化金纳米粒子传感器检测 DNA 示意图Fig. 4. Scheme of the DNA-functionalized Au nanoparticlebased electrochemical DNA sensor for DNA detection
2.2.3 电化学免疫传感器
电化学免疫传感器利用抗原和抗体间高特异性结合所产生的电信号变化对目标检测物进行识别。它具有操作简单、快速、灵敏、低成本、易集成化和小型化等优点,一直备受研究者的关注[34]。纳米材料的应用进一步提高了电化学免疫传感器的灵敏度[35]。双金属纳米多孔结构因其电化学催化活性高和生物相容性好等优势,在生物传感方面的应用受到越来越多的关注。一种新型的夹层式无酶电化学免疫传感器利用石墨烯作为平台,双金属多孔 PtFe 复合结构作为抗体信号载体实现信号增强(图 5),可用于癌症标志物糖抗原 CA15-3 的检测。实验结果证明这种传感器精确度高、信号稳定、重现性好,具有广阔的临床应用前景[36]。
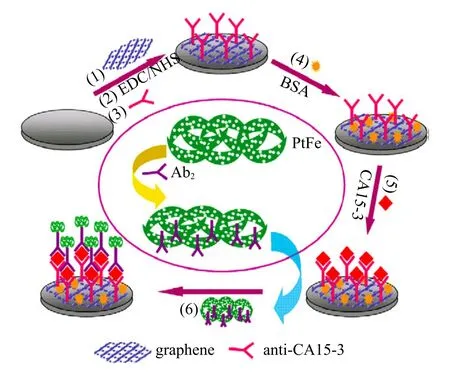
图5 夹层式免疫传感器组装过程示意图Fig. 5. Schematic illustration of the sandwich-type immunosensor fabrication process
SiC 以其高模数、高强度、良好抗腐蚀和抗氧化性等优点已被实际应用于催化氧化、光催化反应和线性饱和烃的异构化等领域。李灿鹏和林洁课题组以 Au @ SiC 纳米复合材料作为电极材料(如图 6),铁氰化物作为介质,构建了一种新型的无标记电化学免疫传感器,可应用于人绒毛膜促性腺激素检测[37]。这种传感器的检测灵敏度可达到 0.042 IU/L。
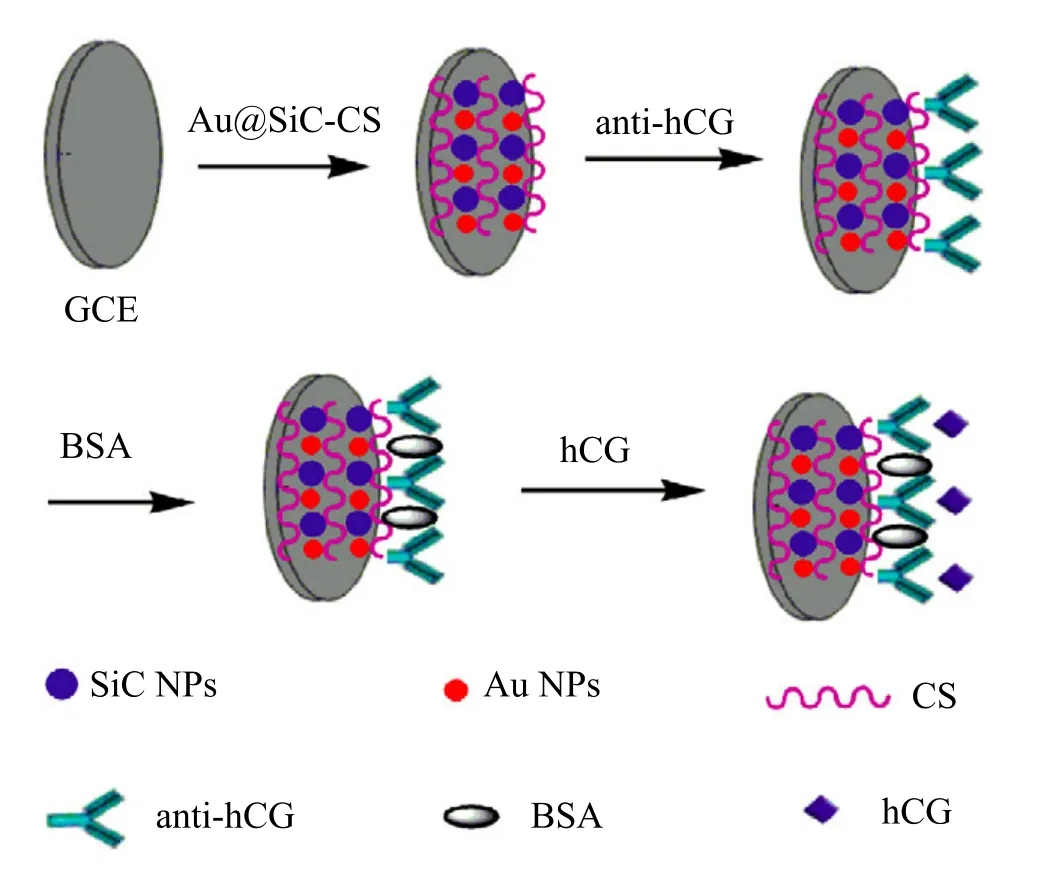
图6 无标记电化学免疫传感器制作过程示意图Fig. 6. Schematic illustration of the label-free electrochemical immunosensor fabrication process
银纳米粒子/硫堇/无限配位聚合物(AgNP/THI/ICP)纤维不仅有利于抗体的固定,还能促进电子转移。Lu 等[38]利用这些优点设计了一种无标记的电化学免疫传感器,可应用于癌胚抗原的检测,检测限可达 0.5 fg/mL。
2.2.4 电化学微生物传感器
微生物传感器的构建是通过化学方法(共价结合和交叉耦合)或物理方法(吸附和包埋)将微生物固定在传感器或基底电极上[19]。Toh 课题组通过脂多糖特异性抗体与巯基乙酸修饰的金电极共价结合构建了一种高灵敏电化学微生物传感器[39]。这种传感器在监控大肠杆菌的噬菌体感染方面表现出色,所需检测时间短(5 h),并且分析过程极其简单。
2.3 电化学生物传感器在生物医学中的应用
近年来,随着生物学、医学、纳米技术和新型材料学等与电化学技术的交叉融合,电化学生物传感技术将在生物医学研究中发挥着更加积极的作用。
2.3.1 基因诊断
基因诊断能够从分子结构水平和表达水平检测出基因的异常,从而对疾病做出判断。电化学生物传感器可以直接识别碱基序列并区别单碱基错配序列,在基因诊断中得到越来越多的应用。
杂交链式反应方法可应用于电化学生物传感器检测 DNA 序列。通过杂交链式反应和三氯化六铵合钌载体构造出树枝状 DNA 串联体以达到增强信号的目的,检测限可达 5 aM(如图 7),这种无酶、无标记的新型 DNA 传感器为基因诊断提供了一种新思路[40]。
Chen 等[41]利用两条辅助探针杂交串联引发远程自组装的机制,构建了一种能够增强信号的一维 DNA 纳米复合结构。基于此 DNA 纳米结构的传感器可用于复杂生物样品中的人类免疫缺陷病毒 DNA 超灵敏检测,检测限为 5 aM。

图7 基于树枝状 DNA 串联体的 DNA 传感器检测 DNA 和 ATP 示意图Fig. 7. Schematic illustration of DNA biosensor fabrication based on dendritic DNA concatamer for detection of target DNA (a)and ATP (b)
MiRNA-24 在细胞增殖和癌细胞分化中起着重要作用。Tang 课题组[42]将与 miRNA 互补的 DNA 探针固定在多壁碳纳米管修饰的电极表面,通过监测鸟嘌呤的氧化信号测定miRNA-24,检测限为 1 pM。这种简单、无标记的传感器还可检测复杂 miRNA 样品中的miRNA-24。
Radecki 课题组建立了双基因传感器[43]。这种传感器将两条分别修饰有二茂铁和甲基蓝的单链 DNA 探针通过 Au-S 键固定于金电极表面,通过“信号关”和“信号开”两种模式产生两种分析信号,可同时测定禽流感病毒 H5N1 中血球凝集素的 DNA 序列和神经氨酸苷酶的 DNA 序列。
2.3.2 肿瘤标志物测定
肿瘤标志物的含量与肿瘤的发生与归转过程具有密切关系。电化学分析是检测肿瘤标志物最有前景的方法之一。
电化学微流控阵列可用于口腔癌四种蛋白标志物的同时测定(如图 8)。这种电化学免疫传感器具有成本低、制作简单、灵敏度高和选择性好等优点,为口腔癌的诊断和个体化治疗提供了一种新方法[44]。

图8 超灵敏微流控阵列检测原理示意图Fig. 8. Strategy for ultra-sensitive detection by microfluidic immunoarray
Jia 等[45]利用氧化铟锡片作为工作电极、石墨烯复合材料作为支持基质构建的电化学免疫传感器可用于癌胚抗原和甲胎蛋白的同时测定。这种免疫传感器线性范围广,检测限低(癌胚抗原:0.650 pg/mL,甲胎蛋白:0.885 pg/mL),具有高通量平行分析的潜力。
Wu 等[46]利用复位氧化石墨烯-四乙烯五胺作为电极材料,氧化还原探针作为标记物,建立了一种电化学免疫传感器。这种电化学免疫传感器可以同时检测宫颈癌的两种标志物:癌胚抗原和鳞状细胞癌抗原,具有良好的稳定性和重现性,对癌胚抗原与鳞状细胞癌抗原的检测限分别为0.013 ng/mL 和 0.010 ng/mL。
2.3.3 药物分析
随着新型药物的陆续研发,对药物质量的检查与控制也越来越重要。近年来,电化学生物传感器在药物分析中的应用受到越来越多的关注。
樊春海课题组利用四面体 DNA 纳米结构修饰电极表面,构建了一种新型的电化学适体传感器(如图 9)。这种电化学传感器可用于可卡因的检测,具有良好的选择性,检测底限可达33 nM[47]。

图9 基于四面体修饰电极的电化学适体传感器检测可卡因原理示意图Figu. 9. Scheme of electrochemical aptasensor based on tetrahedral-decorated electrode for cocaine detection
另外,多壁碳纳米管与石墨丝网印刷电极结合形成的电化学传感器能够连续 16 小时监测萘普生的实时传送[48]。谷胱甘肽硫转移酶对抗癌药物具有耐药性,将其修饰到碳糊电极上制备出的电化学生物传感器可用于抗癌药物的检测[49]。
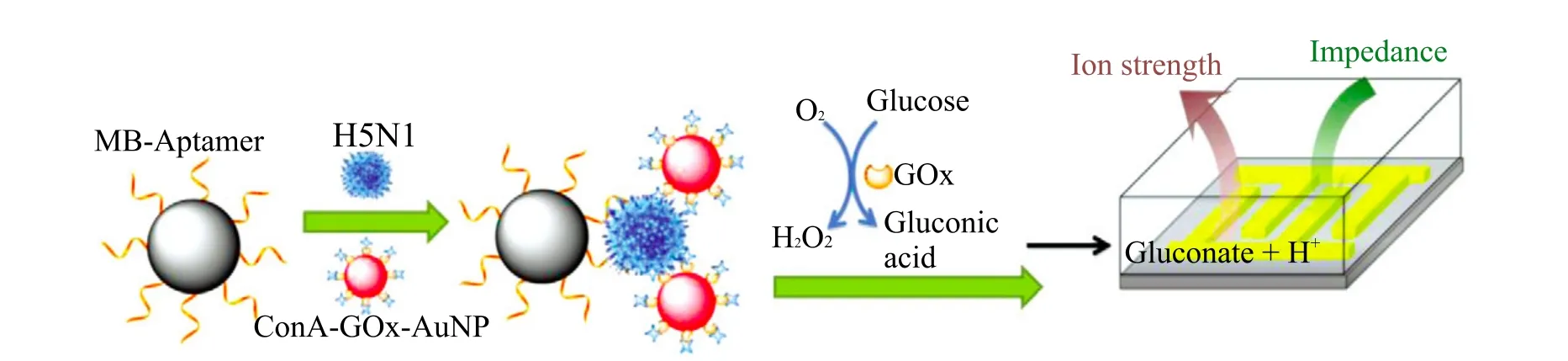
图10 可用于 H5N1 病毒检测电化学生物传感器原理示意图Fig. 10. Illustration of the electrochemical biosensor for virus detection
2.3.4 细菌及病毒感染类疾病诊断
细菌及病毒感染是引起人类疾病的主要原因之一。Fu 等[50]利用酶催化反应在超低离子强度介质中可引起离子强度增加的特性,开发出一种新型的检测禽流感病毒 H5N1 的电化学生物传感器(图 10)。这种电化学生物传感器在 200 μL 的样品中检测限可达到 8×10-4HAU,并且具有制作简便的优点。
Pandey 等[51]利用 1-氯-2-硝基-4-叠氮苯修饰的十八硫醇自组装单层膜制备的电化学生物传感器,够快速灵敏检测大肠杆菌,反应时间仅需60 s。另外,金纳米粒子修饰的氧化铟锡镀膜玻璃电极可用于固定抗体片段,基于此组装的电化学生物传感器可用于无标记检测人类免疫缺陷病毒 HIV-1[52]。
3 结语与展望
电化学生物传感器开辟了电化学与分子生物学研究的新领域,为生命科学的研究提供了一种全新方法,在生物医学、环境监测、食品和药物分析等领域得到广泛应用。近年来随着各种新材料与新技术的引进,电化学生物传感技术也得到飞速发展。然而,当前电化学生物传感器的研究绝大多数还处于基础研究阶段,生物识别元件的寿命、稳定性及非特异性结合依旧是其一个大缺陷。此外,在微型化和纳米界面的高通量生物传感应用方面仍然缺乏研究,不能完全实现复杂的生物样品的实时、快速、超灵敏检测。因此开发低成本与集成化的高通量电化学生物传感器是当前及今后的重点研究方向。纳米材料的合成、加工和集成的进步以及其他技术的引进将会推动电化学生物传感器的进一步改善和改进。随着电化学生物传感器多元化的发展与新技术的不断成熟,电化学生物传感器在生物医学领域将具有更广阔的应用前景。
[1]Chen A, Chatterjee S. Nanomaterials based electrochemical sensors for biomedical applications[J]. Chemical Society Reviews, 2013, 42: 5425-5438.
[2]Kang XH, Wang J, Wu H, et al. A graphene-based electrochemical sensor for sensitive detection of paracetamol [J]. Talanta, 2010, 81(3): 754-759.
[3]McWilliams MA, Anka FH, Balkus KJ, et al.Sensitive and selective real-time electrochemical monitoring of DNA repair [J]. Biosensors and Bioelectronics, 2014, 54: 541-546.
[4]Fu Y, Liu K, Sun QQ, et al. A highly sensitive immunosensor for calmodulin assay based on enhanced biocatalyzed precipitation adopting a dual-layered enzyme strategy [J]. Biosensors and Bioelectronics, 2014, 56: 258-263.
[5]Yogeswaran U, Chen SM. A Review on the electrochemical sensors and biosensors composed of nanowires as sensing material [J]. Sensors, 2008,8(1): 290-313.
[6]Wang J. Electrochemical biosensors: towards pointof-care cancer diagnostics [J]. Biosensors and Bioelectronics, 2006, 21(10): 1887-1892.
[7]Monošík R, Stred’anský M, Šturdík E. Application of electrochemical biosensors in clinical diagnosis[J]. Journal Clinical Laboratory Analysis, 2012,26(1): 22-34.
[8]Yang GM, Zhao FQ, Zeng BZ. Electrochemical determination of cefotaxime based on a threedimensional molecularly imprinted fi lm sensor [J].Biosensors and Bioelectronics, 2014, 53: 447-452.
[9]da Silva H, Pacheco JG, Magalhães JM, et al. MIP-graphene-modif i ed glassy carbon electrode for the determination of trimethoprim [J]. Biosensors and Bioelectronics, 2014, 52: 56-61.
[10]Gan T, Sun JY, Meng W, et al. Electrochemical sensor based on graphene and mesoporous TiO2for the simultaneous determination of trace colourants in food [J]. Food Chemistry, 2013, 141: 3731-3737.
[11]Rassaei L, Marken F, Sillanpää M, et al.Nanoparticles in electrochemical sensors for environmental monitoring [J]. Trends in Analytical Chemistry, 2011, 30(11): 1704-1715.
[12]Mead MI, Popoola OAM, Stewart GB, et al. The use of electrochemical sensors for monitoring urban air quality in low-cost, high-density networks [J].Atmospheric Environment, 2013, 70: 186-203.
[13]Ronkainen NJ, Halsall HB, Heineman WR.Electrochemical biosensors [J]. Chemical Society Reviews, 2010, 39: 1747-1763.
[14]Luo XL, Davis JJ. Electrical biosensors and the label free detection of protein disease biomarkers[J]. Chemical Society Reviews, 2013, 42: 5944-5962.
[15]Mehrvar M, Abdi M. Recent developments,characteristics, and potential applications of electrochemical biosensors [J]. Analytical Science,2004, 20: 1113-1126.
[16]Prodromidis MI, Karayannis MI. Enzyme based amperometric biosensors for food analysis [J].Electroanalysis, 2002, 14: 241-261.
[17]Song SP, Wang LH, Li J, et al. Aptamer-based biosensors [J]. Trends in Analytical Chemistry,2008, 27(2): 108-117.
[18]Conroy PJ, Hearty S, Leonard P, et al. Antibody production, design and use for biosensor-based applications [J]. Seminars in Cell & Developmental Biology, 2009, 20(1): 10-26.
[19]Su L, Jia WZ, Hou CJ, et al. Microbial biosensors:a review [J]. Biosensors and Bioelectronics, 2011,26(5): 1788-1799.
[20]Clark LC, Lyons C. Electrode systems for continuous monitoring in cardiovascular surgery[J]. Annals of the New York Academy of Sciences,1962, 102: 29-45.
[21]Amine A, Mohammadi H, Bourais I, et al. Enzyme inhibition-based biosensors for food safety and environmental monitoring [J]. Biosensors and Bioelectronics, 2006, 21(8): 1405-1423.
[22]Nomngongo PN, Catherine Ngila J, Msagati TAM,et al. Determination of selected persistent organic pollutants in wastewater from landfill leachates,using an amperometric biosensor [J]. Physics and Chemistry of the Earth, 2012, 50-52: 252-261.
[23]Soldatkin OO, Kucherenko IS, Pyeshkova VM, et al. Novel conductometric biosensor based on threeenzyme system for selective determination of heavy metal ions [J]. Bioelectrochemistry, 2012, 83: 25-30.
[24]Zapp E, Brondani D, Vieira IC, et al. Biomonitoring of methomyl pesticide by laccase inhibition on sensor containing platinum nanoparticles in ionic liquid phase supported in montmorillonite [J].Sensors and Actuators B: Chemical, 2011, 155(1):331-339.
[25]Kim JH, Cho S, Bae TS, et al. Enzyme biosensor based on an N-doped activated carbon fiber electrode prepared by a thermal solid-state reaction[J]. Sensors and Actuators B: Chemical, 2014, 197:20-27.
[26]Alwarappan S, Liu C, Kumar A, et al. Enzymedoped graphene nanosheets for enhanced glucose biosensing [J]. The Journal of Physical Chemistry C,2010, 114(30): 12920-12924.
[27]Zhang XH, Liao QL, Chu MM, et al. Structure effect on graphene-modified enzyme electrode glucose sensors [J]. Biosensors and Bioelectronics,2014, 52: 281-287.
[28]Liu A, Wang K, Weng SH, et al. Development of electrochemical DNA biosensors [J]. Trends in Analytical Chemistry, 2012, 37: 101-111.
[29]Li D, Song SP, Fan CH. Target-responsive structural switching for nucleic acid-based sensors [J].Accounts of Chemical Research, 2010, 43(5): 631-641.
[30]Yang K, Zhang CY. Simple detection of nucleic acids with a single-walled carbon-nanotube-based electrochemical biosensor [J]. Biosensors and Bioelectronics, 2011, 28(1): 257-262.
[31]Wan Y, Wang PJ, Su Y, et al. Ultrasensitive electrochemical DNA sensor based on the target induced structural switching and surface-initiated enzymatic polymerization [J]. Biosensors and Bioelectronics, 2014, 55: 231-236.
[32]Yang K, Zhang CY. Improved sensitivity for the electrochemical biosensor with an adjunct probe [J].Analytical Chemistry, 2010, 82(22): 9500-9505.
[33]Cui HF, Cheng L, Zhang J, et al. An electrochemical DNA sensor for sequence-specif i c DNA recognization in a homogeneous solution [J].Biosensors and Bioelectronics, 2014, 56: 124-128.
[34]Perumal V, Hashim U. Advances in biosensors:principle, architecture and applications [J]. Journal of Applied Biomedicine, 2014, 12(1): 1-15.
[35]Ushaa SM, Madhavilatha M, Madhusudhan Rao G.Design and analysis of nanowire sensor array for prostate cancer detection [J]. International Journal of Nano and Biomaterials, 2011, 3: 239-255.
[36]Li YY, Xu CX, Li H, et al. Nonenzymatic immunosensor for detection of carbohydrate antigen 15-3 based on hierarchical nanoporous PtFe alloy[J]. Biosensors and Bioelectronics, 2014, 56: 295-299.
[37]Yang L, Zhao H, Fan SM, et al. Label-free electrochemical immunosensor based on gold–silicon carbide nanocomposites for sensitive detection of human chorionic gonadotrophin [J].Biosensors and Bioelectronics, 2014, 57: 199-206.
[38]Lu WB, Cao XW, Tao L, et al. A novel label-free amperometric immunosensor for carcinoembryonic antigen based on Ag nanoparticle decorated inf i nite coordination polymer fibres [J]. Biosensors and Bioelectronics, 2014, 57: 219-225.
[39]Cheng MS, Ho JS, Lau SH, et al. Impedimetric microbial sensor for real-time monitoring of phage infection of Escherichia coli [J]. Biosensors and Bioelectronics, 2013, 47: 340-344.
[40]Liu SF, Lin Y, Liu T, et al. Enzyme-free and labelfree ultrasensitive electrochemical detection of DNA and adenosine triphosphate by dendritic DNA concatamer-based signal amplification [J].Biosensors and Bioelectronics, 2014, 56: 12-18.
[41]Chen X, Hong CY, Lin YH, et al. Enzyme-free and label-free ultrasensitive electrochemical detection of human immunodef i ciency virus DNA in biological samples based on long-range self-assembled DNA nanostructures [J]. Analytical Chemistry, 2012,84(19): 8277-8283.
[42]Li FY, Peng J, Wang JJ, et al. Carbon nanotubebased label-free electrochemical biosensor for sensitive detection of miRNA-24 [J]. Biosensors and Bioelectronics, 2014, 54: 158-164.
[43]Grabowska I, Maleka K, Stachyra A, et al.Single electrode genosensor for simultaneous determination of sequences encoding hemagglutinin and neuraminidase of avian influenza virus type H5N1 [J]. Analytical Chemistry, 2013, 85(21):10167-10173.
[44]Malhotra R, Patel V, Chikkaveeraiah BV, et al.Ultrasensitive detection of cancer biomarkers in the clinic by use of a nanostructured microf l uidic array[J]. Analytical Chemistry, 2012, 84(14): 6249-6255.
[45]Jia XL, Liu ZM, Liu N, et al. A label-free immunosensor based on graphene nanocomposites for simultaneous multiplexed electrochemical determination of tumor markers [J]. Biosensors and Bioelectronics, 2014, 53: 160-166.
[46]Wu D, Guo AP, Guo ZK, et al. Simultaneous electrochemical detection of cervical cancer markers using reduced graphene oxidetetraethylene pentamine as electrode materials and distinguishable redox probes as labels [J].Biosensors and Bioelectronics, 2014, 54: 634-639.
[47]Wen YL, Pei H, Wan Y, et al. DNA nanostructuredecorated surfaces for enhanced aptamer-target binding and electrochemical cocaine sensors [J].Analytical Chemistry, 2011, 83(19): 7418-7423.
[48]Baj-Rossi C, Rezzonico Jost T, Cavallini A, et al. Continuous monitoring of Naproxen by a cytochrome P450-based electrochemical sensor [J].Biosensors and Bioelectronics, 2014, 53: 283-287.
[49]Materon EM, Huang JPJ, Wong A, et al.Glutathione-s-transferase modified electrodes for detecting anticancer drugs [J]. Biosensors and Bioelectronics, 2014, 58: 232-236.
[50]Fu YC, Callaway Z, Lum J, et al. Exploiting enzyme catalysis in ultra-low ion strength media for impedance biosensing of avian influenza virus using a bare interdigitated electrode [J]. Analytial Chemistry, 2014, 86(4): 1965-1971.
[51]Pandey CM, Singh R, Sumana G, et al.Electrochemical genosensor based on modified octadecanethiol self-assembled monolayer for Escherichia coli detection [J]. Sensors and Actuators B: Chemical, 2011, 151(2): 333-340.
[52]Lee JH, Oh BK, Choi JW. Electrochemical sensor based on direct electron transfer of HIV-1 Virus at Au nanoparticle modified ITO electrode [J].Biosensors and Bioelectronics, 2013, 49: 531-535.

