microRNA过表达载体构建技术的实验研究
姜 彬
(北京大学 医学部生化系,北京 100191)
1 microRNA概述
1993年,Lee等[1]在线虫中发现了小分子单链非编码RNA,其长度只有22nt,当时命名为1in-4。这种RNA能够通过碱基配对结合到靶mRNAlin-14的3’末端非翻译区(3’untransIational region,3’UTR),抑制1in-14的翻译,导致1in-4或lin-14的突变,从而造成线虫发育差时表型(heterocllronlc phenotype)。2000年Reinhart等[2]又发现了另一个类似的具有转录后调节功能的小分子RNA:let-7。两者都被发现具有卓越的时序调节功能,因此被命名为小时序RNA(stRNA)。之后stRNA被归入了 microRNA家族中。2001年不同国家的研究小组分别在线虫、果蝇和人体中发现了这类长度为21~22nt的非编码小分子RNA[3],将其命名为 microRNA(简写为 miRNA)。在以后几年的时间里,许多实验室相继发现了更多的miRNA,其家族成员的数量不断扩大[4]。miRNA在自然界广泛存在于人体、线虫、果蝇、家鼠、拟南芥等多种动植物中,它没有编码功能,但在肿瘤的发生,细胞凋亡与衰老过程中起着关键的作用,其功能还涉及到生物体的正常发育、免疫调控、组织修复、干细胞的自我更新等生理过程。miRNA由于其分子小却具有非常卓越的基因转录表达和细胞周期的调控作用而成为各国分子生物学家研究的热点。
本实验所涉及到的microRNA-21(简写为miR-21)已被发现在多种血液系统和实体器官的恶性肿瘤中发挥重要作用,也是目前发现的唯一一个在实体肿瘤中过表达的miRNA。Ciafre等[5]利用microarray的方法检测了恶性胶质瘤组织中245种microRNAs的整体表达水平,其中miR-21的表达水平明显上调。Chan等[6]通过对原代培养建立的6种多形性恶性胶质瘤细(A172、U87、U373、LN229、LN428、LN308)、正常胎儿和成人脑组织以及体外培养的正常的神经胶质细胞进行比较分析,也发现在恶性胶质瘤中miR-21的表达水平大幅度升高。进一步研究表明,在培养的恶性胶质瘤细胞中下调 miR-21的表达,可以触发caspases的激活,从而导致肿瘤细胞的凋亡。这些研究表明,miR-21的异常可能是通过抑制关键性的凋亡相关基因的表达而促进恶性肿瘤的形成。此外,Iorio等[7]比较了乳腺癌及正常乳腺组织miR-21的表达,通过microarray和Northern印迹法验证了miR-21在乳腺癌组织中表达上调,表明miR-21可能在乳腺癌恶性肿瘤形成中也扮演着癌基因的角色。近年来,大量的文献报道证实了miR-21是一种致癌基因,但它的作用机制仍然不是十分清楚。到目前为止,获得详细描述的miR-21的靶信号通路主要有程序性细胞死亡因子4(PDCD4)[8]、原肌球蛋白1(TPMI)[9]、磷酸酯酶-张力蛋白同源物(PTEN)这3种,这几条靶信号通路仅仅限于部分肿瘤组织中,并不能推广到所有肿瘤组织。miR-21还可以通过作用于一个复杂的肿瘤抑制信号通路来发挥其致癌作用,包括如p53信号通路[10]等。我们看到,在绝大多数的肿瘤细胞中都存在有miR-21的上调,因此miR-21与抑癌基因的关系及其作用机制越来越受到关注。本实验所要构建的miR-21载体正是为了进一步研究miR-21的功能之用的,也是研究的第一步工作。
对于miRNA表达载体构建方法的选择,目前有两种策略:一种策略基于miRNA/siRNA表达载体,利用统一表达框的miRNA过表达技术;另一种策略是从人类基因组DNA中用PCR方法扩增出miRNA的前体序列,酶切后定向插入真核表达载体,构建miRNA真核表达载体pcDNA3.1(+)-microRNA。转染细胞后在载体启动子作用下转录为具有“茎环”结构的pre-microRNAs,通过胞内自身的RNA聚合酶ⅢDicer的作用剪接加工成为成熟的microRNAs,从而发挥对靶基因的调控作用。考虑到由于细胞分化是一个过程,研究微小RNA在其中的调控的作用需要有一定的观察时间,而pcDNA3.1(+)真核表达载体含有CMV启动子,AMP、neo抗性基因以及BGH polyA加尾信号和SV40早期启动子(见图1),可以在大多数哺乳动物细胞中得到稳定表达。因此在构建miR-21表达基因时我们试采用了pcDNA3.1(+)真核表达载体。
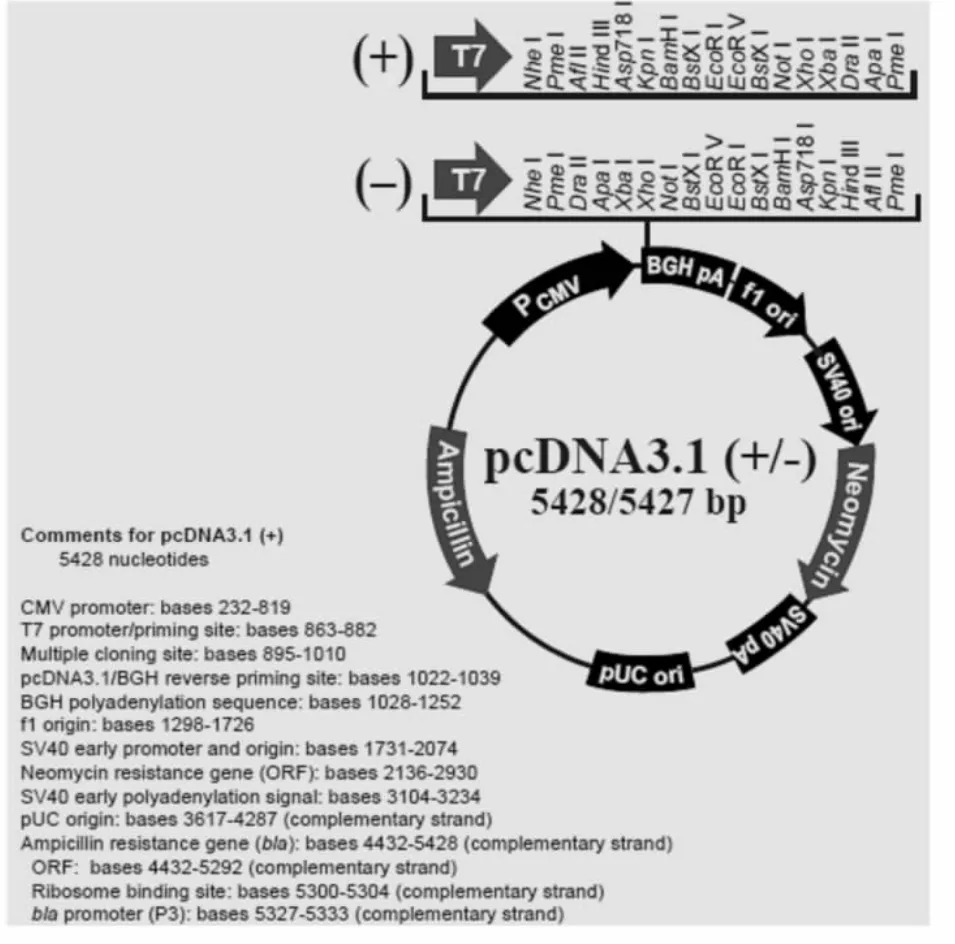
图1 pcDNA3.1(+)真核表达载体图谱
2 试剂
2BS细胞(人肺成纤维细胞)由我校衰老研究中心存种,于实验前复苏培养;过表达质粒载体选用pcDNA3.1(+)真核表达载体,Lipofectamine 2000 Reagent购自lnvitrogen公司;PCR引物由奥科生物公司合成;PCR反应体系购自康润生物公司;限制性内切酶BamHⅠ和EcoRⅠ订购于NEB公司;琼脂糖凝胶回收试剂盒购自BioTeke公司;感受态细胞Dh5α购自博迈德科技公司;基因测序由华大基因公司完成。
3 实验方法
(1)首先,查找pubmad的人类基因组数据库,显示miR-21基因位于17q23.1,即位于该染色体的16571687-16571758bp,基因序列如下:
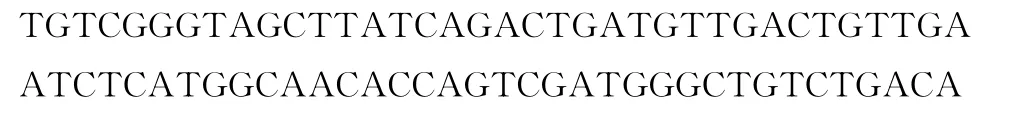
按照构建miRNA的要求,在基因miR-21所在位置上下游各延长约200bp,即基因组中定位于17号染色体16571500—16571999bp的片段,得到如下序列:
序列中黑体加粗序列为与上下游引物匹配的序列部分;下划线序列为pre-miR-21(miR-21前体)对应基因组序列部分;双下划线序列为成熟miR-21所对应的基因组序列部分。

(2)PCR扩增目的基因。使用DNA抽提试剂盒提取2BS细胞(人肺成纤维细胞)基因组DNA,利用PCR技术将上述片段从基因组DNA上扩增下来,所用PCR引物为(5’段分别带有限制性内切酶BamHⅠ和EcoRⅠ的识别序列):

反应条件为:94 ℃、3min,94 ℃、30s,60 ℃、30s,72℃、45s,30个循环。
(3)电泳。将得到的PCR产物进行1%琼脂糖凝胶电泳,进行PCR产物分析。
(4)回收目的基因。电泳后,使用胶回收试剂盒回收目的基因片段。
(5)酶切反应。分别用限制性内切酶BamHⅠ和EcoRⅠ对回收的目的片段和pcDNA3.1(+)质粒空载体进行酶切。目的片段40μL酶切体系:回收的DNA片段30μL;10×缓冲液4μL;100×BSA 0.4 μL;限制性内切酶 2μL;去离子水3.6μL。pcDNA3.1(+)质粒空载体20μL酶切体系:质粒载体5 μL;10×缓冲液4μL;100×BSA0.2μL;限制性内切酶1μL;去离子水9.8μL。酶切反应过夜。纯化回收酶切过后的目的片段和质粒空载。
(6)连接反应。将上述的500bp的目的片段插入到质粒pcDNA3.1(+)的限制性内切酶的BamHⅠ和EcoRⅠ位点上。即将已酶切的目的基因片段与质粒空载进行连接。10μL的连接反应体系:纯化回收的已酶切质粒2μL;纯化回收的已酶切的目的基因片段6μL;T4DNA连接酶1μL;10×T4DNA连接酶缓冲液1μL,连接反应过夜。
(7)转化。将得到的连接产物转化到感受态细胞Dh5α中,操作均按无菌条件的标准进行。
(8)筛选。在超净工作台中从各转化平板上用已灭菌牙签挑取饱满匀称的菌落,将其置于事先已加入适量LA液体培养基的摇菌管中,将摇菌管置于摇床上,37℃摇菌过夜。
(9)从转化细菌中提取重组质粒。采用GenStar公司的StarPrep快速质粒小提试剂盒进行小提,采用MN公司的Plasmid DNA Purification(NucleoBond Xtra Midi/Maxi)试剂盒进行酶切鉴定后的大提。其原理均是基于碱裂解提取质粒的方法,并结合硅胶膜吸附技术,使质粒DNA获得高效、专一的吸附,进而洗脱获取重组体。
(10)酶切鉴定。采用限制性内切酶BamHⅠ和EcoRⅠ进行双酶切,酶切反应体系为20μL双酶切反应体系:提取的重组质粒5μL;10×缓冲液2μL;限制性内切酶BamHⅠ1μL;限制性内切酶EcoRⅠ1μL;去离子水11μL。酶切反应30min后,将酶切产物进行琼脂糖凝胶电泳分析。
(11)测序。将重组质粒送华大基因公司测序,经DNA测序证实,目的基因片段已成功构建到pcDNA3.1(+)真核表达载体中。
(12)RT-PCR。将重组质粒和空载体转染入Hela细胞进行培养,而后提取RNA,进行RT-PCR(反转录聚合酶链式反应)实验。由于miRNA过于短小,因而采用了特殊的逆转录引物序列,以下黑体加粗的序列为与miR-21互补的序列:
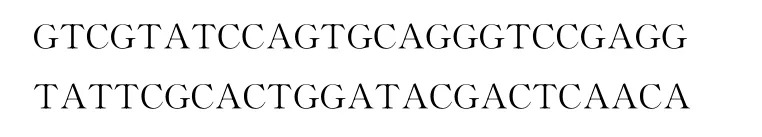
PCR体系一般为20μL,包含合成的cDNA模板2 μL,特异性引物1μL,10mM dNTP 1μL,1uTaqDNA聚合酶1μL,25mMMgc 12μL。共进行25个循环,每个循环包含95℃变性20s,56~60℃退火1min,72℃延伸30s。对于miR-21模板使用miR-21的RT产物,内参GAPDH的模板使用cDNA。PCR产物经1%琼脂糖凝胶电泳分离,用凝胶成像系统进行分析。
4 结论
4.1 miR-21PCR扩增结果
miR-21PCR扩增产物电泳结果显示见图2。图2中左侧为不同温度下,以2BS细胞基因组DNA为模板进行PCR得到的产物条带,扩增产物均在大约500 bp处泳出条带,与用于构建过表达载体的miR-21基因片段大小的理论值相符。图中右侧为DNA mark。
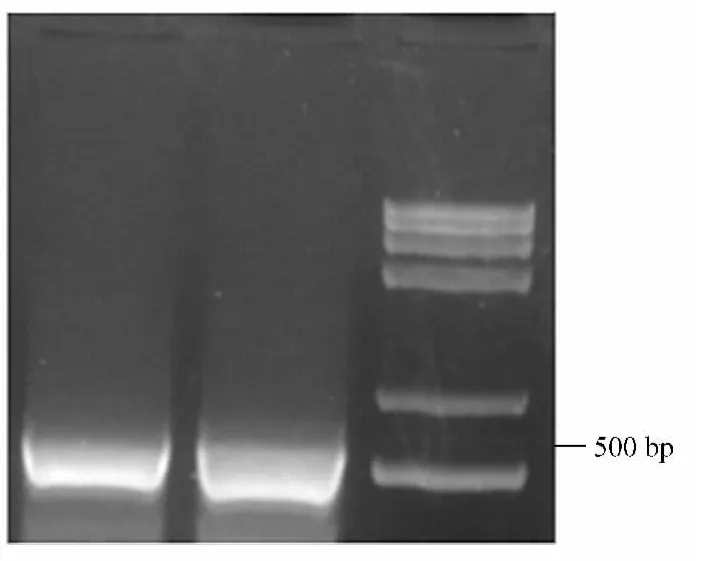
图2 miR-21PCR扩增结果
4.2 重组质粒酶切鉴定结果
对从随机选择的2个菌落中所提重组质粒进行双酶切,然后进行琼脂糖凝胶电泳,结果见图3。图3左侧为挑出的2个单克隆菌落进行摇菌,小提质粒,BamHⅠ和EcoRⅠ(NEB)双酶切,将酶切产物进行琼脂糖凝胶电泳得到的条带。可见两者均泳出2个条带,一条在约5 kbp处,另一条在约500bp处,分别与pcDNA3.1(+)真核表达载体和所需miR-21片段大小相一致。

图3 重组质粒酶切鉴定结果
4.3 miR-21过表达载体转染肿瘤细胞后miR-21的表达情况
利用构建好的miR-21真核表达载体和空载体转染Hela细胞,培养后提取RNA进行RT-PCR实验。结果显示,转染了miR-21真核表达载体的细胞与转染空载体的细胞相比,其miR-21的表达量显著提高(见图4)。证实miR-21过表达载体的构建是准确有效的,构建工作是成功的,为下一步研究miR-21的作用机制及其功能奠定了基础。
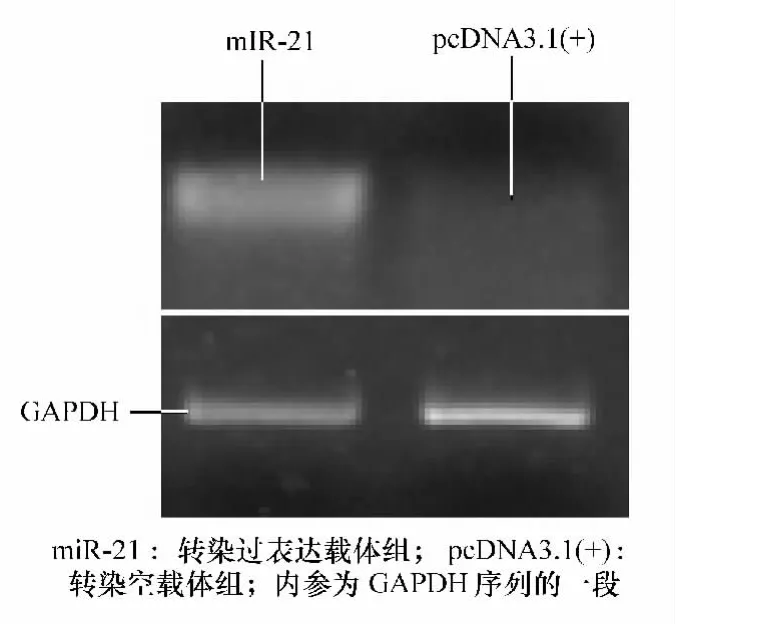
图4 microRNA-21RT-PCR表达水平
5 结论
本实验成功构建了miR-21过表达载体,实验证实,这种利用真核载体构建microRNA过表达载体的方法符合microRNAs的一般生物合成过程和作用原理,经济、简便、高效和准确,效果稳定,重复性好,符合实验需要。构建好的过表达载体可转染细胞(肿瘤细胞或衰老细胞),可通过实时PCR方法[11]检测其转录情况,可通过Western blot[12]检测细胞中蛋白质表达的变化,进一步研究miR-21的作用机理。
(
)
[1]lee R C.Fembaunl R L.Ambros V.Heterochronic gene lin-4encodes small RNAs with antlsense complementarity to lin—14[J].cell,1993,75(5):843-854.
[2]Reinhart B J,Slack F J Basson.The 21nuclcotide let-7RNA regulates developmental timing Caenorhabditis elegans [J].Nature,2000,403(6772):901-906.
[3]Lagos-Quintana M,Rauhut R,Lendeckel W,et al.Identificatlon of novel genes coding for small expressed RNAs[J].science,2001,294(5543):853-858.
[4]Mourelatos Z,Dostie J,Paushkin S,et al,miRNPs.a novel class of rlbonucleoproteins containing numerous microRNAs[J].Genes&DeveIopment,2002,16(6):720-728.
[5]Ciafre S A,Galardi S,Mangiola A,et al.Extensive modulation of a set of microRNAs in primary glioblastoma[J].Biochem BiophysRes Commun,2005,334(4):1351-1358.
[6]Chan J A,Krichevsky A M,Kosik K S.MicroRNA-21is an antiapoptotic factor in human glioblastoma cells[J].Cancer Res,2005,65(14):6029-6033.
[7]Iorio M V ,Fen’acin M ,Liu C G,et al.MicroRNA gene expression deregulation in human breast cancer[J].Cancer Res,2005,65(16):7065-7070.
[8]Lisa B Frankel,Nanna R Christoffersen,Anders Jacobsen,et al.Programmed Cell Death 4 (PDCD4)Is an Important Functional Target of the MicroRNA miR-21in Breast Cancer Cells[J].The Journal of Biological Chemistry,2008,283(2):1026-1033.
[9]Zhu Shuomin,Si Minliang,Wu Hailong,et al.MicroRNA-21Targets the Tumor Suppressor Gene Tropomyosin 1(TPM1)[J].The Journal of Biological Chemistry,2007,282(19):14328-14336.
[10]Hales Papagiannakopoulos,Alice Shapiro,Kenneth S Kosik.MicroRNA-21Targets a Network of Key Tumor-Suppressive Pathways in Glioblastoma Cells[J].Cancer Res,2008,68(19):8164-8172.
[11]李金明.实时荧光PCR技术[M].北京:人民军医出版社,2007.
[12]汪家政.蛋白质技术手册[M].北京:科学出版社,2002.

