铜蓝蛋白生理作用的研究进展
李天颖,李前勇,张德志,谢京君,王庆华
(西南大学荣昌校区动物医学系,重庆 荣昌 402460)
铜蓝蛋白(Ceruloplasmin)是人和动物血液中存在的一种含铜的具有氧化酶活性的α2糖蛋白,它是由Holmberg在1948年首次发现并命名的一种金属蛋白,能结合95%以上的血清铜,外观呈现蓝色。自该蛋白发现以来的近70年时间,国外学者对其功能和作用展开了大量研究和探索,并取得了许多重要成果。近年来,随着人们对Wilson′s病、帕金森氏症及阿尔茨梅病等人类重要疾病的深入研究,铜蓝蛋白的功能和作用也越来越多地引起了国内外学者的重视和关注,为了能更好地了解铜蓝蛋白质生理作用的研究进展,本文综述了铜蓝蛋白质的氧化酶作用、抗氧化作用及在机体铁、铜稳态维持中发挥的生理作用。
1 氧化酶作用
铜蓝蛋白属于多铜氧化酶家族成员,也是该家族成员中能结合分子氧并将其还原成水的少数重要酶类之一。铜蓝蛋白独有的结构特征,使其能借底物的一电子氧化催化分子氧的四个电子还原成两个水分子,其反应过程见图1。在反应过程中,铜蓝蛋白的铜原子发生一个功能单位的氧化还原中心线性排列,该功能单位内的T1位点可从底物摄取单个电子并转运到三环族上,并用获取的电子还原分子氧成水。铜蓝蛋白分子内电子从T1位点转移到氧键位点的过程中,可消耗、氧化各种底物而不释放各种氧自由基(ROS)。
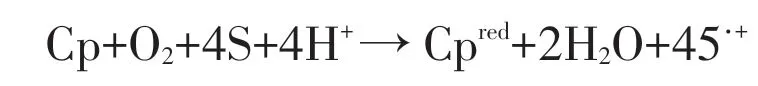
图1 铜蓝蛋白催化氧还原成水的反应过程,“S”为底物
研究证实,血浆铜蓝蛋白可催化铁离子和铜离子等无机生理底物,它可氧化Fe2+为Fe3+、Cu1+为Cu2+,以利于两种金属离子在机体内的转运和代谢。它还对机体其他有机组分所构成的底物发生催化氧化作用,但形成的产物因生物种类的不同而有差异,具有一步电子氧化作用的生物,最终形成的产物是水;而对于哺乳动物,形成的产物则为过氧化氢。这是一个胺氧化反应过程,机体pH值及氯离子对其有明显影响,报道证实,当反应体系的pH值达到5.2时,铜蓝蛋白的胺氧化酶活性才会达到最佳,正常生理浓度的氯离子对铜蓝蛋白胺氧化酶作用有很强的促进作用[5]。此外,铜蓝蛋白在机体内还发挥邻苯二酚氧化酶作用,它能催化酚氧化成相应的邻苯二胺,在动物机体中能与该蛋白发生邻苯二酚反应的底物有对邻苯二酚、邻苯二酚取代物(如DOPA、神经毒素6-羟基多巴胺)及多种神经体液因子(如多巴胺、去甲肾上腺素、肾上腺素、5-羟色胺及色氨酸)。
2 抗氧化作用
动物机体中,许多结合有铜的蛋白质,如铜蓝蛋白(CP)、超氧化物歧化酶(SOD)和金属硫蛋白,均具有明显的抗氧化功能。血浆铜蓝蛋白的抗氧化作用机制有亚铁氧化酶活性、亚铜氧化酶活性、谷胱甘肽过氧化物酶的活性以及其清除活性氧的能力等。Goldsteim等研究发现,血清中正常浓度的铜蓝蛋白能抑制黄嘌呤氧化酶调节的正铁细胞色素C的还原作用,发挥类似于超氧化物歧化酶对O2-的清除功能。与超氧化物歧化酶的清除自由基作用比较,铜蓝蛋白的这种作用显得较弱,但却比较恒定,即使在该蛋白发生变性的情况下仍然保持着除清自由基的作用,据报道这种现象可能是铜蓝蛋白与O2-之间发生了直接化学反应的结果。研究还证实,无论是具有活性的铜蓝蛋白还是变性的铜蓝蛋白均能与血液及组织液中Cu2+结合,从而显著抑制由Cu2+诱发的脂质过氧化作用,有人还提出,铜蓝蛋白的抗氧化作用是血浆抗氧化能力的主要贡献者。但也有研究表明,铜蓝蛋白对过氧自由基和过氧化氢有敏感的氧化修饰作用[11-12],甚至在铜蓝蛋白分子出现单一的表面结合铜离子时,还表现出直接促氧化作用。
众所周知,NO是L-精氨酸(L-Arg)在一氧化氮合成酶(NOS)催化下生成的,而NOS有两种类型,即结构型NOS合成酶(cNOS)和诱导型NOS合成酶(iNOS),其中诱导型NOS合成酶主要催化合成一氧化氮。生理浓度的NO能和羟自由基(·OH)反应,生成HONO而减轻羟自由基对组织的损伤。有资料证实,铜蓝蛋白有促使形成S-亚硝基谷胱甘肽的作用,当将它加到培养的单核细胞中时,可诱导表达诱导型NO合成酶。Mukhopadhyay等在对高胆固醇血症病人的研究中发现,铜蓝蛋白确实有催化合成一氧化氮的作用。由此可见铜蓝蛋白在机体内还可通过促使S-亚硝基化谷胱甘肽的形成,诱导一氧化氮合成酶的表达,促进机体一氧化氮的合成,通过一氧化氮除清自由基的途径而间接发挥抗氧化的作用。
3 维持铁、铜的稳态
铜是人和动物机体必需的微量元素,缺乏或摄入过多均会对健康造成不可忽视的影响,甚至引起死亡现象的发生。然而,游离的铜常对机体造成损害,研究证明,细胞内游离的铜可导致羟自由基的形成,或经多巴胺介导铜的氧化损伤发生,此外,铜在β-淀粉样蛋白的表达和朊蛋白聚集体的装配中还起重要作用。因此,保持机体中游离铜的稳态是确保铜生理功能的发挥和正常代谢进行的重要环节。Holmberg早在1944年就证实,铜蓝蛋白结合了动物血清中95%以上的游离铜,自由铜通常维持在极低浓度的结合蛋白、分子伴侣蛋白的分子内或亚细胞内,Jeong等报道,铜蓝蛋白可为机体各种细胞提供最优先的铜源,是机体铜的转运蛋白。由此可知,铜蓝蛋白在机体铜动态平衡中起着至关重要的作用。
铜蓝蛋白还在机体铁稳态的控制中发挥着不可忽视的作用。对人类的一些遗传性疾病研究中发现,病人铜蓝蛋白基因(aceruloplasminemia)发生突变,则会在视网膜、肝脏、大脑等器官中发生铁的沉积;运用基因敲除法得到的铜蓝蛋白基因缺失小鼠,其血浆中铜蓝蛋白缺乏,血清中亚铁氧化酶活性丧失,全身各组织出现明显的铁沉积现象,且在小鼠生命的晚期还表现出轻度的神经退行性变化。有研究还指出,铜蓝蛋白在神经胶质细胞中以GPI联合的形式表达,可促进铁从中枢神经系统细胞中流出,而且还可促进肝细胞、小肠上皮细胞中铁的释放。但铜蓝蛋白对铁的作用并不仅限定于促进细胞内铁的流出或释放,Dexter报道,帕金森氏症病人在大脑特定的区域内铜蓝蛋白浓度有较大幅度的增加,同时铁的含量也增加,这说明该蛋白质在一定条件下还有促进细胞摄取铁的作用。
4 小结
铜蓝蛋白是人和动物机体广泛存在的一种含铜的金属蛋白,其具有的胺氧化酶活性及邻苯二酚氧化酶作用使其参与了体内铁、铜及多种神经体液因子的代谢;通过发挥亚铁氧化酶、亚铜氧化酶、谷胱甘肽过氧化物酶的活性,具有清除机体活性氧的能力;经促使S-亚硝基化谷胱甘肽的形成,沿一氧化氮除清自由基的途径间接发挥抗氧化的作用;它是机体中最重要的铜转运蛋白,在机体铜动态平衡中起着至关重要的作用;在机体组织中以GPI锚定形式表达,进而促进细胞内铁的流出和释放,但在一定条件下能促进细胞铁的摄取,因而表现出对机体铁稳定的调控作用。然而,铜蓝蛋白在铁代谢调控中的作用机制还不太清楚,同时,该蛋白的胺氧化酶活性发生胺氧化反应的生理基础到目前为止还尚未发现,其邻苯二酚和酚氧化酶活性的生理作用能被氯离子激活,但其激活机制尚需要进一步研究。

