基于生理药动学模型预测玉米赤霉烯酮在猪组织中的浓度
杨 帆,杨 芳,王国永,赵振升,孔 涛
(河南科技大学动物科技学院,河南 洛阳 471003)
玉米赤霉烯酮(zearalenone,ZEA)是一种由镰孢菌属真菌产生的毒素,具有雌激素样效应[1],猪对该效应最为敏感。除雌激素效应外,ZEA的毒性还归因于其合成代谢活性[2]:ZEA能够引发动物真菌毒素中毒,影响内脏器官发育[3-4],导致动物消化功能紊乱[5]。动物采食被ZEA污染的谷物或饲料后,ZEA会残留在动物组织中,严重威胁食品安全。因此预测ZEA在动物体内的残留浓度,意义重大。生理药动学(Physiologically Based Pharmacokinetics,PBPK)模型是一种模拟机体循环系统的血液流向,将各器官或组织连接起来而建立的整体模型[6],可用于预测兽药或外源物质在动物各组织中的浓度。本研究建立了ZEA在猪体内的PBPK模型,预测了经口暴露后ZEA在猪各组织中的浓度,为保证动物性食品安全提供参考。
1 材料与方法
1.1 材料 模型中涉及到的猪的生理学和解剖学参数(Q和V)均来自于文献[7],本试验中猪的体重(bodyweight,bw)为70 kg,猪的心脏全血输出量(CO)为12 L/kg·h,以下式换算成血浆输出量(Qtot):Qtot=CO×bw0.74×(1-pcv),其中pcv为红细胞压积,数值为0.33。ZEA在猪各组织中的组织-血浆分配系数(P)外推自Shin等[8]的报道。本试验利用acslXtreme软件(AEgis Technologies公司;Version 3.0),以代码形式建立此PBPK模型。
1.2 方法
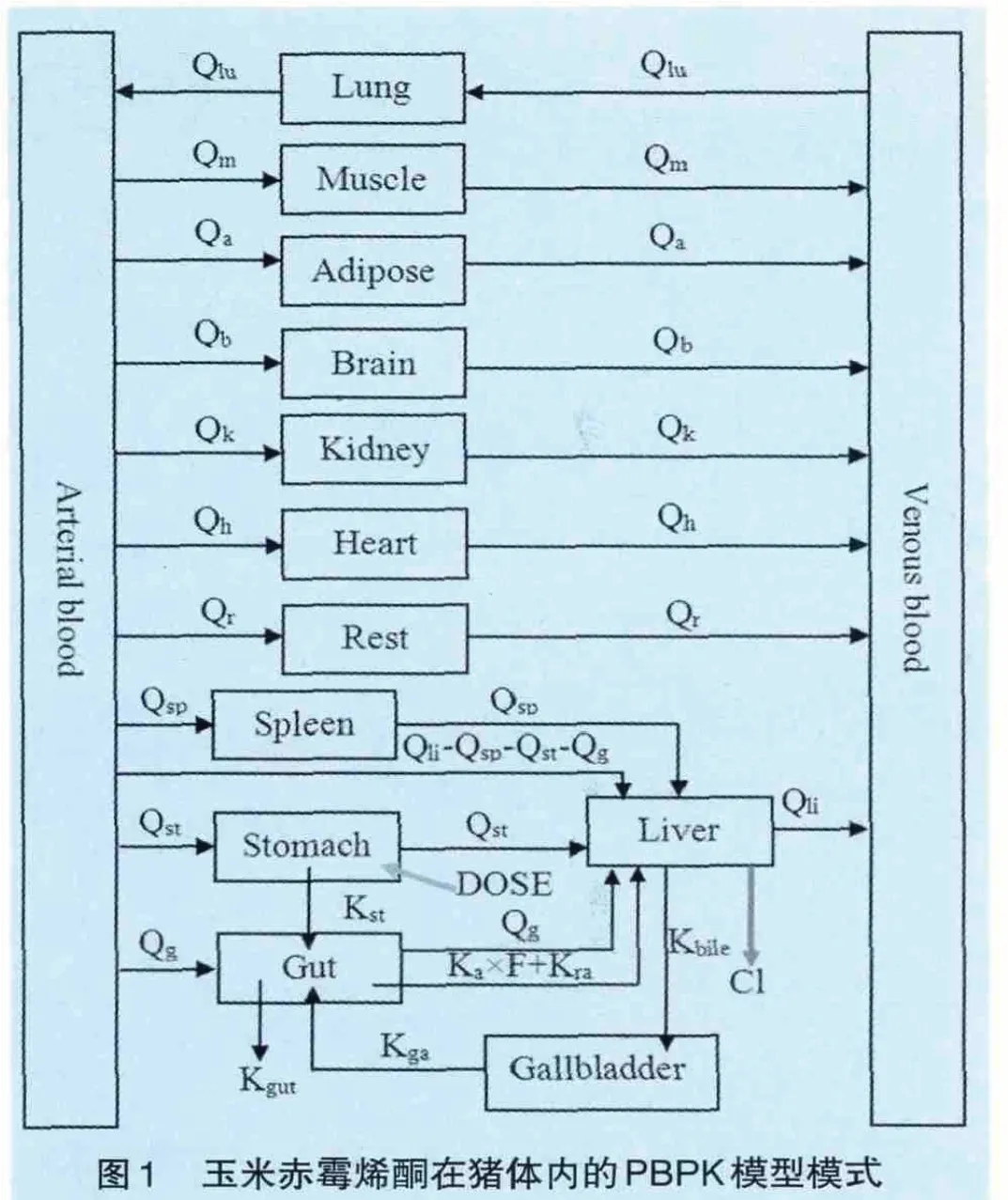
1.2.1 整体模型与循环血流图设计 经口暴露后,ZEA在猪体内吸收迅速,生物利用度(F)高达80%~85%,且存在肝肠循环现象[9]。Kuiper-Goodman等[10]的研究则表明ZEA易分布于脂肪组织。ZEA的主要代谢途径包括两步还原反应:ZEA首先会被还原为α-或β-玉米赤霉烯醇,后者可进一步被还原为α-或β-右环十四酮酚;肝脏是这两步代谢反应发生的主要器官[11]。除经肝脏代谢消除外,剩余小部分ZEA会以原型经胆汁排泄,并存在肝肠循环[5]。基于以上资料,本着删繁就简原则,本文建立了一个包含14个房室模块在内的PBPK模型(图1)。
本模型中,ZEA经口暴露后迅速到达胃部,并在胃排空(速率常数为Kst)作用下到达小肠,小肠中85%(生物利用度=85%)的ZEA经门静脉进入肝脏被吸收(速率常速为KA),之后在肝脏中大部分会以代谢形式清除(清除率为Cl),小部分则随着胆汁回到小肠,并被重吸收(速率常数为Kra),完成肝肠循环过程,而小肠内未被吸收部分(剩余15%)则随排泄物一起排出体外(速率为Kgut)。同时,ZEA也会在血液循环的作用下,分布到其他的各组织和器官中。本模型中,胃是药物暴露模块,为模型提供剂量来源;肝脏为药物清除模块,且其内药物代谢假定符合线性过程。
1.2.2 微分方程组的书写 参照我们之前建立的氟苯尼考在鲫鱼体内的PBPK模型[12],按照质量平衡原理书写代表各组织中ZEA浓度或质量随时间变化的微分方程组。微分方程组的书写基于以下两条基本假设[13]:(1)ZEA在各组织中的分布速度和程度取决于该组织的血流速率常数,即该模型为血流限速型;(2)ZEA从毛细血管到组织细胞的转运瞬间即达平衡,此平衡取决于ZEA在组织-血浆中的分配行为。
1.2.3 模型参数 本研究所建PBPK模型包含了大多数组织器官,涉及到众多参数,其中Q、V和P均来源于文献报道[7-8],生物利用度(F,85%)和经口染毒后ZEA的Ka(9.3 h-1)则分别来源于Biehl等[9]和Ramos等[14]的报道。因ZEA主要通过肝脏代谢和胆汁排泄清除,因此利用Danicke等[15]报道的体内清除率(48 mL/min·kg)来模拟ZEA的消除。另外模型中涉及到的肝肠循环过程中的3个参数(Kra、Kbile和Kga)、ZEA在代表其他所有组织隔室中的组织-血浆分配系数(Prest)及Kst则利用Danicke等[15]报道的浓度数据,在acslXtreme软件中通过参数优化获得。
1.2.4 PBPK模型的建立 本文利用acsl语言建立代码型PBPK模型,即在acslXtreme软件中首先定义外源物质暴露方案参数、体重及模型中其他各个变量(Q、V、P及各速率常数等),并对这些参数进行赋值;之后以acsl语言对1.2.2部分的微分方程组进行编译,并进行导数处理;此外还要定义模型运行参数,如步长、通信间隔、采样时间、计算机算法等。
1.2.5 预测ZEA在猪各组织中的浓度 模型建立成功后,可以通过更改ZEA暴露剂量和时间,轻松预测ZEA在猪各组织中的浓度。本文预测了猪经口多次(1 mg/d,连续7 d)染毒后,ZEA在各组织中的浓度。
2 结果
2.1 模型参数 猪的解剖学和生理学参数已有详细报道[7],而参数P则主要与化合物本身的物理化学性质(主要是脂水分配系数)和组织的成分构成有关,而不同种属哺乳动物间各组织在成分构成上差别不大,因此在PBPK模型中一般假定同一化合物在不同种属动物间的P是近似相等的,这也是PBPK模型种属间外推的基础。因此,本文选取了已报道的ZEA在大鼠各组织中的P[8]建立模型。Prest及另5个速率常数(Kra、Kbile、Kga、Kst、Kgut)则通过参数优化获得,其数值分别为2.78(无单位)、1.24、3.31、1.56、3.41h-1和0.21h-1。
2.2 浓度预测 猪经口多次(1mg/d,连续7 d)染毒后,各组织和血浆中ZEA的浓度见图2。从图2可见,ZEA首次暴露后,吸收迅速,血浆中浓度迅速达到峰值,此外,脾脏、胃、肾脏、心脏和脑中浓度也迅速达峰,但这些组织中药物消除也较快;而在脂肪和小肠中,ZEA最高浓度要低于肝脏和肾脏等,但其内ZEA消除缓慢。另外,从图2可以看出,连续暴露的7 d时间里,小肠和脂肪中的药物浓度均较前一天有所增加,说明ZEA在小肠和脂肪中存在较明显的蓄积作用。

3 讨论
目前有关ZEA的研究主要以毒性和代谢为主,其在动物体内的药动学和残留消除的研究报道很少,这主要是因为试验中毒素暴露剂量较难控制,剂量过高易造成动物中毒死亡,剂量过低又难以对组织中的毒素浓度进行定量。家畜中,猪对ZEA最为敏感,已有的研究显示ZEA经口暴露后,能够迅速且较完全地被猪吸收[9-14],并在肝脏中发生代谢[15],此外还存在部分胆汁排泄和肝肠循环[9],ZEA在猪体内分布广泛[15],并富集在生殖器官和脂肪组织中[11]。本研究结合以上事实,建立了一个PBPK模型,模型中包含了主要的可食性组织(肌肉、脂肪)、ZEA的主要代谢和排泄器官及ZEA的暴露途径等。但因未检索到猪生殖器官(睾丸和卵巢)的质量和血流速率常数,因此本模型中未涉及到ZEA的毒性靶组织,也不能对雌雄动物分别进行预测,这是该模型的一个不足之处。
在肝脏中,ZEA首先会被还原为α-或β-玉米赤霉烯醇,后者可进一步被还原为α-或β-右环十四酮酚。因无法直接获得ZEA在猪体外或体内的代谢速率数据,且已有的经口暴露后ZEA的代谢物在猪组织或血浆中的浓度数据也极其稀少,无法利用参数优化的方法间接获得这些代谢速率,所以本模型未对ZEA的代谢物浓度进行预测。
在猪体内ZEA以游离型和结合型两种形式存在,并处于动态变化过程中。本文因未获得ZEA的血浆蛋白结合率及葡萄糖醛酸结合率等参数,所以未将游离型和结合型ZEA进行区分,因此预测得到的浓度值是游离型和结合型ZEA的总和。
本文中使用的猪的生理学和解剖学参数均来源于健康动物[7],而ZEA会引起猪的脏器损伤,影响肝细胞功能[4],干扰血液及生物化学参数[16]。即ZEA暴露后,会对动物的多个组织器官产生影响,各组织质量、血流量等参数均可能发生改变,因此如果能够确定这些参数的改变量,并利用实际参数值建立模型的话,模型预测精度可能会有所提高。
本试验所建模型预测结果显示,ZEA在脂肪和小肠中消除较慢,这与已有的文献报道[10]一致。猪经口连续染毒过程中,每天各组织中ZEA的浓度值均有所升高,其中以脂肪和小肠的升高幅度最为明显,提示ZEA在猪脂肪和小肠组织中可能存在较严重的蓄积效应。
本试验通过文献检索获得了模型的必须参数,以ZEA在猪体内的处置特点为依据,建立了一个包含14个隔室的PBPK模型,并利用所建模型预测了ZEA多次暴露后在猪各组织中的浓度,为动物组织中ZEA浓度监控提供了一定指导。
[1]马珊珊,石慧芹,马秋刚,等.枯草芽孢杆菌对青年母猪玉米赤霉烯酮中毒症的缓解作用[J].饲料工业.2013(14):32-36.
[2]Etienne M,Jemmali M.Effects of zearalenone(F2)on estrous activity and reproduction in gilts[J].J Anim Sci.1982,55(1):1-10.
[3]赵虎,杨在宾,杨维仁,等.日粮中添加玉米赤霉烯酮对仔猪生产性能和免疫功能影响的研究[J].山东农业大学学报(自然科学版).2009,40(4):489-494.
[4]赵虎,杨在宾,杨维仁,等.玉米赤霉烯酮对仔猪生产性能和内脏器官发育影响的研究[J].粮食与饲料工业.2008(10):37-38.
[5]姜淑贞,杨维仁,杨在宾.玉米赤霉烯酮的代谢、毒性及其预防措施[J].动物营养学报,2011,23(2):196-202.
[6]杨帆.浅谈生理药动学模型及其在兽药残留研究中的应用[J].广东畜牧兽医科技.2010,35(3):3-5.
[7]Upton R N.Organ weights and blood flows of sheep and pig for physiological pharmacokinetic modelling[J].J Pharmacol Toxicol Methods.2008,58(3):198-205.
[8]Shin B S,Hong S H,Bulitta J B,et al.Physiologically based pharmacokinetics of zearalenone[J].J Toxicol Environ Health A.2009,72(21-22):1395-1405.
[9]Biehl M L,Prelusky D B,Koritz G D,et al.Biliary excretion and enterohepatic cycling of zearalenone in immature pigs[J].Toxicol Appl Pharmacol.1993,121(1):152-159.
[10]Kuiper-Goodman T,Scott P M,Watanabe H.Risk assessment of the mycotoxin zearalenone[J].Regul Toxicol Pharmacol,1987,7(3):253-306.
[11]Zinedine A,Soriano J M,Molto J C,et al.Review on the toxicity occurrence metabolism detoxification regulations and intake of zearalenone:an oestrogenic mycotoxin[J].Food Chem Toxicol,2007,45(1):1-18.
[12]Yang F,Sun N,Sun Y X,et al.A physiologically based pharmacokinetics model for florfenicol in crucian carp and oral-to-intramuscular extrapolation[J].J Vet Pharmacol Ther.2013,36(2):192-200.
[13]蒋智钢,高海,刘开永,等.生理药动学模型预测绵羊静脉注射恩诺沙星后的血药浓度[J].中国兽医杂志,2013,49(8):77-80.
[14]Ramos A J,Hernandez E,Pladelfina J M,et al.Intestinal absorption of zearalenone and in vitro study of non-nutritive sorbent materials[J].International Journal Of Pharmaceutics,1996,128(1-2):129-137.
[15]Danicke S,Swiech E,Buraczewska L,et al.Kinetics and metabolism of zearalenone in young female pigs[J].J Anim Physiol Anim Nutr(Berl),2005,89(7-8):268-276.
[16]Maaroufi K,Chekir L,Creppy E E,et al.Zearalenone induces modifications of haematological and biochemical parameters in rats[J].Toxicon,1996,34(5):535-540.

