一株猪圆环病毒2型全基因组的克隆与序列分析
王伟丞,梁海英,曾智勇,汤德元,刘 钊
(1.贵州大学动物科学学院,贵州 贵阳 550025;2.贵州大学教学实验场,贵州 贵阳 550025)
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是引起断奶仔猪多系统衰竭综合征(PMWS)的主要病原。PMWS于1997年首次在加拿大报道,随后在美国、法国、德国、日本等多个国家相继报道。近年来该病在我国普遍流行,给我国养猪业造成了巨大的经济损失[1]。2000年郎洪武等首次报道中国猪群存在PCV2感染,阳性率为42.9%[2]。2007年周绪斌等报道在2000-2005年间20多个省市PCV2感染平均阳性率达55.04%[3]。根据崔亚兰等对贵州省2007-2011年猪圆环病毒感染的流行病学调查结果表明,PCV2在贵州省的感染日益严重[4];另根据本实验室对2011-2012年间贵州部分地区的PCV2血清学调查发现,PCV2野毒感染的阳性率高达61.3%[5]。如今PCV2及其所致的相关疾病越发严重,已成为研究的热点。
2013年12月上旬,贵州省开阳县某猪场10日龄左右的仔猪发生体温升高、下痢、皮肤发红、极度消瘦为特征的急性传染病,并导致仔猪大量死亡,12月中旬该猪场送检1头病死仔猪以确定病原感染类型,经猪繁殖障碍性病毒性疫病6重PCR检测方法[6]诊断为PCV2和PRRSV混合感染。为了解该毒株的分子遗传背景,试验针对PCV2全基因设计了1对特异性引物,对该毒株进行全基因组的扩增、克隆和序列分析,旨在给贵州省PCV2的流行病学研究、诊断与防控、疫苗免疫等提供依据和参考。
1 材料与方法
1.1 病料来源 病料样品系贵州省开阳县某猪场送检的疑似PMWS的1头病死仔猪。
1.2 主要试剂 DNA提取试剂盒,购自上海生工生物工程技术服务有限公司;LA Taq DNA聚合酶、限制性内切酶HindⅢ和BamHⅠ、DL-2 000、pMD19-T Simple Vector,购自宝生物工程(大连)有限公司;E.Z.N.A.TM Gel Extraction Kit,OMEGA公司产品;普通质粒小提试剂盒为TIANGEN公司产品;大肠杆菌感受态TOP10(贵州省动物疫病研究室制备和保存);其他化学试剂均为国产分析纯。
1.3 引物的设计与合成 根据GenBank上已发表的PCV2序列设计1对引物扩增全序列:
PCV2-S:5′-CCCAAGCTTCTTTTTTATCACTTC GTAATGGTTTT-3′;
PCV2-As:5′-GGTGGATCCACTCAGTAATTTA TTTCATATGGA-3′。
分别在引物两端引入HindⅢ和BamHⅠ酶切位点(划线部分),引物由上海生工生物工程技术服务有限公司合成。
1.4 病毒DNA的提取 取送检病死仔猪淋巴结、肾脏、脾脏等组织用PBS按1∶5倍稀释研磨,制成乳悬液,-80℃反复冻融3次后,8 000 r/min离心15 min,取上清按照DNA提取试剂盒操作步骤提取病毒核酸,-20℃保存备用。
1.5 PCV2全基因组的克隆与测序 利用设计的PCR引物,以上述制备好的DNA为模板进行PCR扩增。PCR反应体系:模版DNA 5.0 μL,10×LA Taq Buffer 5.0 μL,dNTP Mixture 8.0 μL,上下游引物各1μL,LA Taq 0.5 μL,ddH2O 29.5 μL。反应条件:94 ℃预变性5 min;94℃热变性1 min,57℃退火40 s,72℃延伸2 min,共35个循环;72℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测。
将3个目的基因片段按照常规方法分别克隆到pMD19-T Simple载体中,进行PCR、酶切和测序鉴定。
1.6 序列分析 应用DNAStar 7.0和MEGA5.0生物学软件对克隆的PCV2全基因组序列与Gen-Bank中查得的PCV2全基因组核苷酸序列进行比对分析。
2 结果
2.1 病料PCR的扩增 以组织中提取的病料核酸为模版,应用上述特异性引物进行PCR扩增,经琼脂糖凝胶电泳后,扩增出1条与预期片段大小1 800 bp左右的特异性条带(图1)。
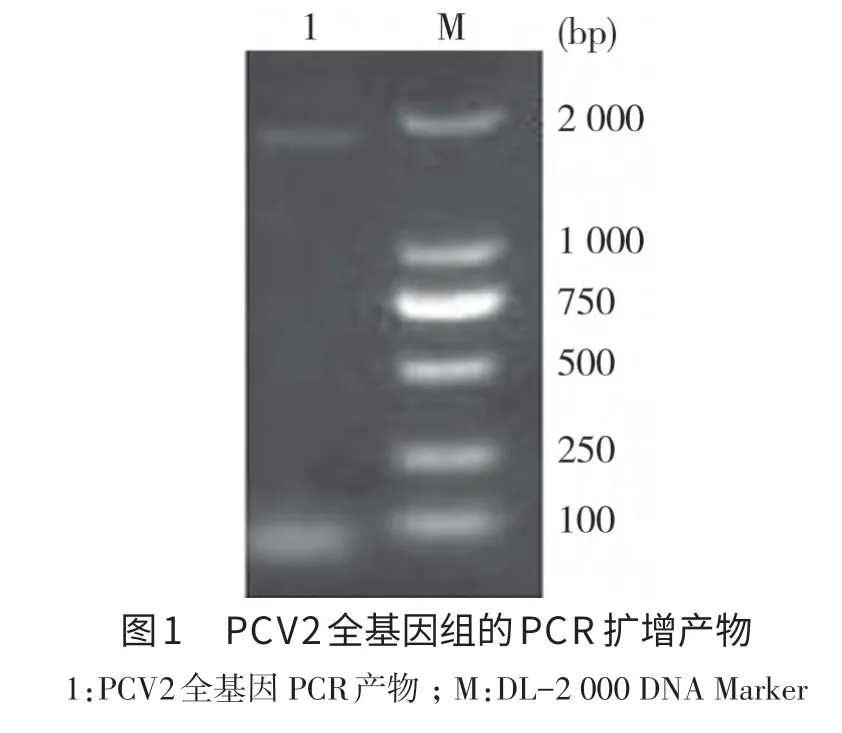
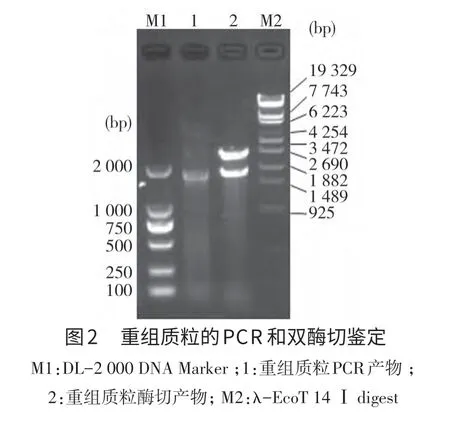
2.2 重组质粒的鉴定 将纯化的PCR产物连接至pMD19-T Simple载体,重组质粒pMD19-TPCV2经PCR和双酶切鉴定,均获得大小约1 800 bp的与预期片段大小一致的DNA片段,与预期结果相符(图2)。
2.3 序列分析 测序结果表明,该毒株基因组全长为1 767 bp,GenBank登录号为KJ139962,将其命名为GZ-KY1株。与从GenBank收录的毒株序列中选取的20株不同国家和地区的PCV2毒株进行核苷酸序列相似性比对分析,结果表明,所有PCV2毒株之间的序列相似性均相对较高,介于94.1%~98.4%之间,其中GZ-KY1与GQ359008(上海)的毒株的相似性最高为98.4%,与EU148504(丹麦)毒株相似性最低分别为94.1%,与疫苗株LG(HM038034)和SH(AY686763)的相似性分别为95.0%和96.3%。
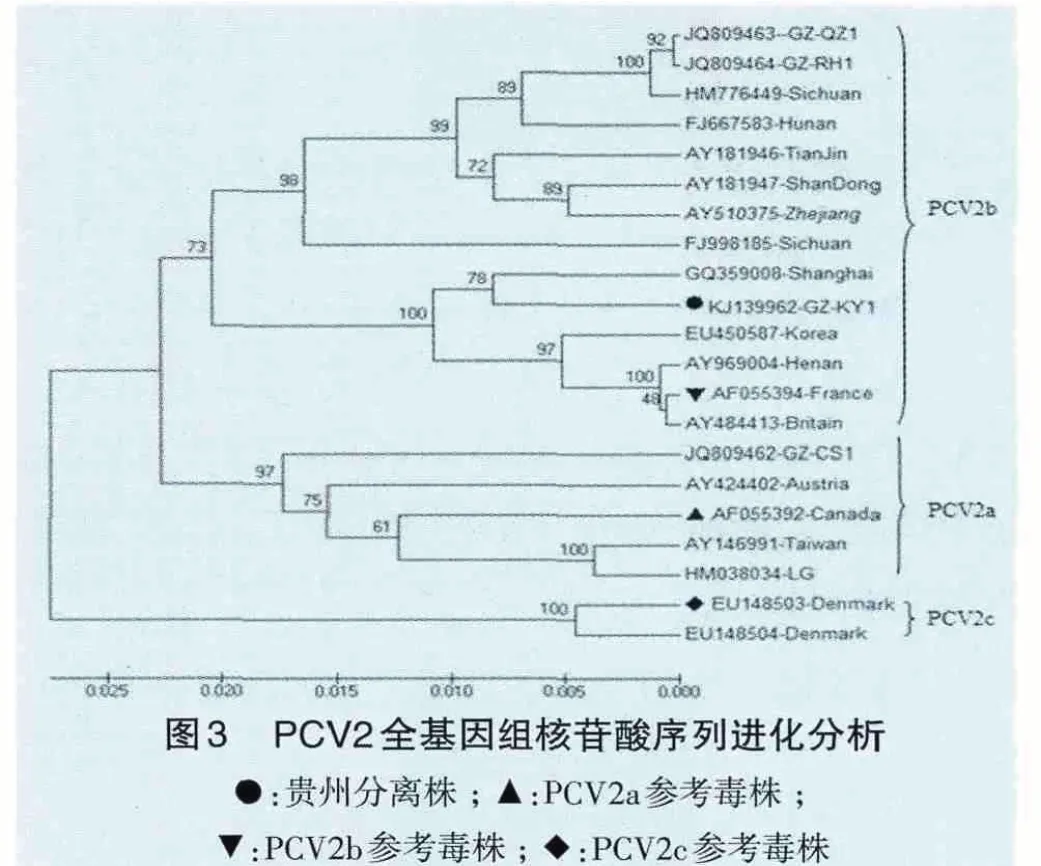
为了更好地了解PCV毒株的遗传学特性及相互间亲缘关系,应用MEGA5.0软件,以相关PCV2毒株全基因组核苷酸序列,绘制了系统发生进化树(图3)。根据2008年欧盟猪圆环病毒疾病委员会基因分型的标准[7],可将PCV2 KJ139962-GZKY1(开阳)株划归为PCV2b基因型,且贵州株JQ809463-GZ-QZ1(清镇)和JQ809464-GZ-RH1(仁怀)均属于PCV2b基因型,仅JQ809462-GZCS1(长顺)株属于PCV2a基因型,表明贵州地区流行的PCV2基因型以2b型为主。
3 讨论
PCV2相关疾病已成为危害我国养猪业的重要疫病,其单独感染较少,常与猪繁殖与呼吸综合征病毒、猪瘟病毒、猪伪狂犬病病毒等混合感染,表现出严重的临床症状和较高的死亡率。PCV2主要分为PCV2a,PCV2b,PCV2c三个亚型,其中PCV2a主要在欧美等国家和亚洲的日本、韩国、中国台湾等;PCV2b包含了加拿大、美国、巴西、中国等;PCV2c仅在丹麦有报道。有学者认为PCV2的不同基因型毒力不同,普遍认为PCV2b的致病力要强于PCV2a,且在1998-2002年间我国流行的猪圆环病毒主要以PCV2a亚型为主,2002年以后PCV2a亚型较少,主要以PCV2b为主[8]。
本试验从贵州开阳地区疑似PMWS病料中通过PCR扩增获得了一株PCV2全基因序列。经序列分析表明,该毒株属于PCV2b亚型,且本实验室先前分离的3株PCV2毒株中,2株PCV2b亚型,1株为PCV2a亚型,表明贵州地区流行的猪圆环病毒也以PCV2b为主。与国内外参考毒株之间的相似性在94.1%~98.4%之间,表明所有PCV2毒株之间的亲缘关系均较近,基因组比较保守,但近年来我国也有PCV2基因组大小为1 766 bp的报道,这可能是PCV2变异所致[9-10],这些变异是否和毒力以及临床症状有关有待进一步研究。
目前PCV2已经在我国猪场广泛存在,猪场对于PCV2的防控除加强饲养管理外,还需要对混合感染的其他病原作适当的主动免疫和被动免疫,预防性给药治疗控制细菌性疾病的混合感染或继发感染,同时开展有效的综合性防制措施,才能起到事半功倍的效果[11]。
[1]Li W,Wang X,Ma T,et al.Genetic analysis of porcine circovirus type 2(PCV2)strains isolated between 2001 and 2009:genotype PCV2b predominate in postweaning multisystemic wasting syndrome occurrences in eastern China[J].Virus Genes,2010,40(2):244-251.
[2]郎洪武,张广川,吴发权,等.断奶猪多系统衰弱综合征血清抗体检测[J].中国兽医科技,2000,30(03):3-5.
[3]周绪斌,张馨玉,许秀梅.我国猪圆环病毒2型的流行情况和分析[J].中国猪业,2007(05):37-41.
[4]崔亚兰,王开功,张华,等.2007-2011年贵州省猪圆环病毒感染的流行病学调查[J].畜牧与兽医,2013,45(03):70-73.
[5]王伟丞,曾智勇,刘志杰.贵州省几种猪繁殖障碍性疫病抗体水平检测[J].贵州农业科学,2013,41(05):118-120.
[6]刘志杰,曾智勇,汤德元,等.猪繁殖障碍病毒性疫病六重PCR检测方法的建立及应用[J].畜牧兽医学报,2012,43(09):1429-1436.
[7]Cortey M,Olvera A,Grau-Roma L,et al.Further comments on porcine circovirus type 2(PCV2)genotype definition and nomenclature[J].Vet Microbiol,2011,149:522-523.
[8]黄新,康立超,韩猛立,等.猪圆环病毒2型XJ-SW株全基因组的克隆与序列分析[J].中国兽医科学,2012,42(5):461-466.
[9]郭龙军,陆月华,危艳武,等.我国部分地区猪圆环病毒2型分离株的遗传变异分析[J].中国预防兽医学报,2009,31(11):856-859.
[10]Shang S B,Jin Y L,Jiang X T,et al.Fine mapping of antigenic epitopes on capsid proteins of porcine circovirus and antigenic phenotype of porcine circovirus type 2[J].Mol Immunol,2009,46(3):327-334.
[11]贾怀杰,王晓霞,房永祥,等.猪圆环病毒2型甘肃株全基因组克隆及序列分析[J].动物医学进展,2010,37(1):1-6.

