副鸡禽杆菌荚膜多糖的提取及HPLC分析
王雪敏,路迎迎,陈小玲,路明华,张培君,龚玉梅,王宏俊
(1.北京市农林科学院畜牧兽医研究所 畜禽疫病防控技术北京市重点实验室,北京 海淀 100097;2.河北工程大学农学院,河北 邯郸 056021;3.河北省禽病工程技术研究中心,河北 邯郸 056021)
鸡传染性鼻炎是由副鸡禽杆菌(Avibacterium paragallinarum,Apg)引起的一种急性呼吸道传染性疾病。主要引起育成鸡的生长受阻,增重减慢,鸡群的死亡数和淘汰数增加,产蛋率下降给养殖户带来了巨大的损失[1]。1920年,由Beach首先报道,该病,1931年DeBlieck初次分离到该病原体,该病目前在世界许多国家和地区都有发生和流行[2]。
荚膜多糖(capusular polysaccharide,CPS)是大分子物质,分离制备比单糖和小分子寡糖更加复杂,高度含水量(>95%)[3],它们是由重复单糖通过糖苷键连接而成同聚体或异聚体,CPS的结构复杂决定于糖链的大小、分枝数目、单糖的组成等。国外有很多关于不同细菌菌株的多糖结构的报道,分子量在万以上,多为葡萄糖,半乳糖等组成的杂多糖[4]。已有报道多糖是副鸡禽杆菌的有效抗原成分,经试验证,实接种有荚膜副鸡禽菌株的动物表现出典型的临床症状,而接种过没有荚膜副鸡禽菌株的动物,却没有出现临床症状,这一结果说明荚膜是副鸡禽菌的一种重要的毒力因子[5]。CPS单独活性的研究及开发尚未见报道,鉴于多糖对机体的免疫调节活性具有广泛影响,本研究将为相关机理的研究奠定基础。
1 材料与方法
1.1 菌种 Apg B型分离株,由北京市农林科学院畜牧兽医研究所畜禽疫病防控技术北京市重点实验室分离鉴定并保存。
1.2 主要试剂及仪器 胰蛋白大豆琼脂(Tryptic Soy Agar,TSA)、胰蛋白大豆肉汤(Tryptic Soy Broth,TSB)为BD公司产品;烟酰胺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide,NAD)为 Amresco公司产品,购自北京百灵克生物技术有限公司,TSA或TSB培养基在使用前均加入终浓度为50 μg/mL的NAD和10%的新生牛血清;浓盐酸、无水乙酸钠、无水乙醇、苯酚等均为分析纯,购自北京市国药集团;L-鼠李糖、D-木糖、D-葡萄糖、D-阿拉伯糖、D-果糖、D-甘露糖、D-半乳糖等标准单糖,均为Sigma公司产品,购自上海化学试剂有限公司,分子量为 4.32 Ku、12.6 Ku、60.6 Ku、110 Ku、410 Ku的葡聚糖标准品,购自中国计量研究所,LC-10A液相色谱仪,购自日本岛津有限公司;Nucleosil C18 1005-5NH2 4.6×250mm色谱柱,购自上海优其实业有限公司,Shodex sugar KS-804凝胶色谱柱,购自迪马科技有限公司;Heidolp旋转蒸发仪,购自北京康高特科技有限公司。
1.3 方法
1.3.1 副鸡禽杆菌的培养 Apg在带有5%CO2的37℃恒温培养箱培养,TSA固体培养传种2代,取多个菌落进行液体培养,在生长9~12 h能达到最佳对数生长期。
1.3.2 Apg B型分离株荚膜染色 运用Anthong荚膜染色法进行[6],具体操作步骤是:加1滴无菌水于载玻片上,从固体培养基上挑少量对数生长期的菌苔涂成薄层风干,1%结晶紫水溶液染2 min,20%硫酸铜冲洗,吸水纸吸干,立即加1~2滴香柏油于涂片处,显微镜镜检。
1.3.3 Apg荚膜多糖提取及纯化 按3%的比例接种培养基扩大培养,37℃恒温箱进行搅拌培养,达到对数生长期终止培养,收集10 L TSB液体培养的菌液,用0.25%甲醛灭活后离心去除菌体,上清液浓缩加入适量乙酸钠和中浓度为25%的无水乙醇,以去除核酸沉淀,4℃过夜后离心收集上清,加入适量乙酸钠和80%无水乙醇完全沉淀粗多糖,4℃过夜离心[7]。去除杂蛋白:沉淀用0.3 mol/L乙酸钠溶液溶解,以等体积苯酚-乙酸钠饱和液离心抽提,此步骤重复4次[8]。吸取上清液用蒸馏水透析去除残存苯酚,透析后内液加入适量乙酸钠和80%无水乙醇以沉淀多糖,用无水乙醇及丙酮各洗2次,冻干所收获的多糖,称量并进行鉴定及分析。
1.3.4 葡萄糖标准曲线的制备 精确称取无水葡萄糖0.5 g,蒸馏水定容至1 L,取10只具塞试管,分别吸取0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL,各加水补至2.0 mL,加入6%苯酚溶液1.0 mL及浓硫酸5 mL,摇匀,放置沸水中15 min,取出再放入冷水中,20 min后在波长490 nm处测定吸光度,以蒸馏水做空白对照,以葡萄糖毫克数为横坐标,吸光值为纵坐标,绘制标准曲线[9]。
1.3.5 多糖含量的测定 精确称取荚膜多糖粗制品85 mg,加入1 mL蒸馏水配制储存溶液,使用时稀释30倍制成多糖样品溶液。取制备好的样品溶液1.0 mL,加入蒸馏水补至2.0 mL,加入6%苯酚溶液1.0 mL及浓硫酸5 mL,摇匀,放置沸水中15 min,取出再放入冷水中,20 min后在波长490 nm处测定吸光度,同时做3个重复。根据公式:多糖含量(%)=[(C×D×F)÷W]×100% 计算多糖在样本中的含量。C为多糖样品溶液的浓度(mg/mL),D为样品的稀释倍数;F为换算因子(国际F=3.19),W样为样品重量。
1.3.6 荚膜多糖的单糖组分分析 称取干燥10 mg样品放入安瓶加入3 mol/L盐酸5 mL封口80℃水解8 h。将水解后的多糖离心过滤去杂质浓缩,色谱分析用1 mL蒸馏水溶解,进样10 μL,根据标准单糖与样品的保留时间的比较确定组成单糖的种类。
1.3.7 多糖分子量测定 称取干燥样品10 mg用1 mL蒸馏水溶解,离心过滤去杂质,进样5 μL液相色谱分析,已知标准品分子量和出现波峰时间,对照样品出现波峰时间来计算出分子量的大小[10]。
2 结果分析
2.1 Apg B型分离株荚膜染色 荚膜染色结果见图1所示,在图中能清楚看到细菌的细胞壁外包围有一层黏性物质,表明体外培养状态下副鸡禽杆菌是有荚膜的。
2.2 经冻干后称量并计算,粗提Apg荚膜多糖的提取得率为85 mg/L。
2.3 标准曲线的测定 配制好的葡萄糖标准溶液按照不同剂量分别吸出,在加入蒸馏水补齐至2.0 mL,按上述苯酚-硫酸比色法操作,得到不同吸光值。以吸光值为纵坐标,糖浓度为横坐标绘制标准浓度曲线,结果见表1。由表1得出葡萄糖标准曲线图,如图2。



表1 不同浓度葡萄糖的吸光值
2.4 粗提物中多糖含量 根据表1,图2标准曲线得出回归方程:y=1.3339X+0.0227,R2=0.994。y为吸光度,X为多糖浓度(mg/mL)。根据葡萄糖标准曲线可以看出在0.0~0.9 mg呈现良好的线性关系。提取荚膜多糖浓度使用回归方程来计算。荚膜多糖在OD490处测得3次吸收值,取其平均数为0.728,将该平均值带入回归方程得出荚膜多糖样品的浓度为0.529 mg/mL。依据公式:多糖含量(%)=[(C×D×F)÷W]×100%=[(0.529×30×3.19)÷85]×100%,得出荚膜多糖的含量为59.6%。
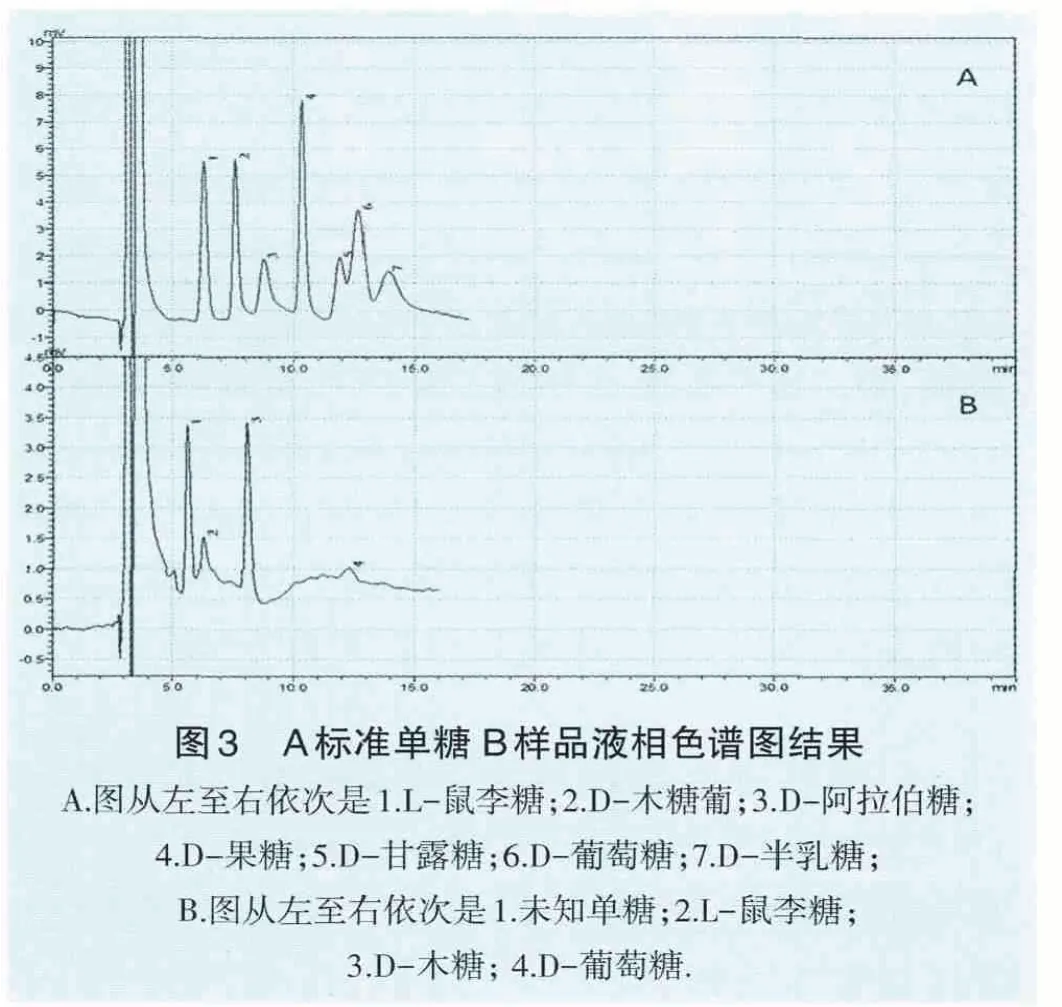
2.5 多糖的单糖组分构成 液相色谱分析单糖构成结果见图3。从图3-A标准品单糖出峰时间和峰面积对比,图3-B图样品出峰时间和面积,可以确定Apg B型分离株荚膜多糖主要由L-鼠李糖、D-木糖、D-葡萄糖组成,图3-B图第一个峰为未知糖。
2.6 多糖分子量 分子量测定结果见图4。其中图4A从左到右的波峰依次对应分子量为410 Ku、110 Ku、60.6 Ku、12.6 Ku、4.32 Ku,依据标准品分子量大小和其出现波峰的时间,对照B图样品出现波峰时间来计算样品多糖的分子量。本试验中所测样品多糖的分子量约为209 Ku左右,图4C是A图标准分子量曲线图,横轴为标准品所用时间,纵轴为分子量大小。

3 讨论
关于副鸡禽杆菌荚膜多糖的研究鲜有报道,早在1981年Iritani等研究发现,该菌的粗提多糖含有两种成分,并对这两种成分做了相关的活性分析,证实这些成分具有保护活性和型特异性。直到2010年,台湾也有关于副鸡禽杆菌荚膜化学成分的分析,该研究主要发现了外膜基因序列存在两种基因型[5],而本文提取纯化了副鸡禽杆菌的荚膜多糖并首次对其含量、组分、分子量大小作了初步研究。
确定荚膜存在是进行分析鉴定的前提。荚膜染色方法各不相同,要有摸索过程。开始使用墨汁染色法造成荚膜效果不是很理想,最终选择Anthong荚膜染色法操作更为简便,荚膜清晰可见并可观察到荚膜的自然形态,此方法操作简便省时高效,值得推广[6]。冷酚蛋白抽提次数增加多糖含量会逐渐降低,抽提5次以上会使荚膜多糖化学结构受到损伤导致多糖指标不合格[7],抽提1~2次杂质去除不彻底多糖指标不合格,定为4次为最佳抽提条件。本文多糖含量测定,用苯酚-硫酸比色法具有简单快速无需多糖纯品和贵重仪器等优点,此法测定多糖含量其重复性和稳定性好[11-12]。
本试验运用高效液相色谱分析Apg荚膜多糖的组分,由于没有相应的标准单糖,目前还无法确定图3B中出现的第一个峰对应的是哪一种单糖,仍需再进一步的研究加以确定。
本研究应用高效液相色谱分析了多糖的分子量。同条件下分子量越大出峰越早,根据标准葡聚糖出峰时间和分子量大小的对应关系,来计算出样品出峰时间分子量。在检测过程中,样品的纯度跟出现的峰是密切相关的,过多杂质会导致试验结果不理想。
据报道荚膜多糖是细菌中毒力的主要成分之一,但是提取纯化后的荚膜多糖只是半抗原,免疫原性弱,往往需要与其他蛋白偶联后才能发挥免疫作用。有文献[13]报道,荚膜多糖与菌体蛋白质联合粗提物的免疫原性明显高于荚膜多糖本身。因此选择较为简单的粗提法,可使浓缩物能够保持免疫原性,同时也可以在生产过程中降低成本。本研究对探索副鸡禽杆菌亚单位疫苗的可行性提供了一定的参考。
[1]Calnek B W,Barnes H J,Beard C W.McDougald L R Snif Y M.Diseases of Poultry[M].10th Edn(Ames Iowa Iowa State University Press),2009,41(7):179-190.
[2]Poernom O S,SU Tarm A,Rafiee M,et al.Characterization of isolates of Haemophilus paragallinanum from Indonesia[J].Aust Vet J,2000,78(11):759-762
[3]Costerton J M,Irvin R T,Cheng K J.The bacterial glycocalyx in nature and disease.Annual Review of Microbiology,1981,35:299-324.
[4]Ajit Varki,Richard Cummings,Jeffrey Esko.et al.Essentials of Glycobiology[J].California:Cold Spring Harbour Laboratory Press,2002.
[5]WU Jin-Ru,Chen Ping-Yi,Shien Jui-Hung,et al.Analysis of the biosynthesis genes and chemical components of the capsule of Avibacterium paragallinarum[J].Veterinary microbiology,2010,145(1):90-99.
[6]克拉克G.生物染色程序[M].北京:科技出版社,1985.
[7]尹姗姗,李贵凡,刘学龙,等.b流感嗜血杆菌荚膜多糖纯化方法的优化[J].动物医学进展,2009,30(1):50-52.
[8]杨明,陈作江,曹鑫,等.C群脑膜炎球菌多糖纯化方法的改进[J].微生物学免疫学进展,2006,34(4):27-29.
[9]董群,郑丽伊,方积年.改良的苯酚-硫酸法测定总糖和寡糖的研究[J].中国药学杂志,1996,31(9):550.
[10]张紫恒.不同血清分型链球菌荚膜多糖的提取分离与结构组成初步分析[D].青岛:中国海洋大学,2011.
[11]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances,Anal chem,1956,28:350.
[12]Dubois M,Gilles K A,Hamilton J K,et al.A colorimtric method for the determination of sugars Nature,1951,168:167
[13]阮国瑞,范子文,张雪萍.细菌荚膜多糖纯化、分析及免疫原性的研究现状[J].南京铁道医学院学报,1997,16(3):216-218.

