小型猪特异性麻醉颉颃剂对小型猪血浆RAAS的影响
宋旭东,姜 胜,侯金龙,牛栋梁,范宏刚,王洪斌
(东北农业大学动物医学学院,黑龙江 哈尔滨 150030)
肾素-血管紧张素-醛固酮系统(R-A-A-S)是由肾素(PRA)、醛固酮(ALD)、血管紧张素(AⅡ)等一系列激素和相应的酶所组成,体内起着调节血压、水和电解质平衡,维持机体内环境稳定的作用,其作用机理包括调节全身血容量和控制外周阻力。过度激活RAAS,PRA、AⅡ浓度会显著升高,引起全身小血管强烈收缩,造成组织器官不同程度的缺血,甚至导致水和电解质紊乱[1],从而导致各重要脏器处于应激状态[2]。
心钠素(ANP)是心肌细胞分泌的一种循环激素,不仅具有强烈的扩张血管作用[3],还有颉颉应激反应和稳定循环的作用[4],从而有助于缓解机体对伤害性刺激的反应。虽然小型猪特异性麻醉颉颃剂对小型猪肝肾功能、氧化损伤的研究已经完成[5-6],但是目前尚无对该复合制剂催醒小型猪过程中血流动力学变化及此变化与RAAS关系的研究报道。本研究旨在观察小型猪应用XFM麻醉剂后,采用小型猪特异性麻醉颉颃剂催醒过程中血浆RAAS和ANP的动态变化,通过分析ANP和RAAS的变化,探讨小型猪特异性麻醉颉颃剂对小型猪血流动力学的影响的作用机制。
1 材料与方法
1.1 实验动物 中国实验用小型猪14头,16~18月龄,体重49.8±5.2 kg,购自中国农业大学实验用小型猪繁育基地,临床检查健康,营养状况良好。
1.2 试验材料 XFM(东北农业大学外科教研室,批号:20110821);小型猪特异性麻醉颉颃剂(东北农业大学外科教研室,批号:20110824)。PRA ELISA测定试剂盒、AⅡELISA测定试剂盒、ALD ELISA测定试剂盒及ANPELISA测定试剂盒;Sig⁃ma公司3-30K高速冷冻离心机(德国Sigma公司);Epoch酶标仪(美国BioTek公司);Elx50洗板机(美国BioTek公司)等。
1.3 试验方法 14头小型猪禁食12 h,不禁水,随机分为单纯麻醉组和麻醉-催醒组,每组7头。两组动物麻醉之前,此时间点记为0min。保定记录小型猪的SBP、MAP、DBP、HR、SPO2、T和RR值,并采前腔静脉空白血2mL,适量肝素抗凝,采血完成后立即注射XFM并计时。记录麻醉后5、10、20、30 min各项生理指标,并采前腔静脉血2mL。麻醉后30min即刻,麻醉-催醒组立即注射小型猪特异性麻醉颉颃剂,单纯麻醉组则立即注射等量生理盐水,随后记录麻醉后32、35、40、60、90min、120min小型猪的SBP、MAP、DBP、HR,SPO2、RR、T值并于各时间点采集前腔静脉血2mL,采集的血样,加入肝素抗凝,室温静置1 h,3 000 r/min离心分离血浆,置于-80℃冰箱内冷冻保存,待检。此后记录苏醒及行走时间。
1.4 统计分析 数据使用±SD表示,用统计软件SPSS13.0进行一维方差分析,P<0.05为差异显著。P<0.01为差异极显著。
2 结果
2.1 小型猪一般临床体征的变化 麻醉-催醒组小型猪肌肉注射小型猪特异性麻醉颉颃剂后,表现为镇痛、镇静逐渐恢复,肌肉张力开始增加,随后出现挣扎,最后站立,直到行走。小型猪麻醉催醒期和苏醒期分别为 9.7±2.2 min、18.4±7.8 min。催醒过程均迅速且平稳,无兴奋及复睡现象。小型猪催醒期间SPO2、RR和T分别维持在91.8%±3.3%~98.6%±1.1%、47±19次/min~83±15次/min和37.0±0.3℃~39.1±0.3℃之间,且呼吸、心律平稳,可视黏膜等其他基本生命体征正常。
2.2 小型猪血流动力学的变化 XFM麻醉30min的小型猪肌肉注射颉颃剂后,表现出明显的血流动力学变化。SBP、DBP、MAP及HR均不同程度地增加,于40 min时升至监测过程的最高值,与0 min比较分别增加19.68%(P<0.01)、27.03%(P<0.01)、22.83%(P<0.01)和 40.87%(P<0.01),与30min(注射小型猪特异性麻醉颉颃剂时)比较,分别增加34.51%(P<0.01)、28.77%(P<0.01)、29.88%(P<0.01)和47.27%(P<0.01)。随后各项监测指标逐渐下降,90min时已基本恢复至麻醉前水平,与0 min比较P>0.05,差异不显著。麻醉-催醒组SBP在32min、90min时与单纯麻醉组比较差异显著(P<0.05),麻醉后35 min、40min、60min时麻醉-催醒组与单纯麻醉组比较差异极显著(P<0.01);麻醉-催醒组DBP及MAP在麻醉后35min、60min时与单纯麻醉组比较差异显著(P<0.05),麻醉后40min时麻醉-催醒组与单纯麻醉组比较差异极显著(P<0.01);麻醉-催醒组HR在麻醉后32min、35 min、40min、60min及90 min时与单纯麻醉组比较差异极显著(P<0.01)。结果见表1。
2.3 小型猪血浆R-A-A-S和ANP的变化 试验结果显示,XFM麻醉的小型猪在肌肉注射小型猪特异性麻醉颉颃剂后,其血浆PRA、AⅡ及ALD的浓度在注射颉颃剂后的10min下降至最低点,分别较 0 min下降 25.00%(P>0.05)、25.85%(P>0.05)、27.77%(P<0.05),分别较30min(注射小型猪特异性麻醉颉颃剂时)下降40.00%(P<0.05)、38.90%(P<0.05)、23.59%(P>0.05),之后血浆PRA、AⅡ及ALD的浓度开始上升,到90min时已经基本恢复正常(P>0.05)。麻醉-催醒组血浆PRA、ALD的浓度在监测各时间点分别与相应单纯麻醉组比较均无明显差异(P>0.05);麻醉-催醒组血浆AⅡ的浓度在监测40min时与单纯麻醉组比较差异显著(P<0.05)。血浆ANP的浓度在注射小型猪特异性麻醉颉颃剂后的10min上升至最高点,分别较0min上升31.34%(P<0.05),分别较30 min(注射小型猪特异性麻醉颉颃剂时)上升47.97%(P<0.01),之后血浆ANP的浓度开始下降,到90min时已经基本恢复正常(P>0.05)。与X/S组:X/W组血浆ANP的浓度在麻醉监测40min时与对照组比较差异显著(P<0.05)。体结果见表2。
表1 小型猪特异性麻醉颉颃剂对小型猪血流动力学的影响 (n=7,±SD)
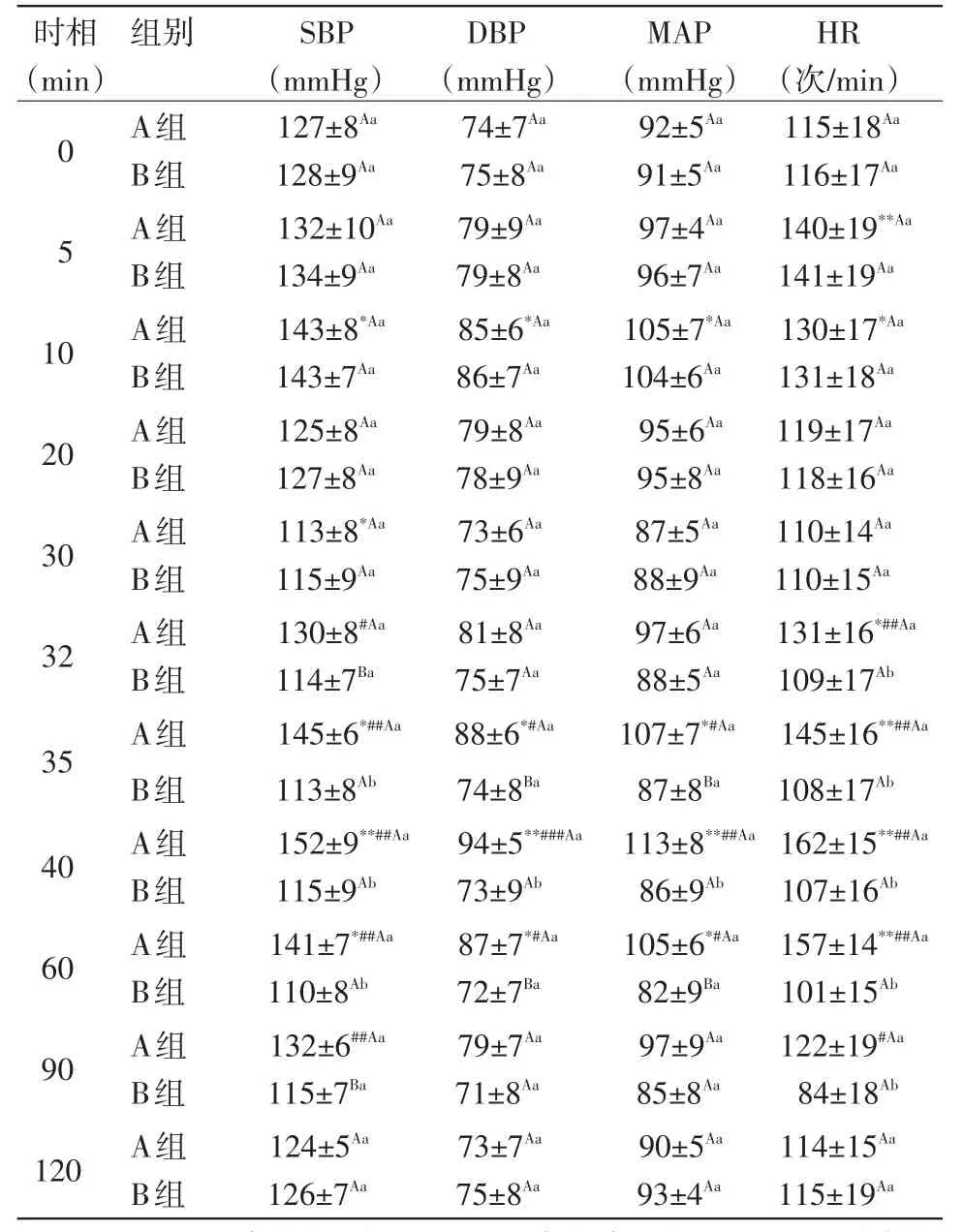
表1 小型猪特异性麻醉颉颃剂对小型猪血流动力学的影响 (n=7,±SD)
注:(1)A组代表麻醉催醒组;B组代表单纯麻醉组;(2)组内数据比较:**代表与0min比较P<0.01,差异极显著,*代表与0min比较P<0.05,差异显著;##代表与30min比较P<0.01,差异极显著,#代表与30 min比较P<0.05,差异显著;(3)同一时间点两组间数据比较:肩标小写字母不同表示差异极显著(P<0.01);大写字母不同表示差异显著(P<0.05);字母相同且大小写也相同表示差异不显著(P>0.05),表2同
时相 组别 SBP DBP MAP HR(min) (mmHg) (mmHg) (mmHg) (次/min)A组 127±8Aa 74±7Aa 92±5Aa 115±18Aa 0 B组 128±9Aa 75±8Aa 91±5Aa 116±17Aa A组 132±10Aa 79±9Aa 97±4Aa 140±19**Aa 5 B组 134±9Aa 79±8Aa 96±7Aa 141±19Aa A组 143±8*Aa 85±6*Aa 105±7*Aa 130±17*Aa 10 B组 143±7Aa 86±7Aa 104±6Aa 131±18Aa A组 125±8Aa 79±8Aa 95±6Aa 119±17Aa 20 B组 127±8Aa 78±9Aa 95±8Aa 118±16Aa A组 113±8*Aa 73±6Aa 87±5Aa 110±14Aa 30 B组 115±9Aa 75±9Aa 88±9Aa 110±15Aa A组 130±8#Aa 81±8Aa 97±6Aa 131±16*##Aa 32 B组 114±7Ba 75±7Aa 88±5Aa 109±17Ab A组 145±6*##Aa 88±6*#Aa 107±7*#Aa 145±16**##Aa 35 B组 113±8Ab 74±8Ba 87±8Ba 108±17Ab A组 152±9**##Aa 94±5**###Aa 113±8**##Aa 162±15**##Aa 40 B组 115±9Ab 73±9Ab 86±9Ab 107±16Ab A组 141±7*##Aa 87±7*#Aa 105±6*#Aa 157±14**##Aa 60 B组 110±8Ab 72±7Ba 82±9Ba 101±15Ab A组 132±6##Aa 79±7Aa 97±9Aa 122±19#Aa 90 B组 115±7Ba 71±8Aa 85±8Aa 84±18Ab A组 124±5Aa 73±7Aa 90±5Aa 114±15Aa 120 B组 126±7Aa 75±8Aa 93±4Aa 115±19Aa
2.4 小型猪血浆内R-A-A-S、ANP与血流动力学指标的相关性分析 相关性分析发现:XFM麻醉30min的小型猪肌肉注射小型猪特异性麻醉颉颃剂后,麻醉催醒组小型猪血浆PRA、ALD浓度与血压和心率变化均没有相关性(P>0.05);小型猪血浆AⅡ的浓度与其相应对照组比较差异显著(P<0.05),且与HR呈现显著负相关(P<0.05),与相应血压无相关性(P>0.05),结果见表3。
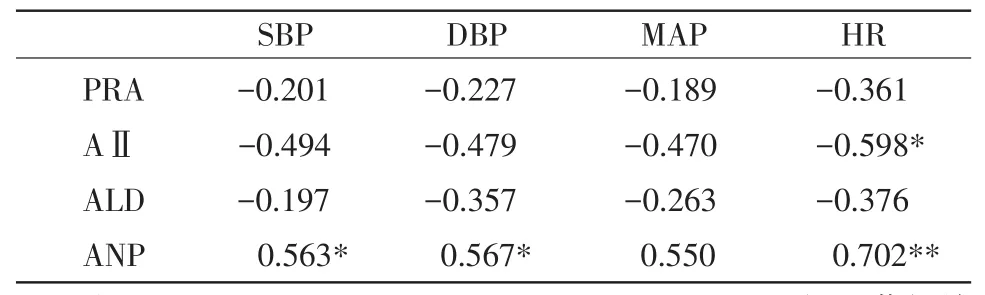
表3 小型猪血管活性物质与血流动力学指标相关性分析
3 讨论
3.1 小型猪特异性麻醉颉颃剂对小型猪R-A-AS的影响与血流动力学变化 R-A-A-S具有调节机体血压、水和电解质平衡的作用,其作用机理包括调节全身血容量和控制外周阻力。本试验中,XFM麻醉的小型猪肌肉注射颉颃剂后,血浆PRA、AⅡ及ALD的浓度均呈现出先降低后升高的变化趋势,可见小型猪特异性麻醉颉颃剂对小型猪的R-A-A-S造成了一定程度的影响。但仅见麻醉-催醒组小型猪血浆AⅡ的浓度与单纯麻醉组比较差异显著(P<0.05),且与HR呈现显著负相关(P<0.05),与相应血压无相关性(P>0.05);推断XFM麻醉30min的小型猪肌肉注射颉颃剂后,AⅡ参与了小型猪血流动力学变化的调节,是引起血压发生变化的主要因素之一。
临床研究揭示,肾脏分泌的PRA首先作用于肝脏合成的血管紧张素原,使血管紧张素原转变成为没有活性的AⅠ,它再由肺脏分泌的血管紧张素转换酶(ACE)的作用下,转化为具有极强生理活性的AⅡ和AⅢ,刺激肾上腺皮质分泌ALD。上述激素组成一个微系统(R-A-A-S),协调作用于心血管系统、泌尿系统和神经系统等,在维持机体血压和血容量平衡中起着非常重要的生理作用。生理状态下,血管紧张素对血容量和血压的调节几乎不起作用,只有在血容量和血压发生改变后(如失血、失液、休克等)才发生效应。目前尚未见复合麻醉颉颃剂对R-A-A-S影响的报道,推断可能是实验中小型猪注射小型猪特异性麻醉颉颃剂后血压迅速升高,血浆扩血管物质增加,从而对R-A-A-S造成了一定程度的影响。
3.2 小型猪特异性麻醉颉颃剂对小型猪血浆ANP的影响与血流动力学变化 本试验中,麻醉-催醒组小型猪肌肉注射颉颃剂后,血浆ANP的浓度呈现出先升高后降低的变化趋势,在麻醉后40min时与单纯麻醉组比较差异显著(P<0.05)。通过相关性分析发现:麻醉-催醒组小型猪注射颉颃剂后,小型猪血浆ANP的浓度与HR有极显著相关性(P<0.01),与SBP及DBP呈显著相关(P<0.05),与MAP没有相关性(P>0.05)。推断XFM麻醉后30分钟小型猪肌肉注射颉颃剂后,血浆中ANP浓度的变化参与了小型猪血流动力学变化的调节,是引起血压发生变化的主要因素之一。
在钠水负荷增加、血容量扩张、交感神经兴奋、心肌缺血缺氧、心肌作功增加等因素导致的心肌扩张、牵拉变形时可引起ANP分泌增加,有人称之为应激激素[7]。此外,HR增加,尽管心房牵张力无变化,也能引起ANP分泌,急性细胞外液容量扩张(摄入钠盐)也可以刺激ANP的分泌,在体液方面,血管紧张素、抗利尿素、肾上腺皮质激素、降钙素基因相关肽等均能促进ANP的释放[8-9]。ANP可能是一种保护心血管系统防止突然刺激激活肾上腺系统或R-A-AS引起血压波动的缓冲剂[8]。心钠素还能直接松弛血管平滑肌,降低血压并可对抗NE和AⅡ所致的缩血管效应[10]。本试验中小型猪特异性麻醉颉颃剂中的阿替美唑可使交感神经兴奋,NE释放增加,从而引起血压、HR迅速升高[11-12],推断小型猪特异性麻醉颉颃剂可能通过以上途径引起血浆ANP浓度的迅速升高,然后伴随血压的下降,血浆ANP的浓度也呈降低趋势。
表2 小型猪特异性麻醉颉颃剂对小型猪血浆R-A-A-S和ANP的影响 (n=7,±SD)
时相 组别 PRA AⅡ ALD ANP(min) (ng/mL·h) (pg/mL) (ng/mL) (ng/mL)A组0 B组A组5 B组A组10 B组A组20 B组A组30 B组A组32 B组A组35 B组A组40 B组0.92±0.22Aa 0.93±0.23Aa 1.36±0.34Aa 1.35±0.29Aa 1.90±0.33**Aa 1.91±0.30Aa 1.54±0.16*Aa 1.55±0.19Aa 1.15±0.31Aa 1.16±0.33Aa 0.93±0.26Aa 1.14±0.24Aa 0.81±0.23Aa 0.99±0.21Aa 0.69±0.19#Aa 0.93±0.20Aa 96.78±22.46Aa 97.13±19.67Aa 116.41±30.82Aa 117.38±26.73Aa 142.32±33.28*Aa 141.79±32.42Aa 134.49±22.13*Aa 136.27±26.61Aa 117.44±22.75Aa 119.57±25.77Aa 101.26±23.48Aa 116.38±22.46Aa 84.46±19.93Aa 110.32±18.98Aa 71.76±20.75#Aa 118.46±23.41Ba 205.41±37.42Aa 204.69±35.64Aa 268.43±50.16*Aa 267.45±48.51Aa 283.76±42.64*Aa 283.56±39.51Aa 226.49±31.79Aa 225.52±37.85Aa 194.16±37.67Aa 195.34±35.84Aa 179.39±23.25Aa 193.21±29.86Aa 166.61±35.46Aa 189.35±40.36Aa 148.36±29.16*Aa 195.32±32.15Aa 231.43±35.67Aa 232.54±36.57Aa 222.30±32.59Aa 223.69±37.52Aa 168.42±40.27*Aa 169.23±32.67Aa 183.76±39.64Aa 184.27±31.59Aa 205.41±42.37Aa 204.94±39.25Aa 234.37±43.54Aa 206.82±41.37Aa 268.79±37.21#Aa 212.62±38.92Aa 303.95±33.36*##Aa 221.49±34.29Ba A组60 B组A组90 B组A组120 B组0.81±0.16Aa 0.87±0.24Aa 0.93±0.12Aa 0.96±0.19Aa 1.01±0.24Aa 1.42±0.29Aa 84.42±21.42Aa 94.25±24.32Aa 94.42±29.46Aa 97.18±27.51Aa 105.24±23.16Aa 120.37±21.96Aa 161.49±27.53Aa 183.74±43.79Aa 199.42±24.73Aa 193.65±29.35Aa 213.48±39.92Aa 188.24±34.76Aa 272.43±43.75#Aa 241.85±44.72Aa 235.68±37.61Aa 263.46±35.29Aa 240.66±44.69Aa 248.62±37.37Aa
4 结论
研究麻醉药对血流动力学的作用机制是一个非常复杂的过程,麻醉下血流动力学变化是众多因素共同作用的结果,涉及内皮源性血管活性因子,肾素-血管紧张素-醛固酮系统及相关神经肽类等。因此通过研究R-A-A-S、ANP与血流动力学的相关性,进而从某一角度揭示XFM对小型猪血流动力学作用机制的影响。
[1] 周伟,孙德海,黄海波,等.腰麻-硬膜外联合麻醉对剖宫产母婴肾素-血管紧张素-醛固酮系统的影响[J].中华麻醉学杂志,2003,23(1):12-15.
[2] Benedetto U,Sciarretta S,Roscitano A,et al.Preoperative angio⁃tensin-converting enzyme inhibitors and acute kidney injury af⁃ter coronary artery bypass grafting[J].Ann Thorac Surg,2008,86(4):1160-1165.
[3] Gherardini G,Jernbeck J,Samuelson V,et al.Effect of calcito⁃nin gene-related peptide and lidocaine on mechanically-in⁃duced vasospasm in a rat island flap[J].Journal of Reconstruc⁃tiveMicrosurgery,1995,11(3):179-183.
[4] 沈通桃,傅诚章,刘存明,等.地氟醚、异氟醚和异丙酚对上腹部手术患者血浆内皮素和心钠素的影响[J].中华麻醉学杂志,2002,22(7):412-415.
[5] 姜胜,马昆,于世明,等.小型猪特异性麻醉颉颃剂对小型猪肝肾功能的影响[J].中国兽医杂志,2012,48(1);18-20.
[6] 姜胜,于世明,谭丽娟,等.小型猪特异性麻醉颉颃剂对小型猪血清一氧化氮一氧化氮合酶丙二醛超氧化物歧化酶的影响[J].中国兽医杂志,2012,48(8);6-8.
[7] 王进,施溥涛.心钠素的结构与功能的研究[J].生物化学与生物物理学报,1995,27(4):443-446.
[8] 文亮,毕敏.静注芬太尼对心钠素及肾素一血管紧张素系统的影响[J].临床麻醉学杂志,1994,10(5):254-255.
[9] Rahman SN,Kin G F,Mathew A S,et al.Effect of atrial natri⁃uretic peptide in clinical acute renal failure[J].Kidney Int,1994,45(6):1731-1738.
[10] 蒙翠凤.心钠素的研究进展[J].海峡药学,2006,18(5):4-6.
[11] Kinjavdekar P,Amarpal G R S,Pawde A M,et al.In fluence of yohimbine and atipamezole on haemodynamics and ECG after lumbosacral subarachnoid administration of medetomidine in goats[J].JVetMed A,2003,50(8):424-431.
[12] Penttila J,Kaila T,Helminen A,et al.Effects of atipamezole-a selective a2-adrenoceptor antagonist-on cardiac parasympathet⁃ic regulation in human subjects[J].Autonomic and Autacoid Phar⁃macology,2004,24(3):69-75.

