2014年高考电化学新题解析及备考启示(下)
孟凡盛


三、考查微粒的移动方向
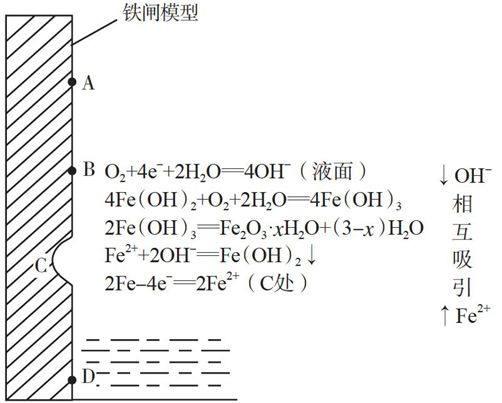
例4 (1)(2014年福建卷,24题节选)如图1是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
图1
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)(2014年新课标I卷,27题节选)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图2所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
图2
(已知:H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银)
①写出阳极的电极反应式 。
②分析产品室可得到H3PO2的原因 。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有 杂质,该杂质产生的原因是 。
【解析】(1)①海水(主要为氯化钠的稀溶液)是中性溶液,铁在中性溶液中发生吸氧腐蚀。②海水表面溶解的氧气最多,氧气得电子生成OH-;C处的铁失去电子生成Fe2+,可以想象为水面生成的OH-与C处生成的Fe2+相互吸引并结合生成Fe(OH)2,Fe(OH)2进一步被表面海水中溶解的氧化为Fe(OH)3, Fe(OH)3分解生成铁锈,故在靠近表面的B处生成的铁锈最多。各反应发生的大致区域如图3所示:
图3
(2)①电解稀硫酸的阳极是“放氧生酸”:2H2O-4e-O2↑+4H+。②电解NaOH稀溶液的阴极是“放氢生碱”:4H2O+4e-2H2↑+4OH-。阳极室不断生成的H+与原料室的H2PO2-相互吸引,H+穿过阳膜扩散至产品室,H2PO2-穿过阴膜扩散至产品室,二者结合生成弱电解质H3PO2。③“H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质”说明H3PO2及H2PO2-具有还原性。合并前后的不同在于:合并前H2PO2-没有与阳极接触,合并后具有还原性的H2PO2-与阳极接触放电(失去电子)被氧化为PO43-。
【答案】(1)①吸氧腐蚀 ②B (2)①2H2O- 4e- O2↑+4H+ ②阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2 ③PO43- H2PO2-或H3PO2被氧化
【备考启示】(1)“阴阳相吸”是很多化学反应的微观基础,阴阳相吸的含义有:①阴离子与阳离子相互吸引并发生迁移;②阴极吸引电解质溶液中的阳离子,阳极吸引电解质溶液中的阴离子,并使阳离子、阴离子发生定向移动;③正极吸引自由电子,使电子经过金属导线由负极定向移动到正极。(2)考生要有丰富的微观想象能力,铁锈主要不在正极或负极处形成,而主要在正、负极之间产生,因为Fe(OH)2在正、负极之间形成,Fe(OH)2继续与溶解的O2(靠近水面溶解的O2多)反应生成Fe(OH)3,Fe(OH)3脱去一部分水才生成铁锈,因此铁锈主要是在有O2的区域形成。复习备考归根到底是要对教材知识有深刻的理解!
四、考查对比分析的能力
例5 (2014年天津卷,7题节选)已知:
化合物 MgO Al2O3 MgCl2 AlCl3
类型 离子化合物 离子化合物 离子化合物 共价化合物
熔点/℃ 2800 2050 714 191
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
【解析】氧化镁和氯化镁都是离子化合物,在熔融状态下电解均能制备金属镁,但氧化镁的熔点(2800℃)比氯化镁的熔点(714℃)高得多,因此电解熔融氧化镁制备金属镁比电解熔融的氯化镁制备金属镁能耗要大得多,生产成本也高得多。氧化铝是离子化合物,氯化铝是共价化合物,熔融状态下氧化铝能导电而氯化铝却不能导电,因此只能选择电解氧化铝制铝而不能选择电解氯化铝制铝。
【答案】MgO的熔点高,熔融时耗费更多能源,增加生产成本 AlCl3是共价化合物,熔融态难导电
【备考启示】(1)复习过程中,要善于思考、发现异同,利用结构、性质上的不同来解释应用上的差别。(2)实际工业生产中用冰晶石(Na3AlF6)降低氧化铝的熔点,从而降低生产成本。(3)纯净的熔融氯化铝不导电,但我们可以设想,如果找到某种物质与熔融态的氯化铝形成的液态混合物能导电,那么电解熔融氯化铝就能制备金属铝。事实上,工业上已有用电解AlCl3-NaCl-KCl的熔融盐混合物的方法制备金属铝,其能耗比电解氧化铝与冰晶石的熔融混合物更低。
五、考查复杂装置的判断
例6 (2014年广东卷,11题)某同学组装了如图4所示的电化学装置。电极I为Al,其他电极均为Cu,则( )
A.电流方向:电极IV→→电极I
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-Cu
图4
【解析】本题考查考生的观察理解能力。前两个烧杯中有盐桥,很容易让考生联想到盐桥电池,若将Ⅱ和Ⅲ、Ⅰ和Ⅳ断开,把Ⅰ和Ⅱ连接起来,就是总反应为2Al+3CuSO4Al2(SO4)3+3Cu的盐桥电池,如图5所示:
图5
第三个烧杯中是两个铜电极插入硫酸铜溶液中,应该联想到铜的电解精炼装置:盐桥电池的负极铝与铜电极Ⅳ相连,铜电极Ⅳ作电解池的阴极;盐桥电池的正极与铜电极Ⅲ相连,铜电极Ⅲ作电解池的阳极。至此,考生可在图上标明,如图6所示:
图6
参照图6,根据电化学的基础知识可以顺利得出结论。电流方向与电子方向相反,即电极Ⅳ经电流计到电极Ⅰ,A正确。电池负极是还原剂,失去电子发生氧化反应,B错误。电极Ⅱ是正极,电解质溶液中的铜离子不断得到电子并在电极表面析出铜,电极II逐渐变粗,C错误。电极Ⅲ是铜作活泼阳极,失去电子被氧化:Cu-2e-Cu2+,D错误。
【答案】A
【备考启示】(1)利用原电池作为电解池的电源,创设比较复杂的情景,考查考生的观察理解能力,这种命题方式应引起考生的重视。(2)盐桥电池的构造是:还原剂与氧化产物在一起构成电池的负极区,氧化剂与还原产物在一起构成电池的正极区,负极区与正极区通过盐桥相连。理解并牢记盐桥电池的优点:可以避免氧化剂与还原剂(如本题中的铜离子和铝)的接触,从而避免能量损失,提高电池效率,提供稳定的电流。
六、考查电化学计算
例7 (2014年重庆卷,11题节选)一定条件下,如图7所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________。
③该储氢装置的电流效率η= 。
(η=×100%,计算结果
保留小数点后1位)
图7
【解析】①仔细观察装置图可以发现:电解池左边D电极上发生的反应是苯加氢还原。根据电解池中电极名称的规定知:发生还原反应的D电极是阴极,即电子流入的电极,故导线中电子移动方向为A→D。②该电解池的目的是为了储氢,故目标产物为环己烷,其电极反应式为C6H6+6H++6e-C6H12。③阳极生成的H+经过高分子电解质膜移动至阴极,一部分H+与苯一起得电子生成环己烷,还有一部分H+ 得电子生成H2(2H++2e-H2↑,阴极的副反应),左边(阴极区)出来的混合气体成分为未反应的苯(g)和生成的环己烷(g)、H2,设未反应的苯蒸气物质的量为x,生成的氢气的物质的量为y,阴极生成的气态环己烷为(2.4-x)mol,得到电子6(2.4-x)mol,阴极生成
y mol H2得到电子2y mol,阳极(E极)的电极反应式为2H2O-4e-O2↑+4H+,生成2.8 mol O2失去电子物质的量为4×2.8 mol=11.2 mol,根据得失电子守恒有6(2.4-x) mol+2y mol=11.2 mol;阴极出来的混合气体中苯蒸气的物质的量分数为x÷(10+y)= 0.1;联解得x=1.2 mol,电流效率为6×(2.4-1.2)÷ 11.2×100%=64.3%。
【答案】①A→D ②C6H6+6H++6e-C6H12 ③64.3%
【备考启示】“定量计算进入化学意味着化学的成熟”“将化学问题抽象成数学问题是思维的飞跃”等观点是命题专家的共识。要加强复习备考的针对性就应重视通过计算和推理解决实际化学计算题。
Q博士课后作业参考答案:
(Ⅰ)λ =± 1.
(Ⅱ)证明:由已知,λ > 0,x1=x2及y1=y2=2,可得xn> 0,yn> 0,由不等式的性质,有≥λ≥λ2≥…≥
λn-1= λn-1;另一方面,=λ=λ2=…=λn-1=
λn-1,故 ≥λn-1=(n=N*),即≤(n=N*).

