细胞因子检测在急性胰腺炎患者中的临床意义*
王绪山,陈胜全,杨全德,刘景宏,王彪(江苏省连云港市灌云人民医院:.检验科;.外5科 00)
急性胰腺炎(AP)是消化系统常见的急腹症之一,其病因复杂,病情严重程度差异悬殊,并发症多。临床上将AP 分为轻症急性胰腺炎(MAP)及重症急性胰腺炎(SAP);其中MAP具有自限性,预后良好[1];而SAP 的发病率逐年上升,临床过程凶险,病死率可高达15%~20%[2]。AP 发病机制复杂,至今仍未完全阐明。近年来研究发现,不同程度的全身性炎性反应可导致细胞因子的表达异常,促进AP的发生、发展及MAP向SAP的演变。本研究对58例AP 患者血清中炎性细胞因子——白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)进行检测,并与急性生理和慢性健康评估(APACHEⅡ)评分和CT 严重度指数(CTSI)进行比较,探讨其在AP中的临床价值。
1 资料与方法
1.1 一般资料选取2010年1月至2013年1月于本院住院治疗的AP患者58例,所有患者在症状出现后24h内入院。结合患者临床症状、体征、实验室指标、CT 检查结果。按中国急性胰腺炎诊治指南(草案)中的重症胰腺炎判断标准[3],排除原发性肝、胆、胰腺疾病,以及糖尿病、高血压、肿瘤及自身免疫性疾病者。将58例患者分为两组,MAP组39例,其中男26例、女13例,平均年龄(48.7±9.1)岁;SAP组19例,其中男13例、女6例,平均年龄(51.1±9.6)岁。另选取本院体检中心体检合格的健康人31例为健康对照组,其中男20例、女11例,平均年龄(48.1±7.9)岁。各组在性别、年龄上比较,差异均无统计学意义(P>0.05),具有可比性。本研究符合医学伦理学标准,并经本院医学伦理学委员会同意,所有检测均经患者或家属知情同意。
1.2 研究方法所有患者均于入院第1、3、7天,采集静脉血5mL,37℃水浴30min后,相对离心力(RCF)1600×g离心10min,留取血清分装密封于-70℃冰箱保存,以备检测。血清IL-1测定采用酶联免疫吸附试验(ELISA),试剂盒购自美国R&D 公司,严格按说明书进行操作,使用芬兰Labsystems MK3型的酶标仪检测。血清IL-6、TNF-α测定采用化学发光法,于西门子DPC 1000全自动化学发光免疫分析仪上进行检测。并在入院后第1、3、7天动态检测APACHEⅡ评分和CTSI。
1.3 统计学处理采用SPSS17.0统计学软件进行数据分析;计量资料以表示,组间比较采用方差分析,各指标的相关性检测采用Pearson′s相关分析法;以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 3组血清各细胞因子水平、APACHEⅡ评分及CTSI比较 MAP与SAP组患者血清IL-1、IL-6及TNF-α水平明显高于健康对照组,差异具有统计学意义(P<0.01);且SAP组患者血清IL-1、IL-6及TNF-α水平明显高于同期MAP组,差异具有统计学意义(P<0.01)。SAP组患者第3天血清IL-1、IL-6及TNF-α水平略高于第1天,但差异无统计学意义(P>0.05);第7天明显下降,与同组前两次检测结果相比较,差异均有统计学意义(P<0.01)。MAP组患者入院第1、3、7天血清IL-1、IL-6及TNF-α水平逐渐下降,差异具有统计学意义(P<0.01);第7天基本恢复正常,且与健康对照组比较差异无统计学意义(P>0.05)。SAP组患者APACHEⅡ评分及CTSI明显高于MAP组,且入院第3天较第1天有明显升高,差异均有统计学意义(P<0.01);入院第7天略有下降,但与第3天比较差异无统计学意义(P>0.05)。而MAP组患者入院第3、7天较第1天APACHEⅡ评分及CTSI有一定的升高,差异均有统计学意义(P<0.01);但第3天与第7天比较差异无统计学意义(P>0.05)。见表1。
表1 3组血清IL-1、IL-6、TNF-α水平、APACHEⅡ评分及CTSI比较()

表1 3组血清IL-1、IL-6、TNF-α水平、APACHEⅡ评分及CTSI比较()
注:-表示无数据。
2.2 2组患者入院第3天患者血清各细胞因子水平与APACHEⅡ评分及CTSI的相关性分析入院第3天可见MAP与SAP组患者血清IL-1、IL-6及TNF-α水平与APACHEⅡ评分及CTSI均呈正相关(P<0.01),且SAP组患者血清IL-1、IL-6及TNF-α水平与APACHEⅡ评分及CTSI的相关性更为显著。见表2。
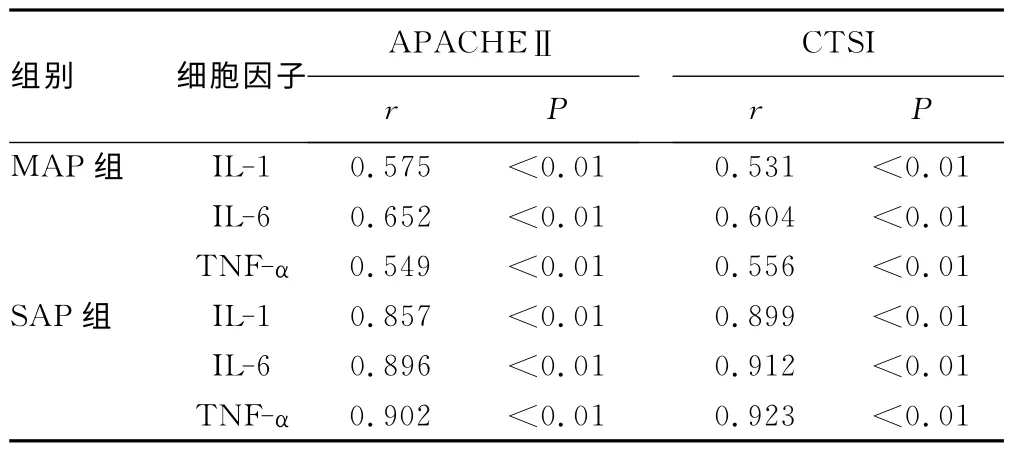
表2 2组患者血清中IL-1、IL-6及TNF-α水平与APACHEⅡ评分及CTSI的相关性比较
3 讨论
AP 是一种起病急,病情发展快的全身性炎性反应疾病[4]。在炎症过程中TNF-α在局部组织中出现较早,并迅速达到高峰,从而诱发“次级”细胞因子IL-1及IL-6的生成,促进IL-1及IL-6合成和释放[5]。研究发现,TNF-α升高的程度与胰腺损伤及炎症程度直接相关[6]。因此,TNF-α成为AP发病后反映其严重程度的重要早期指标。IL-1在正常胰腺实质中仅有少量表达,在低浓度时可上调免疫功能,但高浓度时可导致多种炎性损伤,诱导TNF-α、IL-6及其自身的分泌。IL-6在急性胰腺炎尤其在重症或伴有复杂并发症的患者中明显升高,并与急性胰腺炎严重程度密切相关[7]。
本研究显示,MAP组患者入院第1天血清IL-1、IL-6及TNF-α水平明显高于健康对照组,在入院第3、7天水平持续下降,直至与健康对照组比较差异无统计学意义(P>0.05)。说明MAP组患者在有效的临床治疗及自身抗炎细胞因子的作用下急性炎症得到控制,相关的促炎细胞因子水平开始下降,与相关文献报道路一致[8]。SAP组患者入院第1天血清中IL-1、IL-6及TNF-α水平显著增高,直至第3天仍持续升高,提示SAP患者随着AP病情进一步加重,单核巨噬细胞系统被激活,产生大量细胞因子,从而增加了促炎因子的产生,导致促炎细胞因子的“级联瀑布反应”,加重了SAP 患者的炎性反应。SAP组患者入院第7天血清IL-1、IL-6及TNF-α水平较前显著下降,提示促炎细胞因子和抗炎细胞因子在消耗和产生中达到近似动态平衡,病情开始好转,与临床治疗中SAP的病情好转相符。但SAP组患者入院第7天血清IL-1、IL-6及TNF-α水平仍明显高于MAP组和健康对照组,提示病情仍未得到完全控制,全身性炎性反应仍未完全缓解。上述实验结果表明,动态检测血清IL-1、IL-6及TNF-α水平可以进行有效的病情观察,有利于判断预后。
目前,对AP的诊断及病情评估方法较多。因CT 检查比较简单,成为确诊AP和判断预后的首选检查方法,在临床上应用甚广。但需要注意的是,AP 的影像学表现与临床表现相比,存在一定的时间滞后性,而且对SAP组的检查也不方便[9]。APACHEⅡ评分标准根据临床表现来预测AP的严重程度,不受患者入院后的时间限制,可重复检测评分,连续观察,是目前仍然公认的AP 严重度的评估指标之一,但临床上收集完整指标比较困难[10]。检测患者血清IL-1、IL-6及TNFα水平不受时间、病情的限制,可以进行动态观察,具有方便快捷的特点。本研究显示,患者入院第3天,血清中IL-1、IL-6及TNF-α水平与APACHEⅡ评分及CTSI呈正相关,提示血清中IL-1、IL-6及TNF-α水平与病情严重程度、胰腺病变之间存在密切联系。SAP组患者血清IL-1、IL-6及TNF-α水平与APACHEⅡ评分及CTSI高度相关,提示血清中细胞因子检测对SAP患者的病情评估具有参考价值。APACHEⅡ评分及CTSI在MAP与SAP组具有明显差异,考虑由于两型AP 的病因、病理过程不尽相同,其后期对机体的全身及局部影响差别依然显著,也提示检测细胞因子水平有助于诊断及病情评估。
有研究认为,促炎-抗炎细胞因子二者之间存在动态平衡,二者的作用结果决定了胰腺炎的转归[11]。治疗SAP 的重点在于快速使二者达到低水平的动态平衡。目前,对于AP的发病机制,细胞因子网络是如何互相作用并推动胰腺炎临床病程演进的详细机制尚未完全阐明。细胞因子在胰腺组织损伤,远隔器官并发症产生中的详尽作用也不十分清楚。对胰腺微循环障碍、炎性介质和细胞因子作用等发病机制进行深入研究,能够尽早阻断全身炎症反应综合征的发展,预防多器官功能衰竭综合征的发生,并为免疫调节治疗奠定基础。
综上所述,AP病情变化迅速,及时、准确的判断病情和合理的治疗是改善预后的关键。检测AP 患者血清细胞因子水平,有助于从AP的发病机制入手,具有一定的前瞻性。而APACHEⅡ评分及CTSI可以动态观察患者病情及其在治疗过程中的变化。联合检测可更有效地确定和判断AP 的炎症程度及治疗方法的有效性,从而更好地对AP患者进行病情风险预测,为各病理时期的相应“个体化”治疗提供指导性的帮助,提高患者的生存率。
[1]王春亭,曲鑫.重症急性胰腺炎的诊治进展[J].中华急诊医学杂志,2012,21(10):1080-1083.
[2]Hong W,Dong L,Huang Q,et a1.Prediction of severe acute pancreatitis using classification and regression tree analysis[J].Dig Dis Sci,2011,56(12):3664-3671.
[3]中华医学会消化病学会胰腺疾病学组.重症急性胰腺炎内科规范治疗建议[J].中华消化杂志,2009,29(2):75-78.
[4]Koussouals V,Tzivras M,Karaqianni V,et al.Monocytes in systematic inflammatory response syndrome:differences between sepsis and acute pancreatitis[J].World J Gastroenterol,2006,12(41):6711-6714.
[5]Mori T,Miyamoto T,Yoshida H,et al.IL-1βand TNF-αinitiated IL-6-STAT3pathway is critical in mediating inflammatory cytokines and RANKL expression in inflammatory arthritis[J].Int Immunol,2011,23(11):701-712.
[6]孟杰,张静静.白细胞介素质-6、白细胞介素质-10、肿瘤坏死因子-α在不同时期胰腺炎的表达和临床意义[J].中国医药导报,2013,10(19):71-75.
[7]王要军,葛文松.TNF-α、IL-6、TPA 与急性胰腺炎严重程度的相关性[J].国误诊学杂志,2009,9(6):1261-1262.
[8]Gunjaca I,Zunic J,Gunjaca M,et a1.Circulating Cytokine Levels in Acute Pancreatitis-Model of SIRS/CARS Can Help in the Clinical Assessment of Disease Severity[J].Inflammation,2012,35(2):758-763.
[9]曹友红,孔文涛,王小平,等.降钙素原、CRP联合Balthazar分级对急性胰腺炎患者临床风险预测的意义[J].新医学,2013,44(9):626-628.
[10]邹金艳,林军,易三凤,等.BISAP、Ranson's、APACHEⅡ和CTSI评分系统在急性胰腺炎评估中的价值[J].中华消化外科杂志,2014,13(1):39-43.
[11]杨健鹰,方茂勇,徐周纬,等.血清IL-1β、IL-6及IL-10对急性胰腺炎预后判断的研究[J].安徽医药杂志,2013,17(7):1185-1187.

