充血性心力衰竭患者血清抗碳酸酐酶Ⅱ和Ⅲ自身抗体检测的意义
刘辰庚, 夏 鸣, 王金玲, 李 蕾, 王培昌
(1.首都医科大学宣武医院检验科,北京 100053;2.闵行区中心医院检验科,上海 201100)
累积的研究表明,自身抗体不仅出现在传统意义上的自身免疫病患者体内,也可见于心脏疾病、糖尿病等多种类型的疾病[1-2]。有研究认为,细胞内蛋白的漏出可能是其自身抗体产生的原因之一[2]。我们前期研究结果表明,缺氧状态下培养的心肌细胞其碳酸酐酶漏出量升高[3],本研究拟利用酶联免疫吸附试验(anzyme-linked immunosorbent assay,ELISA)对在近3个月~1年内曾发生心肌梗死的充血性心力衰竭(congestive heart failure,CHF)患者血清中的抗碳酸酐酶Ⅱ和Ⅲ自身抗体、超氧化物歧化酶(super-oxide dismutase,SOD)等5种抗氧化物水平,白细胞介素2(inter-leukin 2,IL-2)等5种细胞因子的水平以及红细胞沉降率(erythrocyte sedimentation rate,ESR)进行检测和临床意义的初步评价。
材料和方法
一、临床资料
收集宣武医院2011年5月至2012年6月的CHF患者共58例(符合世界卫生组织 /国际心脏病学会诊断标准),其中男39例,女19例,平均年龄(65.8±7.6)岁。另随机选取58名健康受试者为对照组,其中男39名,女19名,平均年龄(66.3±8.1)岁。受试者于上午空腹分别使用促凝采血管和ESR管空腹抽取静脉血,抽血后立即进行ESR检测,促凝采血管中的标本经分离后将血清保存于-80℃备用。
二、抗碳酸酐酶Ⅱ和Ⅲ自身抗体ELISA检测
稀释碳酸酐酶 Ⅱ和Ⅲ(Sigma)至5μg/mL;包被的酶标板用保鲜膜封好,置4℃过夜;使用洗涤液缓冲液清洗5次,每孔加入封阻液,于室温下放置30 min,洗板3次;每孔加入100μL稀释后的血清标本(碳酸酐酶Ⅱ测定为1∶150稀释,碳酸酐酶Ⅲ测定为1∶100稀释),37℃放置30 min,洗板3次;每孔加入封闭缓冲液稀释的二抗100μL(Santa cruz),37℃放置30 min;每孔加入100μL底物缓冲溶液(KPL),37℃避光反应30 min;每孔加入25μL终止液(KPL),读取波长450 nm 处(参考波长630 nm)吸光度(A)值[4]。
三、其他指标的测定
SOD使用英国朗道公司的试剂在日立7600生化分析仪上进行测定,测定前先进行定标和质控操作。过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、总抗氧化能力(total antioxidant capacity,TAC)、丙二醛(methanedicarboxylic aldehyde,MDA)使用 BioVision公司试剂,IL-2、白细胞介素6(interleukin 6,IL-6)、白细胞介素17(interleukin17,IL-17)、肿瘤坏死因子 α(tumor nerosis factor-aplha,TNF-α)和γ 干扰素(interferon-garmma,IFN-γ)使用 R&D 公司ELISA试剂。以上检测项目均严格按照试剂盒说明书进行操作。
四、统计学方法
采用SPSS13.0统计软件进行t检验和直线相关分析,以P<0.05为差异有统计学意义。
结 果
CHF患者血清抗碳酸酐酶Ⅱ自身抗体水平显著高于对照组(P<0.05),抗碳酸酐酶Ⅲ自身抗体水平与对照组差异无统计学意义(P>0.05),见表1;CHF患者ESR水平显著高于对照组(P<0.05),但CHF患者ESR检测结果与血清抗碳酸酐酶Ⅱ自身抗体水平不具有相关性(r=0.39,P> 0.05);CHF 患者的 SOD、GPx、CAT和TAC水平显著低于对照组(P<0.05),MDA水平高于对照组(P<0.05),见表2;CHF患者血清的IL-2和IL-17水平较对照组显著升高(P<0.05),IL-6、TNF-α和IFN-γ水平与对照组差异无统计学意义(P>0.05),见表3。
表1 CHF患者和对照组抗碳酸酐酶Ⅱ和Ⅲ自身抗体及ESR水平比较(±s)
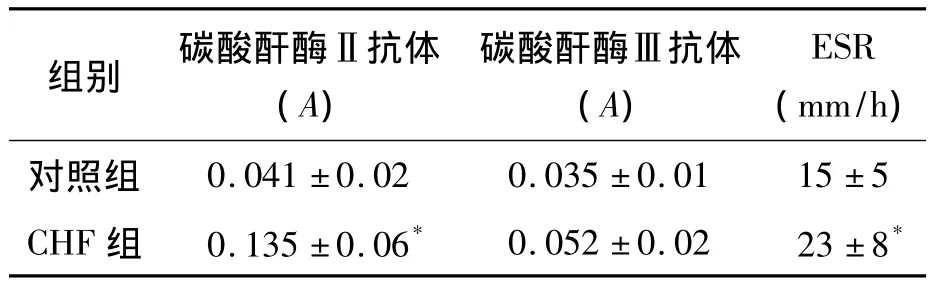
表1 CHF患者和对照组抗碳酸酐酶Ⅱ和Ⅲ自身抗体及ESR水平比较(±s)
注:与对照组比较,*P<0.05
组别 碳酸酐酶Ⅱ抗体(A)碳酸酐酶Ⅲ抗体(A)ESR(mm/h)对照组0.041±0.02 0.035±0.01 15±5 CHF 组 0.135±0.06* 0.052±0.02 23±8*
表2 CHF患者和对照组抗氧化物活性及MDA水平比较(±s)

表2 CHF患者和对照组抗氧化物活性及MDA水平比较(±s)
注:与对照组比较,*P<0.05
CHF 组 123.8±21.9* 139.3±41.1* 1.1±0.3* 12.3±3.3* 4.7±1.1*
表3 CHF患者和对照组细胞因子水平比较(±s,ng/L)

表3 CHF患者和对照组细胞因子水平比较(±s,ng/L)
注:与对照组比较,*P<0.05
CHF 组 3.34±1.35* 1.51±0.49 2.98±0.73*14.02±3.31 12.17±4.73
讨 论
碳酸酐酶(EC 4.2.1.1)是一族含锌的金属蛋白酶,也是最重要的含锌金属酶之一,其主要功能是催化二氧化碳的水合和碳酸的水解,对二氧化碳的运输、水电解质和酸碱平衡调节以及细胞内、外电势差的形成有重要作用。目前至少已经发现15种不同类型的碳酸酐酶同工酶,其中碳酸酐酶Ⅲ和Ⅳ的活性相对较强[5]。他们广泛分布于人体多种组织器官中,与青光眼、骨质疏松症、癌症等多种病理生理过程密切相关。碳酸酐酶Ⅱ在脑组织、肾脏和肌肉组织中含量较高,碳酸酐酶Ⅲ主要存在于脂肪组织、肝脏、心肌和慢骨骼肌纤维中。碳酸酐酶Ⅱ、Ⅲ和Ⅳ自身抗体已经分别在系统性红斑狼疮、类风湿性关节炎和1型糖尿病患者体内中被检测到[6-7]。目前至少已发现了17种与心肌组织相关的自身抗体,包括钠泵、钙泵等与心肌细胞功能密切相关功能蛋白的自身抗体[2]。有学者认为自身抗原长期缓慢暴露是其自身抗体产生的原因之一[1-2]。免疫反应和免疫抑制的平衡受多种因素的影响和控制,其中抗氧化活性和细胞因子的改变起到了很大的作用,虽然目前尚无实验证明这些心肌细胞相关自身抗体是否能造成相关功能蛋白质的功能障碍或影响心肌细胞的正常生理活动,但自身抗体的出现至少标志着免疫反应和免疫抑制的平衡被打破[8]。本课题组的前期研究表明,缺氧状态下的心肌细胞会漏出大量的碳酸酐酶Ⅳ到培养基中,从而导致培养基中的碳酸酐酶Ⅳ水平显著升高[3],而人体内各项抗氧化能力指标的异常可能参与诱导了自身抗体的产生[7]。碳酸酐酶Ⅱ与Ⅳ具有相似的相对分子质量和空间构象,故在同样的心肌细胞损伤情况下,碳酸酐酶Ⅱ和Ⅲ的漏出比例应该与碳酸酐酶Ⅳ相当。由此我们推测,CHF患者碳酸酐酶Ⅱ的长期暴露可能是其自身抗体产生的原因。有研究表明,碳酸酐酶可以减轻氧化应激给机体带来的损伤,同时其具有的酪氨酸磷酸酶活性对心肌细胞离子通道的活性也具有调节作用[9]。有研究表明,碳酸酐酶自身抗体能够有效地抑制碳酸酐酶的总活性[4],故CHF患者血清碳酸酐酶Ⅱ自身抗体如能通过吞噬小泡进入心肌细胞内部,也可能对心肌细胞的正常生理功能产生影响。虽然不能仅由一种或几种自身抗体的检出而把某种疾病划归为自身免疫病,但自身抗体的产生和滴度的变化可以作为疾病活动性的监测和风险预测的指标,应对其进行深入研究[10]。本研究表明,ESR水平与抗碳酸酐酶Ⅱ和Ⅳ自身抗体滴度之间无相关性,目前已有多位学者进行了ESR测定与不同种类自身抗体之间相关性的研究[11-12],虽然其相关系数大都未超过 0.85,但ESR测定值的高、低能反应自身抗体水平的变化已经得到了越来越多的证实,值得研究者投入更多的精力。
细胞因子的改变与自身免疫反应的水平和强度也存在联系,本研究结果表明 CHF患者的IL-6、IFN-α和 IFN-γ 水平差异无统计学意义,但IL-2和IL-17水平显著升高,这与之前一些研究的结果略有不同,其原因可能与本研究入组人群的平均年龄较低,从而因年龄自然增加所导致的自身免疫反应较弱有关[7,13]。抗炎细胞因子和促炎细胞因子的平衡是维持人体内正常免疫反应的前提之一[14],IL-2和IFN-α为同时具有抗炎和促炎作用的细胞因子,故CHF患者血清IL-2水平的升高对抗碳酸酐酶Ⅳ自身抗体的产生究竟起到何种作用还需进一步的证实。
[1 ]Martínez-Borra J,López-Larrea C.Autophagy and self-defense[J].Adv Exp Med Biol,2012,738:169-184.
[2]Kaya Z,Leib C,Katus HA.Autoantibodies in heart failure and cardiac dysfunction[J].Circ Res,2012,110(1):145-158.
[3]刘辰庚,王培昌.缺氧状态下雌二醇对H9c2细胞碳酸酐酶Ⅳ表达的影响[J].医学研究杂志,2012,41(9):86-88.
[4]Liu C,Wei Y,Wang J,etal.Carbonic anhydrasesⅢ and Ⅳ autoantibodies in rheumatoid arthritis,systemic lupus erythematosus,diabetes,hypertensive renal disease,and heart failure[J].Clin Dev Immunol,2012,2012:354594.
[5]Supuran CT.Carbonic anhydrase inhibitors and activators for novel therapeutic applications[J].Future Med Chem,2011,3(9):1165-1180.
[6]Hosoda H,Okawa-Takatsuji M,Shinmura W,etal.Potential for differential diagnosis of autoimmune pancreatitis and pancreatic cancer using carbonic anhydrase Ⅱ antibody[J].Pancreas,2008,37(1):e1-e7.
[7]Sánchez-Castañón M,de las Heras-Castaño G,López-Hoyos M.Autoimmune pancreatitis:an underdiagnosed autoimmune disease with clinical,imaging and serological features[J].Autoimmun Rev,2010,9(4):237-240.
[8]Biswas UK,Kumar A.Study on the changes of carbonic anhydrase activity in insulin resistance and the effect of methylglyoxal[J].J Pak Med Assoc,2012,62(5):417-421.
[9]Yamada H.Current perspectives on the role of IL-17 in autoimmune disease[J].J Inflamm Res,2010,3:33-44.
[10]仲人前.应提倡自身免疫性疾病实验室诊断研究的原创性和实用性[J].检验医学,2006,21(2):89-90.
[11]Li W,Wang W,Sun S,etal.Autoantibodies against the catalytic domain of BRAF are not specific serum markers for rheumatoid arthritis[J].PLoS One,2011,6(12):e28975.
[12]Zimmerman UJ,Wang P,Zhang X,etal.Anti-oxidative response of carbonic anhydraseⅢin skeletal muscle[J].IUBMB Life,2004,56(6):343-347.
[13]Soares SR,Martínez-Varea A,Hidalgo-Mora JJ,etal.Pharmacologic therapies in endometriosis:a systematic review [J].Fertil Steril,2012,98(3):529-555.
[14]Tayal V,Kalra BS.Cytokines and anti-cytokines as therapeutics--an update[J].Eur JPharmacol,2008,579(1-3):1-12.

