复合诱变选育高产虾青素的红法夫酵母菌株*
胡向东,潘玲燕,章祺,叶茂,梁新乐
1(浙江皇冠科技有限公司,浙江 杭州,310012)
2(浙江工商大学食品与生物工程学院,浙江杭州,310018)
虾青素(astaxanthin)为 3,3-二羟基-4,4-二酮基-β,β-胡萝卜素,是一种酮式类胡萝卜素,为艳丽红色,具脂溶性,广泛应用于水产养殖,可使水产动物呈现鲜艳的颜色,以更具观赏性[1];另外虾青素具有极强的生物抗氧化性、促进机体抗体产生、增强免疫力以及抗紫外线辐射等作用[2]。因而在食品添加剂、水产养殖、化妆品、保健品和医药工业方面有广阔的应用前景[3-6]。
红法夫酵母作为虾青素的主要生物来源之一,具有能利用多种糖类进行异养代谢、生长速度快、培养时间短、不需要光照、能够在发酵罐中高密度培养等优点[7]。但野生型红法夫酵母因其虾青素产量低,每克干酵母仅产生约500 μg类胡萝卜素,而产虾青素仅为350 μg,无法满足市场需求,为提高其虾青素产量,一个重要的方法是进行诱变育种。UV诱变是常用的物理诱变方法,但是单纯的紫外诱变效果不理想,因此国内外学者对此进行了大量研究,采用UV-亚硝基胍 (NTG)协同诱变[8]、LiCl-UV和NTG复合诱变[9]、UV-NTG 和60Co-γ 射线复合诱变[10]等诱变方法对红法夫酵母菌株进行诱变,提高虾青素的产量。本文首先对红法夫酵母菌株进行UV-LiCl复合诱变处理以筛选高产菌株,再对其用60Co-γ射线诱变处理,筛选若干高产菌株后再进行一轮UV-LiCl复合诱变和60Co-γ射线诱变处理,从而选育出高产虾青素且具有稳定性遗传的酵母菌株,命名为HSC-125。
1 材料与方法
1.1 材料
1.1.1 菌株
亲本菌株为红法夫酵母(P.rhodozyma)02,由浙江工商大学食品与生物工程学院保藏,由梁新乐(浙江杭州)赠送,于-80℃下保存于含有30%的甘油内。
1.1.2 培养基
YM培养基(g/L):10.0葡萄糖,5.0缩酵母浸出粉,5.0蛋白胨,pH 5.4。若为固体培养基需加入2.5%琼脂粉。
YM-二苯胺选择性培养基:待YM培养基冷却至50℃时加入一定量的无菌二苯胺溶液。
摇瓶发酵培养基(g/L):20.0葡萄糖,5.0蛋白胨,5.0 浓缩酵母浸出粉,3.0(NH4)2SO4,0.5 MgSO4·7H2O,1.5 KH2PO4,0.1 CaCl2·2H2O,pH 5.4。
1.2 培养及分析方法
1.2.1 菌种活化
从-80℃保藏的菌悬液或YM斜面上取1环至装有30 mL新鲜YM液体培养基的250 mL锥形瓶中。22℃、220 r/min培养36~48 h后,稀释10-6涂布于YM平板,置于22℃培养箱培养3~5 d。挑取颜色深红且较大菌落于斜面,置于22℃培养3~5 d。
1.2.2 种子培养
挑取斜面上的活化菌至装有30 mL种子培养基的250 mL锥形瓶,置于22℃、220 r/min的恒温摇床,培养36~48 h。
1.2.3 摇瓶发酵培养
取种子培养液,按10%(v/v)接种量接入装有30 mL液体发酵培养基的250 mL锥形瓶中,置于22℃、220 r/min的恒温摇床,培养72 h。
1.2.4 虾青素含量的测定
采用紫外分光光度测定法[11]。取5 mL发酵液于5 000 r/min下离心10 min,去离子水洗涤2次,收集菌体,加入1 mL 55℃预热的二甲亚砜 (DMSO),振荡悬浮,加入丙酮4 mL,漩涡振荡20~30 s,最后4℃,5 000 r/min离心10 min,上清液用分光光度计测OD474。如菌泥仍有色可重复抽提至白色为止,虾青素含量计算:
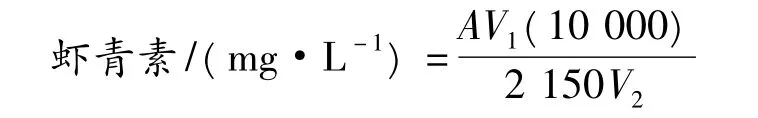
式中:A,OD474mm值;V1,有机溶剂的总体积,mL;2 150,比消光系数;V2,发酵液体积,mL;100,单位换算后的作数,mg/L。
1.2.5 菌体生物量的测定
取5 mL菌悬液,5 000 r/min离心10 min,弃上清液,菌体用去离子水洗2次,在烘箱中于105℃烘至恒重,然后称重。
1.3 诱变方法
1.3.1 二苯胺抗性浓度的确定
将对数期的出发菌株P.rhodozyma 02菌液用无菌生理盐水稀释不同梯度浓度:106、105、104、103、102/mL,分别取3 μL菌悬液点样到含二苯胺(二苯胺浓度分别为 0、10、20、40、60、80、100 μmol/L)的抗性平板。22℃培养5~7 d,观察不同平板上菌落的生长情况及菌落颜色变化,颜色由红到浅黄直到无色,即为二苯胺对该菌的最小抑制浓度(MIC)。
1.3.2 UV-LiCl复合诱变育种
将对数期的出发菌株菌液用无菌生理盐水稀释到106/mL,然后各取5 mL菌悬液于带磁力转子的培养皿中,各加入300 μL 10%LiCl混匀后开盖进行紫外线照射。在30 cm,15 W 下紫外线光照1、3、5、7、9、12、15、20 min。将经过不同时间照射后的菌液黑暗处理稀释10-3倍,涂布于已确定的二苯胺最适浓度平板上,在22℃恒温培养箱中暗培养5~7 d。以未经诱变的菌悬液同样操作作为对照,计算致死率。从平板上筛选颜色较红,菌落较大的菌株进行摇瓶复筛,检测各菌株生物量和虾青素产量,筛选较好的菌株进行60Co-γ射线诱变育种。
1.3.360Co-γ射线诱变育种
将UV-LiCl复合诱变筛选到的高产菌株培养至对数期,菌悬液浓度稀释至106/mL,进行60Co-γ射线处理,照射剂量为 2、3、3.5、4、4.5、5 kGy。辐射处理由浙江省农科院辐照中心进行。将照射后的菌液稀释,涂布于二苯胺抗性平板,22℃培养5~7 d。观察菌落生长情况,同时以未经诱变的菌悬液同样操作作为对照,计算致死率。从平板上筛选颜色较红,菌落较大的菌株进行摇瓶复筛,检测各菌株生物量和虾青素产量,筛选虾青素高产菌株。
1.3.4 第二轮复合诱变
筛选出经60Co-γ射线诱变后高产虾青素的菌株,在最佳紫外光照射时间和最佳60Co-γ射线诱变剂量下进行下一轮复合诱变,其余步骤同“1.3.2和1.3.3”。
1.4 菌株稳定性测试
筛选出经两轮UV-LiCl诱变和60Co-γ射线诱变育种后的高产虾青素菌株,对其进行稳定性试验,传代5次,分别测定其生物量和虾青素产量,验证菌株遗传稳定性。
2 结果与分析
2.1 二苯胺筛选剂量的选择
在进行诱变育种前,将不同浓度的抗性筛选剂二苯胺添加到YM固体培养基内,诱变后,当抑制剂去除,突变型菌株所合成的虾青素含量往往比野生型高,利用这一原理筛选出虾青素含量较高的突变株。如图1,出发菌株P.rhodozyma 02随着二苯胺浓度的增加颜色逐渐变淡,出发菌株在40 μmol/L的抗性平板上颜色发白,达到了通过颜色即可区分高低产菌株的效果,因此本实验选择MIC为40 μmol/L做为抑制剂的筛选浓度。

图1 红法夫酵母菌株在不同浓度二苯胺平板上的生长情况Fig.1 Growth of P.rhodozyma 02 strains on YM agar medium with different concentrations of diphenylamine
2.2 UV-LiCl复合诱变育种结果
2.2.1 UV-LiCl复合诱变剂量的确定
LiCl是一种碱金属卤化剂,本身并无诱变作用,但与紫外线复合,克服了单纯用紫外线诱变效果不理想的弊端,且在一定浓度范围内,有利于菌体正突变的发生[12]。因此,本实验将原始红法夫酵母菌株进行UV-LiCl协同诱变,稀释后涂布于含有40 μmol/L二苯胺的YM平板上培养后,计算得到的致死率和正突变率如图2。随着照射时间的延长,红法夫酵母致死率增大,当照射20 min时,红法夫酵母几乎完全致死。按照诱变剂量选择的一般原则,选取菌体致死率大约在80%~95%之间的诱变剂量进行诱变[13],位于此区间的诱变时间是5~12 min。而当诱变时间为7 min时,正突变率达到最大,为25.64%。因此,本实验选定紫外线照射时间7 min作为红法夫酵母菌株UV-LiCl协同诱变的诱变剂量。
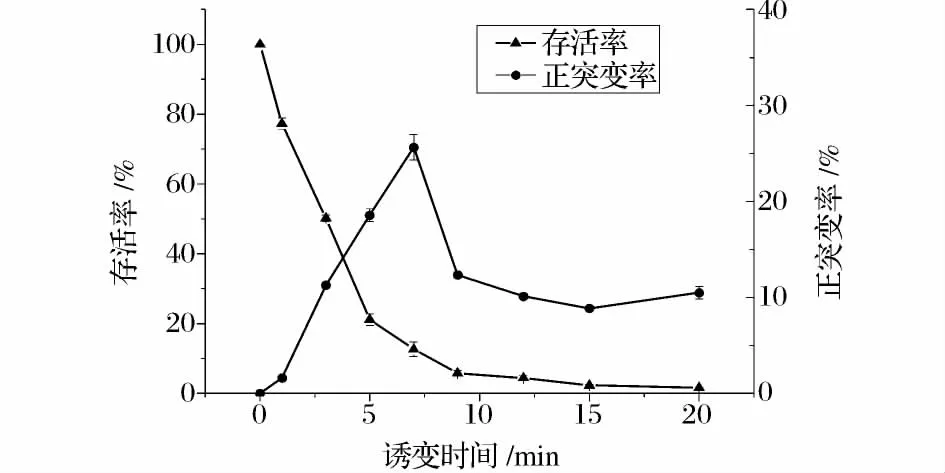
图2 不同剂量UV-LiCl处理对红法夫酵母菌株的影响Fig.2 Dose response curves of P.rhodozyma 02 strains by UV-LiCl radiation
2.2.2 UV-LiCl复合诱变高产菌株的筛选
P.rhodozyma 02菌株经紫外照射7 min后,平板初筛63个单菌落,选取其中菌落大、颜色亮而红的菌株12株进行摇瓶发酵复筛,测定虾青素含量和生物量。结果见表1。从表1中可以看出,突变株H1-2、H1-12虾青素体积产量较高,分别是(9.62±0.16)mg/L和(9.44±0.14)mg/L,分别是出发菌株 P.rhodozyma 02的2.02和1.99倍。因此将H1-2、H1-12作为下一步60Co-γ射线诱变的出发菌株。
2.3 60Co-γ射线诱变育种结果
2.3.160Co-γ射线复合诱变剂量的确定
从UV-LiCl诱变结果中得到H1-2、H1-12两株虾青素产量较高的突变株,分别取其对数期菌悬液,稀释成浓度为106/mL,将其混合后进行不同剂量的60Co-γ射线照射,平板培养后计算得到致死率和正突变率。如图3,随着诱变剂量的增加,红法夫酵母致死率增大,红法夫酵母正突变率先增大后降低。当诱变剂量为3.5 kGy时,致死率为84.95%,正突变率达到最大为32.4%,当诱变剂量高于3.5 kGy时,致死率达到90%左右,正突变率低于24.36%;当诱变剂量低于3.5 kGy时,致死率低于80%正突变率低于20.86%。因此选择3.5 kGy为最适诱变剂量。

表1 UV-LiCl复合诱变突变株的生物量和虾青素产量Table 1 Biomass and astaxanthin production of mutants by UV-LiCl radiation

图3 不同剂量60Co-γ射线诱变处理对红法夫酵母突变株的影响Fig.3 Dose response curves of mutants by60Co-γ radiation
2.3.260Co-γ射线诱变高产菌株的筛选
H1-2、H1-12 突变株经3.5 kGy剂量的60Co-γ射线诱变后,平板初筛得到52个单菌落,选取其中菌落大、颜色亮而红的菌株12株进行摇瓶发酵复筛,测定虾青素含量和生物量。结果见表2。从表2中可以看出,突变株H2-5和H2-10的虾青素产量分别是(13.27±0.17)mg/L和(13.75±0.08)mg/L,分别是出发菌株H1-2的1.38和1.43倍。因此将H2-5和H2-10作为第2轮UV-LiCl复合诱变的出发菌株。

表2 60Co-γ射线诱变突变株的生物量和虾青素产量Table 2 Biomass and astaxanthin production of mutants by60Co-γ radiation
2.4 第2轮UV-LiCl复合诱变育种结果
将60Co-γ射线诱变育种筛选到的H2-5和H2-10菌株作为第2轮UV-LiCl复合诱变育种的出发菌株,UV照射处理时间7 min。平板初筛得到56个单菌落,选取其中菌落大、颜色亮而红的菌株10株进行摇瓶发酵复筛,测定虾青素含量和生物量。结果见表3。从表3中可以看出,突变株H3-3和H3-10的虾青素产量分别是(18.59±0.07)mg/L和(18.40±0.10)mg/L,分别是出发菌株 H2-10的1.35和1.34倍。因此将突变株H3-3和H3-10作为第2轮60Co-γ射线诱变的出发菌株。
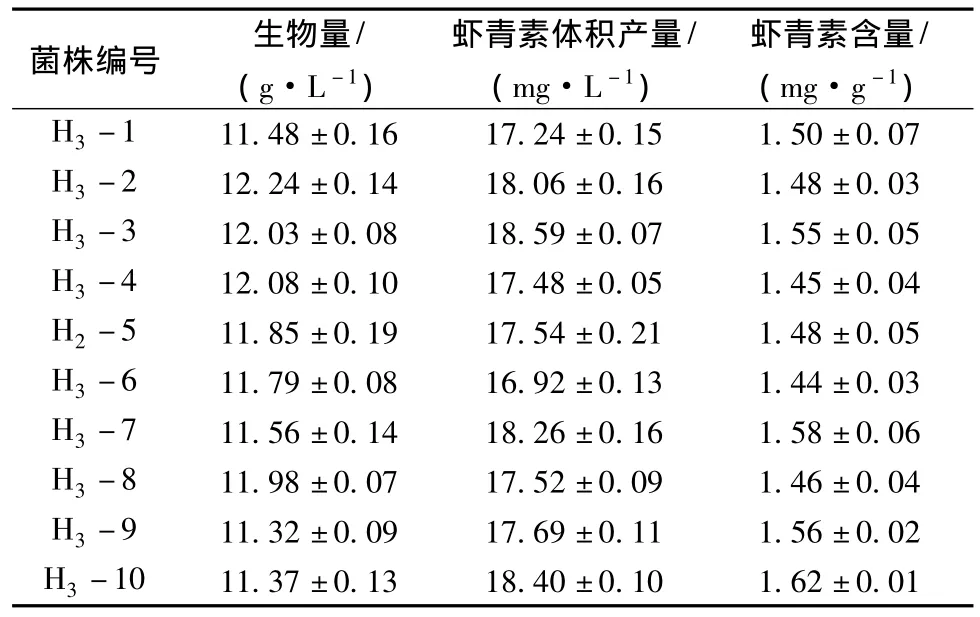
表3 第2轮UV-LiCl复合诱变突变株的生物量和虾青素产量Table 3 Biomass and astaxanthin production of mutants by the second-round UV-LiCl radiation
2.5 第2轮60Co-γ射线诱变育种结果
将第2轮UV-LiCl复合诱变育种筛选到的H3-3和H3-10菌株作为第2轮60Co-γ射线诱变育种的出发菌株,诱变剂量为3.5 kGy。平板初筛得到50个单菌落,选取其中菌落大、颜色亮而红的菌株10株进行摇瓶发酵复筛,测定虾青素含量和生物量。结果见表4。从表4看出,突变株H4-2和H4-4的虾青素产量分别是(25.27±0.08)mg/L和(25.52±0.12)mg/L,分别是出发菌株H3-3的1.36和1.37倍。

表4 第2轮60Co-γ射线诱变突变株的生物量和虾青素产量Table 4 Biomass and astaxanthin production of mutants by the second-round60Co-γ radiation
2.6 菌株稳定性试验结果
将2轮复合诱变得到的2株虾青素产量较高的突变株H4-2和H4-4,进行摇瓶稳定性遗传试验,考察菌株传代稳定性,结果见表5。传代5次后,发现菌株H4-4具有良好的稳定性,而菌株H4-2稳定性较差。其中H4-4菌株虾青素体积产量达到25.36 mg/L,是原始出发菌株 P.rhodozyma 02的5.34倍。而H4-2菌株虾青素细胞产量最高达到25.27 mg/L,最低达到23.34 mg/L。所以最终得到1株稳定的高产虾青素红法夫酵母菌株H4-4菌株。
3 讨论
传统的物理诱变剂(紫外诱变、γ射线诱变等)比化学诱变剂,如NTG、甲基磺酸乙酯(EMS)、硫酸二乙酯(DES)毒性更弱。但是紫外线诱变虽然常见但是正突变率低,诱变菌株不稳定容易回复突变,γ射线易在水中产生氧自由基进而导致微生物发生基因重组,基于这个原因γ射线常用来改良菌株[14]。
本试验选择UV-LiCl和60Co-γ两种物理诱变剂对红法夫酵母菌株进行复合诱变。UV-LiCl诱变已成功应用于红法夫酵母菌株,提高虾青素产率[12]。利用60Co-γ射线成功改良菌种的报道也很多[15-16],其正突变率较高,不易发生回复突变,操作简便。

表5 红法夫酵母突变株稳定性遗传试验结果Table 5 Inheritance stability tests of P.rhodozyma mutants
复合诱变通常包括3类:1是同一种诱变剂重复使用;2是两种或多种诱变剂先后使用;3是两种或多种诱变剂同时使用[17]。遵循上述原则可以有效提高诱变的效率,还能大幅度减轻工作量。本文采用两种诱变剂先后使用,进行2轮UV-LiCl复合诱变和2轮60Co-γ诱变,最终诱变得到两株高产虾青素的红法夫酵母菌株H4-2和H4-4。经稳定性试验考察,H4-4菌株遗传稳定性良好,虾青素产量为25.36 mg/L,是原始出发菌株5.34倍。本实验将最终得到的H4-4菌株命名为HSC-125,保藏编号为 CGMCC No.2024。
由此可见,对于筛选高产虾青素红法夫酵母突变株,采用多轮UV-LiCl和60Co-γ射线复合诱变结合二苯胺作为抗性筛选剂展现良好效果,并且高产菌株遗传稳定性良好。
[1]汪洪涛,徐学明,金征宇.天然虾青素对金鱼体色变化的影响[J].现代食品科技,2013,29(4):749-751.
[2]HU C,HAN W,CHEN Z,et al.Statistical optimization of microwave-assisted astaxanthin extraction from Phaffia rhodozym[C].Yantai:2010 3rd International Conference on Biomedical Engineering and Informatics,2010:2 104 -2 109.
[3]冯畅.虾青素对AA肉鸡血液理化指标和免疫功能的影响研究[D].长沙:湖南农业大学,2010.
[4]Mezquita PC,Huerta BEB,Ramírez JCP,et al.Milks pigmentation with astaxanthin and determination of colour stability during short period cold storage[J].J Food Sci Technol,2013,DOI:10.1007/s13197-013-1179-4.
[5]Tominaga K,Hongo N,Karato M,et al.Cosmetic benefits of astaxanthin on humans subjects[J].Acta Biochim Pol,2012,59(1):43-47.
[6]Yoshida H,Yanai H,Ito K,et al.Administration of natural astaxanthin increases serum HDL-cholesterol and adiponectin in subjects with mild hyperlipidemia[J].Atherosclerosis,2010,209(2):520-523.
[7]邵曼.法夫酵母JMU-MVP14联产发酵虾青素及低聚果糖的研究[D].福建:集美大学,2011:2.
[8]龚玉姣,屈平华,曹理想,等.协同诱变法选育虾青素高产优良酵母菌株[J].微生物学杂志,2010,30(1):16-20.
[9]谢虹,周元元,夏小伟,等.法夫酵母诱变选育高产虾青素菌株的研究[J].扬州大学学报,2006,27(4):80-84.
[10]XIE H,ZHOU YY,HU JF,et al.Production of astaxanthin by a mutant strain of Phaffia rhodozyma and optimization of culture conditions using response surface methodology[J].Ann Microbiol,2014,DOI:10.1007/s13213 -013-0790-y.
[11]郑宗宝.基于基因组重排技术的红法夫酵母虾青素高产株选育[D].天津:天津大学,2009:22.
[12]林晓,储小军,何光华,等.高产虾青素红法夫酵母的紫外线诱变[J].生物技术通报,2008,z1:411-414.
[13]梁新乐,陈敏,张虹,等.60Co-射线诱变阿维拉霉素筛选高产菌株及培养基优化[J].核农学报,2007,21(5):451-455.
[14]张森.红法夫酵母生产虾青素的研究[D].北京:北京化工大学,2012:10.
[15]汪文俊,周蓬蓬,何璞,等.60Co-γ射线诱变选育高产虾青素红法夫酵母突变株[J].激光生物学报,2005,14(3):208-212.
[16]Najafi N,Ahmadi A R,Hosseini R,et al.Gamma irradiation as a useful tool for the isolation of astaxanthin-overproducing mutant strains of Phaffia rhodozyma[J].Can J Microbiol,2011,57:730 -734.
[17]周元元.法夫酵母摇瓶发酵条件优化和高产虾青素菌株诱变选育[D].扬州:扬州大学,2006:66-67.

