通气量对谷氨酸棒杆菌HYH3-1 10 L生物反应器分批发酵的影响*
刘俊梅,王宏龄,王金枝,范春艳,吴杰
1(玉米深加工国家工程研究中心博士后工作站/吉林中粮生化有限公司,吉林长春,130033)
2(吉林大学 生命科学学院,吉林长春,130012)
3(吉林农业大学食品科学与工程学院,吉林长春,130118)
色氨酸是人体内的必需氨基酸之一,还是血清素的前体,对人和动物的生长发育、新陈代谢起重要的作用,广泛应用于医药、食品和饲料行业,其工业化生产方法越来越为研究人员所重视[1]。早期的L-色氨酸生产方法主要依靠化学合成和蛋白质水解,但这些方法由于材料来源有限、周期长、工艺复杂、杂质多等缺点在20世纪90年代逐渐被淘汰,随着对微生物法生产色氨酸的研究深入及基因工程的介入,微生物法已成为目前L-色氨酸生产的主要方法[2-5]。目前,国内L-色氨酸生产工艺研究开展较晚,产率较低,限制了工业化生产[6]。本文采用实验室构建的谷氨酸棒杆菌HYH3-1工程菌为研究材料,在合作单位研究的基础上对L-色氨酸发酵的一些关键控制点进行优化,并采用10 L发酵罐进行中试放大研究,确定通气量对谷氨酸棒杆菌HYH3-1 10 L生物反应器分批发酵的影响。
生物反应器分批发酵的重要目标是提高体积产率,即在给定的体积和最短的时间内得到最大的菌体量[7-9]。高密度培养是提高体积产率最有前途的方法之一,指应用一定的培养技术或装置提高菌体的发酵密度,最终提高特定产物的比生长率[10]。补料分批发酵是根据菌体生长和初始培养条件的控制实现高密度发酵培养[11-13]。本研究在摇瓶发酵的基础上,通过在10 L生物反应器中对通气量进行优化的分批发酵培养,研究谷氨酸棒杆菌HYH3-1的放大培养规律,为其大规模高密度培养提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
菌株Corynebacterium glutamicum HYH3-1为吉林农业大学实验室构建的工程菌,斜面保存于4℃冰箱中。
1.1.2 培养基
液体完全培养基(g/L):胰蛋白胨10,酵母浸出粉5,NaCl 5,葡萄糖1,pH 7.0~7.2。
种子培养基(g/L):葡萄糖20,酵母膏15,胰蛋白胨15,NaCl 2.5,脲 1,苯丙氨酸 0.2,酪氨酸 0.2,pH 7.0~7.2。
发酵培养基(g/L):葡萄糖 60,KH2PO41,K2HPO41,MgSO41,(NH4)2SO420,玉米浆 10,硫酸锰0.01,生物素0.03,CaCO320 ,pH 7.0 -7.2。(葡萄糖溶液采用单独高压灭菌后加入到其他各种成分中)。
以上培养基均于121℃灭菌20 min。
小灶河铜锑矿点,共发现4条铜锑矿化体,长约15~280m,宽约2~20m,主要有孔雀石化、辉铜矿化、黄铜矿化、褐铁矿化,孔雀石呈斑点状、浸染状附在岩石裂隙面上,辉铜矿、黄铜矿呈斑点状集合体赋存在灰岩内部,铜的品位在0.2%~3.71%之间,锑的品位在0.1%~1.09%。
1.1.3 主要试剂
苯丙氨酸(色谱纯),Sigma公司;酸酪氨酸(色谱纯),Sigma公司;胰蛋白胨,OXOID公司;酵母浸出粉,OXOID公司,其他国产试剂均为国产分析纯。
1.2 主要仪器与设备
Bioflo 110 发酵罐,New Brunswick Scientific,USA;DHG-9243BS-Ⅲ型电热恒温鼓风干燥箱,上海新苗医疗器械制造有限公司;SHB-A型循环水式多用真空泵,上海豫康科教仪器设备有限公司;HZQF280型台式恒温振荡器,太仓市华美生化仪器厂;SZ-97型自动三重纯水蒸馏器,上海亚荣生化仪器厂;GKC型数显控温水浴锅,上海浦东电理仪器厂;LDZX-50KB型立式压力蒸汽灭菌器,上海申安医疗器械厂;UV2700型紫外可见分光光度计,日本岛津公司;TGL-16G型台式离心机,上海安亭科学仪器厂;DHP9162型培养箱,上海索普仪器有限公司等。
1.3 实验方法
1.3.1 菌体活化
从斜面试管中挑取1环菌种于装有10 mL种子培养基的试管中,置于22℃的摇床中活化培养,4 d后以10%接种量接入装液量为100 mL/500 mL种子培养液的三角瓶中,22℃、160 r/min振荡培养80 h,备用。
1.3.2 生物量测定
用移液管吸取10 mL发酵液于15 000 r/min离心5 min,弃上清液,用去离子水洗涤3次后,置烘箱中,于105℃烘干至恒重,称量。
采用高效液相色谱分析系统测定,色谱分离条件Agilent Cl8(150 mm × 4.6 mm,3.5 μm),流动相 V(0.03%,KH2PO4溶液)∶V(甲醇)=90∶10,流速1 mL/min检测波长 278 nm[14]。
1.3.4 葡萄糖浓度标准曲线的制作
3,5-二硝基水杨酸比色法。1 mL不同浓度的葡萄糖溶液中分别加入2 mL配制好的DNS,沸水浴2 min,取出后用水迅速冷却,各加入9 mL的蒸馏水。于可见分光光度计中读取540 nm下的OD值。
1.3.5 残糖量的测定
发酵液经15 000 r/min,离心5 min,取上清液。按照1.3.4方法对上清液中的葡萄糖含量进行测定。
1.3.6 10 L生物反应器中不同通气量对各参数影响的初步研究
(1)10 L生物反应器分批培养方法:种子液以20%的接种量接入经灭菌装有2.5 L发酵培养基的自动生物发酵罐中,发酵期间主要控制参数与摇瓶培养确定的最佳参数相同。
(2)按照(1)生物反应器分批培养方法分别进行两组通气量的发酵:3.5 m3/h和5.0 m3/h,以对通气量进行优化。
(3)针对不同通气量进行分批发酵生产L-色氨酸,每隔一段时间从发酵罐取样口中取出一定量的发酵液,进行残糖量浓度、菌体干重及L-色氨酸产量的测定,同时利用发酵罐的在线检测,读出发酵液的pH值和OD值,并分别绘制曲线。
2 结果与分析
2.1 葡萄糖浓度标准曲线的绘制
将所得数值输入Origin作图软件,得到的线性公式和绘制出的标准曲线如图1所示。
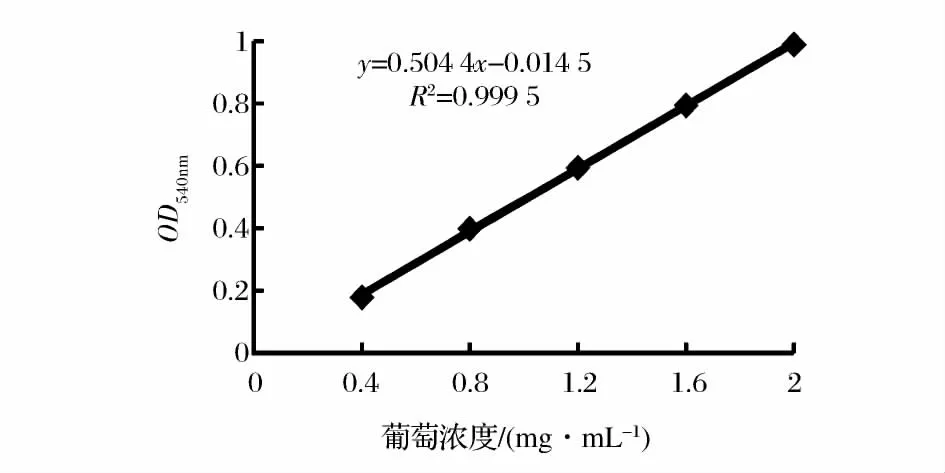
图1 葡萄糖浓度标准曲线Fig.1 Standard curve of glucose concentration
2.2 不同通气量对发酵过程中pH的影响
在转速一定(160 r/min)的条件下,考察两种不同通气量对谷氨酸棒杆菌HYH3-1发酵过程中pH的影响(图2)。
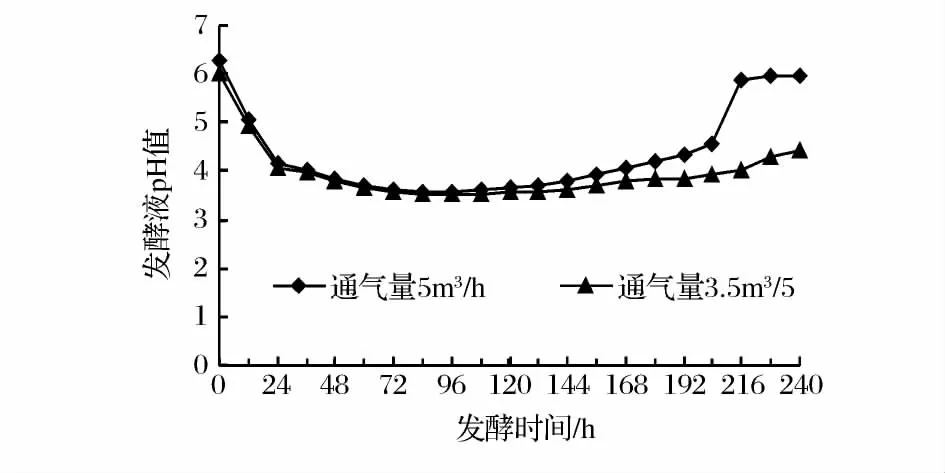
图2 10 L反应器培养中不同通气量的pH值变化曲线Fig.2 Curve of pH in the 10 L bioreactor of different ventilation capacity
由图2可见,发酵液的初始pH基本相同,在整个发酵过程中pH变化趋势也基本一致。0~24 h发酵液的pH均下降较快,这可能是由于发酵初期还原糖含量较多或溶解氧不足,致使糖等物质的氧化不完全及发酵液中有机酸的积累;在24~96 h pH下降缓慢并逐渐平缓;而在发酵120 h之后,发酵液的pH开始上升,之后又趋于平稳,分析pH值上升可能是由于随着培养基中的营养物质的耗尽,微生物细胞内蛋白酶的积累和活跃,引起培养液中氨基酸等的增加致使pH值上升。比较两种通气量,当通气量为5.0 m3/h时pH变化幅度较大,发酵终止时的pH高于通气量为3.5 m3/h的发酵液pH。
2.3 不同通气量对发酵过程中溶氧浓度的影响
在好氧培养过程中,溶氧浓度(简称DO)是一个非常关键的控制参数,其中通气量对于发酵罐中的溶氧浓度起到直接的作用。发酵液中的DO对微生物生长和产物形成有着重要的影响[15-16]。DO对发酵的影响分为两方面:一是影响与呼吸链有关的能量代谢,从而影响微生物生长;另一是直接参与产物合成[17-18]。谷氨酸棒杆菌 HYH3-1为兼性好氧微生物,对于氧的需求量较大,而在发酵过程中菌种只能利用发酵液中的溶解氧,因此,通过向发酵液中连续补充氧气并不断搅拌,可提高发酵液中的溶解氧。
由图3可以看出,由于通气量的不同,导致初始的DO值相差较大。随着发酵时间的增加,菌种生长导致发酵体系中溶解氧迅速降低,之后迅速增加,最后是缓慢的增加。通气量为5 m3/h时,在24~60 h之间溶氧一直保持在较低的水平,60 h后DO值急速上升,菌体进入对数生长末期,产物合成阶段;通气量为3.5 m3/h时,DO在24~72 h处于低谷,在72 h时才开始迅速上升,进入产物合成阶段较5 m3/h通气量晚12 h。通气量为5 m3/h时,更有利于菌体的生长和代谢产物的形成,而在通气量较大的条件下,发酵后期发酵液中的溶氧保持在较高的浓度,由此可见,通气量对DO有显著影响。

图3 10L反应器培养中不同通气量的DO变化曲线Fig.3 Curve of DO in the 10 L bioreactor of different ventilation
2.4 不同通气量对发酵过程中残糖量的影响
由图4可见,发酵液中初始含糖量均为200 g/L,进入对数生长期的谷氨酸棒杆菌HYH3-1迅速分解碳源,吸收营养物质,致使糖浓度迅速下降,在发酵108 h残糖大致耗尽,直至发酵结束整个体系中残糖量始终保持在很低的水平。

图4 10 L反应器培养中不同通气量的发酵液残糖曲线Fig.4 Curve of glucose content in the 10 L bioreactor of different ventilation
2.5 不同通气量对菌体干重的影响
由图5可见,HYH3-1在发酵36 h进入对数生长期,生物量迅速增加;在66 h进入稳定期,细胞生长缓慢,在通气量为5 m3/h和3.5 m3/h时,细胞干重分别达到16.3 g/L和15.6 g/L。结合图3可观察到,在快速生长期溶氧下降迅速,表明此时细胞的摄氧速率明显高于发酵液中的供氧速率,进入稳定期后,溶氧一直保持在较低的水平,这也可能由于生长期大量菌体生长需要消耗大量的溶氧。

图5 10 L反应器培养中不同通气量的细胞干重变化曲线Fig.5 Curves of cell dry weight in the 10 L bioreactor of different ventilation
不同的是,较高的通气量有利于HYH3-1的生长,在通气量为5 m3/h和3.5 m3/h时,最大细胞干重分别达到18.3 g/L和16.4 g/L。由此可见,在较大通气量下,谷氨酸棒杆菌HYH3-1的菌体生长较为充分。
2.6 不同通气量对L-色氨酸合成的影响
由图5和图6可见,分批发酵中L-色氨酸的积累与菌体的生长属于部分生长偶联型。在菌体处于对数生长期时,L-色氨酸合成速率较慢;当细胞进入稳定期时,细胞干重的增长趋势减慢,菌体浓度保持在一个较稳定的水平,而L-色氨酸合成速率却有明显的提高。由图6可以看出,L-色氨酸的合成随通气量的改变而发生变化。通气量为5 m3/h时,L-色氨酸在发酵48 h开始大量合成;而通气量为3.5 m3/h时,L-色氨酸的合成时间推迟到66 h,发酵终止时,L-色氨酸产量分别达到43.3 g/L和40.5 g/L。由此可见,高通气量对于细胞生长和L-色氨酸合成都有明显的促进作用。HYH3-1在有氧的条件下,能够很好的利用乙醇,它分解成二氧化碳和水。维持菌体的生命,又不使它过量生长,以促进产酸。

图6 10 L反应器培养中不同通气量的L-色氨酸产量变化曲线Fig.6 Curves of L-tryptophan production in the 10 L bioreactor of different ventilation
2.7 不同通气量条件下各参数主要变化时间的比较
表1为不同通气量条件下,细胞干重和L-色氨酸产量与各关键时间点的关系。

表1 不同通气量下关键时间及细胞干重和L-色氨酸产量的比较Table 1 Comparison of the key time and cell dry weight and L-tryptophan production of different ventilation
由表1可以看出,不同通气量条件下,谷氨酸棒杆菌HYH3-1进入对数生长期的时间基本相同,都在发酵第12 h,但低通气量延长了稳定期的时间,同时也推迟了二次生长的时间。同时也不难看出,L-色氨酸的大量积累主要在谷氨酸棒杆菌HYH3-1的二次生长阶段,因此可将谷氨酸棒杆菌HYH3-1的发酵过程分为两个阶段:第一阶段以大量积累谷氨酸棒杆菌HYH3-1细胞为主;第二阶段以细胞内合成L-色氨酸为主,同时伴有谷氨酸棒杆菌HYH3-1的二次生长。
3 讨论
发酵过程中通气量的大小,对氨基酸发酵有明显的影响。不同种龄、种量,不同的培养基成份,不同的发酵阶段和不同大小比例的发酵罐要求是不同的。通常情况下,培养基营养丰富,通气量要适当加大;培养基营养贫乏,通气量要适当减少[19]。通风量对兼性好氧菌发酵效果影响极大,本研究首先确定了发酵过程中通风量的维持浓度,并进一步探讨了通气量对10 L分批发酵培养的影响,发现采用5.0 m3/h通风量时L-色氨酸产量较高。可能是由于高通气量抑制丙酮酸激酶的活性减弱糖酵解途径,强化HMP途径,有利于L-色氨酸的合成。基因工程菌一般对氧气需求较高,在低溶氧条件下容易产生乙酸等副产物,本研究在发酵过程中维持5.0 m3/h的通风量即可满足L-色氨酸生产菌HYH3-1的需要。采用上述条件在容积10 L罐上进行8批发酵实验,L-色氨酸质量浓度基本稳定在40 g/L左右,发酵周期控制在120 h内。
4 结论
在500 mL摇瓶实验基础上,进行10 L生物反应器的分批发酵培养。实验表明高通气量有利于谷氨酸棒杆菌HYH3-1的生长和L-色氨酸的合成,当通气量为5.0 m3/h时,发酵液中色氨酸产量和细胞干重分别为43.3 g/L和18.3 g/L,发酵过程残糖变化不明显。当通气量为5.0 m3/h时pH变化幅度较大,发酵终止时的pH高于通气量为3.5 m3/h的发酵液pH。在通气量较大的条件下,发酵后期发酵液中的溶氧保持在较高的浓度,对DO有显著影响。
[1]赵春光,程立坤,徐庆阳,等.微生物法生产L-色氨酸的研究进展[J].发酵科技通讯,2005,37(4):34-36.
[2]杨会琴.L-色氨酸生物技术研究进展[J].食品科学,2007,28(9):45 -48.
[3]王健,张蓓,张克旭.L-色氨酸产生菌的途经分析[J].无锡轻工大学学报,2001,22(5):15 -18.
[4]陈俊峰,苏丽娜,王璋,等.从土壤中分离L-色氨酸生产菌株及其高产诱变选育的研究[J].食品与发酵工业,2007,33(7)37-41.
[5]Charles Yanofsky.Using studies on trytophan metabolism to answer basic biological questions[J].The Journal of Biological Chemistry,2003,278(13)858 -878.
[6]胡耀辉,王玉华,于寒松,等.L-色氨酸的应用及生产技术研究进展[J].吉林农业大学学报,2008,30(4):586-589.
[7]储炬,李友荣.现代工业发酵调控学[M].北京:化学工业出版,2002:234-242.
[8]陈涛,陈宁.L-色氨酸的生产及其代谢控制育种[J].生物技术通讯,2000(2):141-145.
[9]郑志永,姚善径.应用溶氧反馈控制高密度培养人肠杆菌过程中乙酸的产生[J].高校化学工程学报,2008,20(2):233-238.
[10]杨海军,王健,陈宁,等.不同添加物对L-色氨酸补料分批发酵的影响[J].天津科技大学学报,2004,19(1):1 -3,8.
[11]王东阳,蔡传康,司汝东,等.L-色氨酸中试生产研究[J].现代化工,2011,31(3):73 -76.
[12]张宁.氨基酸工艺学[M].北京:中国轻工业出版社,2007:312-322.
[13]邓毛程.氨基酸发酵生产技术[M].北京:中国轻工业出版社,2007:156-176.
[14]许前会,王慧彦,李艳辉,等.对二甲胺基本甲醛分光光度法测定色氨酸[J].甘肃科技,2006(12):50-53.
[15]周小萍,杨海军.L-色氨酸5L罐发酵条件的研究[J].农产品加工学刊,2005(8):51-53.
[16]吴有炜.试验设计与数据处理[M].苏州:苏州大学出版社,2002.
[17]刘燕,魏爱英,孟刚,等.采用补料生物反应器对产L-色氨酸发酵条件的优化[J].发酵科技通讯,2013(1):1-3.
[18]郑辉.L-色氨酸发酵条件研究[J].河北农业科学,2011,15(3):159-16.
[19]发酵过程通气量大小对谷氨酸发酵有何影响[J].发酵科技通讯,2010,39(1):7.

