乌桕群体/家系苗期性状遗传变异
辜云杰, 方泽红, 罗建勋, 冯 毅
(1.四川省林业科学研究院, 四川 成都 610081; 2.四川省森林病虫防治检疫总站, 四川 成都 610081;3.成都市农林科学研究院, 四川 成都 610011)
乌桕群体/家系苗期性状遗传变异
辜云杰1, 方泽红2, 罗建勋1, 冯 毅3
(1.四川省林业科学研究院, 四川 成都 610081; 2.四川省森林病虫防治检疫总站, 四川 成都 610081;3.成都市农林科学研究院, 四川 成都 610011)
于2009年11月采集四川、重庆地区10个乌桕群体共300个家系种子,在四川达州市林业中心苗圃播种育苗,并进行苗期观测,结果表明:乌桕群体/家系的苗高、地径、主根长、侧根数、分枝数均存在极显著差异,苗期表型平均分化系数为17.63%,群体内的变异大于群体间的变异;5个性状的家系遗传力受中等强度的遗传控制,单株遗传力受中等到高等强度的遗传控制;以欧式平均距离5为阈值聚类,10个群体可聚为北部群体、中部群体和南部群体3大类。
乌桕; 苗期性状; 遗传变异; 表型分化系数; 遗传力
乌桕(Sapiumsebiferum)在我国已有约1500年的利用和栽培历史,为我国特有的木本油料树种[1-4]。19世纪末期,乌桕在我国长江流域已被广泛种植,其列系产品桕脂、梓油一度成为主要的照明用油[5-9]。20世纪30年代贵州、安徽、江西以及长江流域的湖北、浙江和四川地区成为我国乌桕的重要产区,其中湖北汉口和浙江杭州为我国两大重要的乌桕油脂集散地。20世纪70年代,伴随电力事业的发展,乌桕的市场竞争力逐年降低,至80年代,全国乌桕年产量下降到9.5万t,90年代产量仅为7万t。我国现存乌桕约有2.8亿株,约产桕籽1亿kg,重庆巫山和酉阳县常年产籽1500t左右,四川荣县、屏山、犍为、井研4 县常年产量维持在500t以上[10-11]。目前,川渝地区乌桕产量全国排名第3,但开发利用还不够充分。我们对川渝两地乌桕地理群体苗期性状的地理变异进行研究,为今后开展乌桕优良群体选择,以及基于群体基础进行林分选择、单株选择和进一步开展育种工作奠定基础,还可使乌桕优良群体尽早地应用于生产,同时对保护乌桕的种质资源也具有重要意义。
1 试验地概况
试验地设在达州市林业局中心苗圃。该区地处31°06′49″N,107°30′16″E,海拔321m;属亚热带东南风气候区,其平均气温17.2℃,1月均温9℃,7月均温27℃,极端高温42.3℃,极端低温0℃,≥10℃的有效积温5514.4℃。无霜期多年平均299天,年均降雨量1205.7mm,年均蒸发量1118mm,相对湿度79%。
2 材料与方法
2.1试验材料
2009年11月,在川渝地区乌桕自然分布区,按照聚合群体抽样方法共收集10个有代表性的群体(这些群体的分布区基本涵盖了该树种在川渝地区的自然分布区),分别是四川凉山州的会东县和雷波县、乐山市井研县、眉山市洪雅县、泸州市古蔺县、绵阳市游仙区、广元市朝天区、达州万源市、重庆市的巫山县和酉阳县。选择处于亚优势地位、生长健壮、无明显病虫害的单株采种。每个群体选取30个单株采种,株间距离50m以上,采种部位为树冠中上部南向,每株采集100g以上成熟种实,分单株风干后保存。各群体分布区的地理位置及气象因子见表1。
2.2试验设计
2010年3月28日,将人工去蜡质层的乌桕种子用50℃温水浸种24h后,于29日播种。采用裂区试验设计,群体为主区,家系为副区,随机排列,每个家系播种50粒,3次重复。播种后盖上遮阳网,每群体/家系要打桩挂牌注明群体、家系号,并绘制位置图。
2.3苗期性状测定
2011年春季,在苗木萌动之前,对各大区每群体/家系植株的苗高、地径、分枝数、主根长和侧根数(大于1mm)进行观测和记录,测量工具使用游标卡尺和钢卷尺。各大区每群体/家系重复测5株。对调查数据进行方差分析。其线性方程[12-15]为:
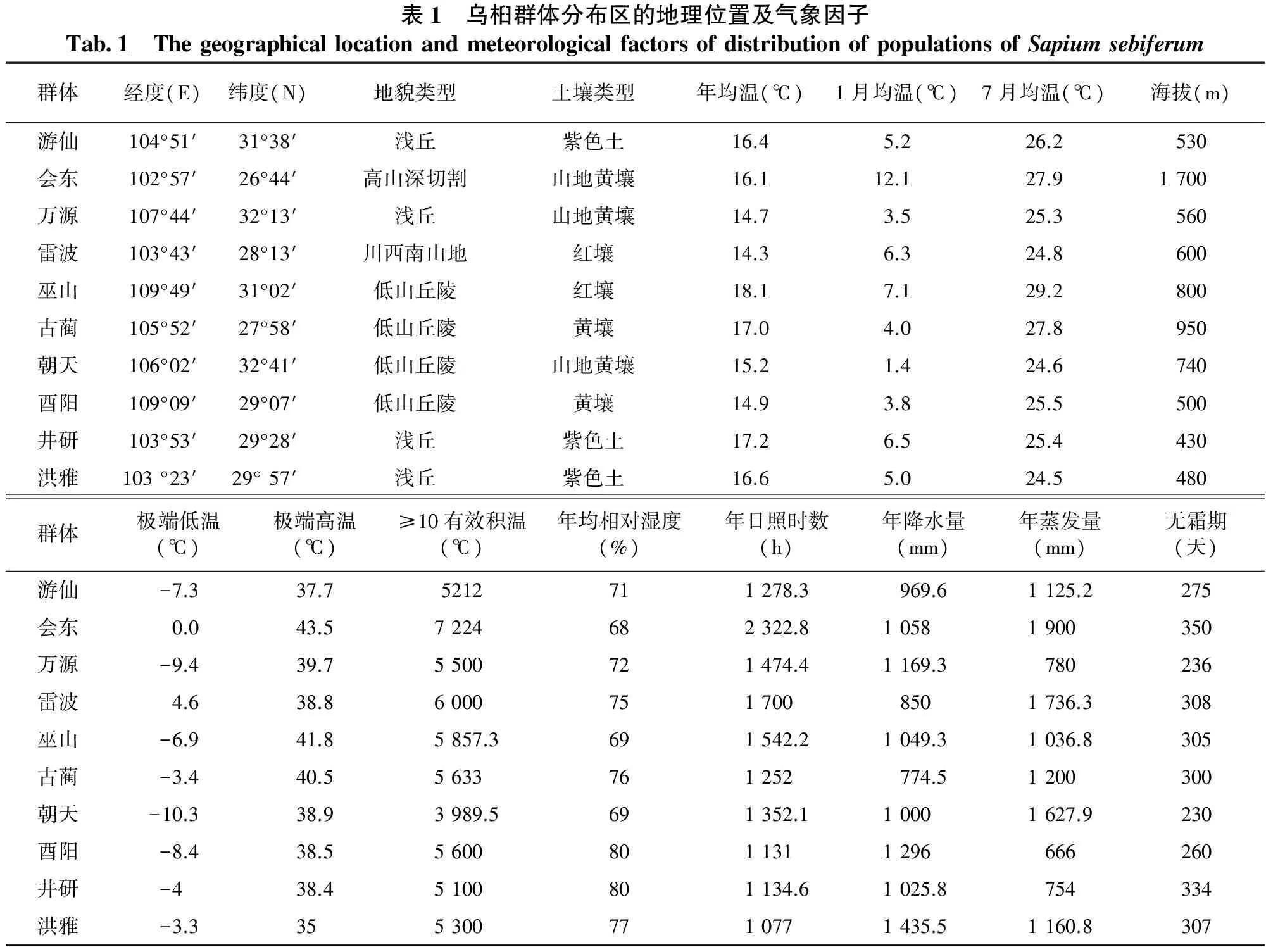
表1 乌桕群体分布区的地理位置及气象因子Tab1 ThegeographicallocationandmeteorologicalfactorsofdistributionofpopulationsofSapiumsebiferum群体经度(E)纬度(N)地貌类型土壤类型年均温(℃)1月均温(℃)7月均温(℃)海拔(m)游仙104°51′31°38′浅丘紫色土16.45.226.2530会东102°57′26°44′高山深切割山地黄壤16.112.127.91700万源107°44′32°13′浅丘山地黄壤14.73.525.3560雷波103°43′28°13′川西南山地红壤14.36.324.8600巫山109°49′31°02′低山丘陵红壤18.17.129.2800古蔺105°52′27°58′低山丘陵黄壤17.04.027.8950朝天106°02′32°41′低山丘陵山地黄壤15.21.424.6740酉阳109°09′29°07′低山丘陵黄壤14.93.825.5500井研103°53′29°28′浅丘紫色土17.26.525.4430洪雅103°23′29°57′浅丘紫色土16.65.024.5480群体极端低温(℃)极端高温(℃)≥10有效积温(℃)年均相对湿度(%)年日照时数(h)年降水量(mm)年蒸发量(mm)无霜期(天)游仙-7.337.75212711278.3969.61125.2275会东0.043.57224682322.810581900350万源-9.439.75500721474.41169.3780236雷波4.638.860007517008501736.3308巫山-6.941.85857.3691542.21049.31036.8305古蔺-3.440.55633761252774.51200300朝天-10.338.93989.5691352.110001627.9230酉阳-8.438.556008011311296666260井研-438.45100801134.61025.8754334洪雅-3.33553007710771435.51160.8307
Yijk=μ+pi+Fj/Pi+Bk+PiBk+εkij
测定苗高、地径、分枝数、主根长及侧根数,统计分析各群体样本平均数(μ)、变异系数(CV),并估算反映群体间表型变化的表型分化系数(Vst)。
2.4统计方法
按(1.4)中的线性方程进行相关遗传参数的估计。
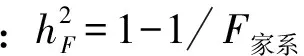
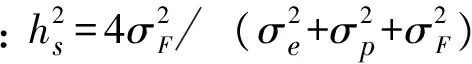
3 结果与分析
3.1乌桕苗期性状群体间变异特征
乌桕群体/家系苗期性状在群体间和家系内的方差分析结果见表2,多重比较结果见表3。由于种植地面积较大,且乌桕家系较多,因此各裂区地块间的肥力有一定差异。从表2可以看出:乌桕在肥力较好的地块上的苗期生长表现明显优于肥力较差的地块,并且区组与群体互作效用明显;苗期生长表现较好的群体在肥力较好的区组内,其生长表现远远强于肥力较差的区组。乌桕苗期各群体/家系苗高、地径、侧根数、最长根长及分枝数等性状均存在极显著差异,说明在群体和家系水平上对乌桕苗期性状改良有很大的潜力,进行苗高、地径及分枝等性状的群体选择和家系选择将取得良好的效果。
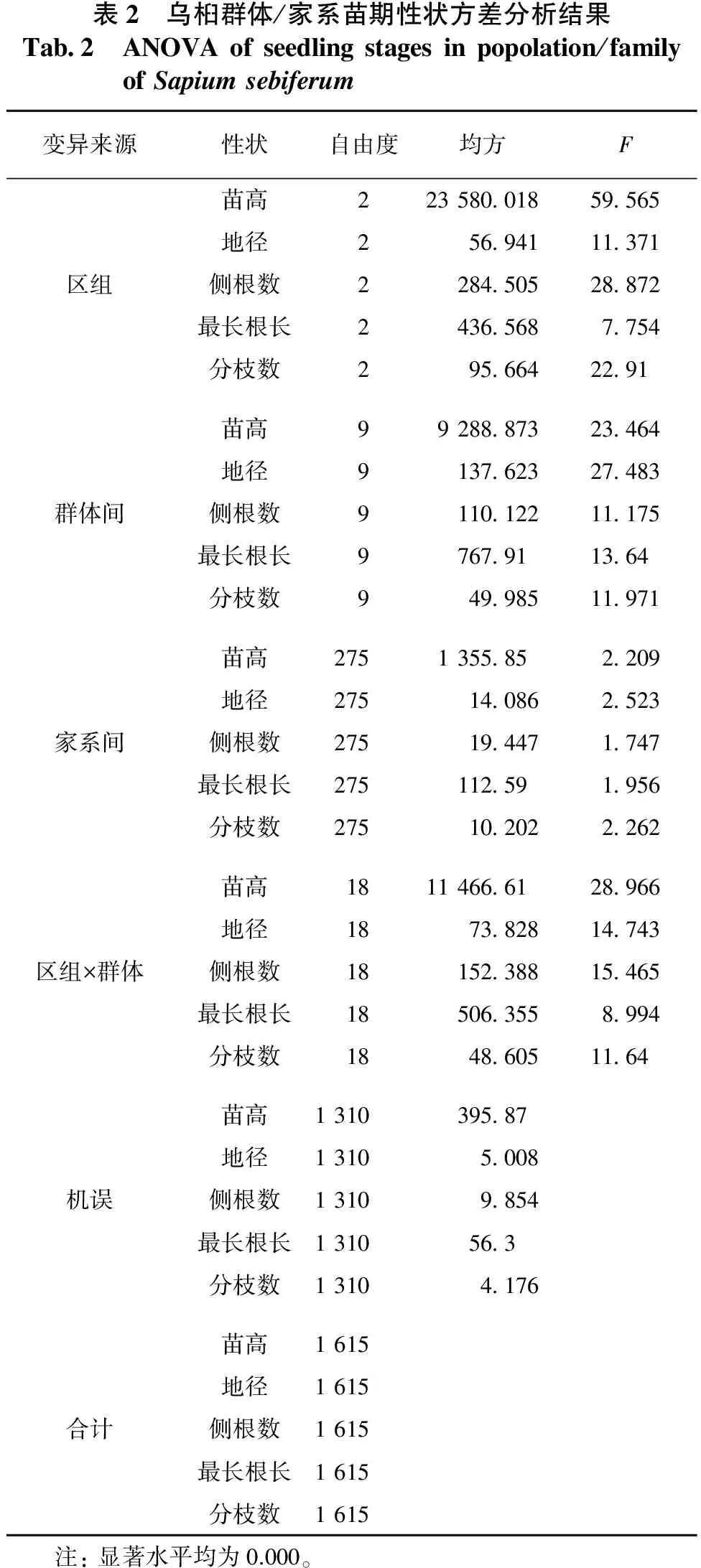
表2 乌桕群体/家系苗期性状方差分析结果Tab2 ANOVAofseedlingstagesinpopolation/familyofSapiumsebiferum变异来源性状自由度均方F苗高22358001859565地径25694111371区组侧根数228450528872最长根长24365687754分枝数2956642291苗高9928887323464地径913762327483群体间侧根数911012211175最长根长9767911364分枝数94998511971苗高2751355852209地径275140862523家系间侧根数275194471747最长根长275112591956分枝数275102022262苗高18114666128966地径187382814743区组×群体侧根数1815238815465最长根长185063558994分枝数18486051164苗高131039587地径13105008机误侧根数13109854最长根长1310563分枝数13104176苗高1615地径1615合计侧根数1615最长根长1615分枝数1615 注:显著水平均为0.000。
乌桕群体/家系苗各性状均值、标准差及多重比较结果见表3。从表3可以看出:乌桕群体/家系苗各性状均值在群体间和家系间存在显著差异。苗高平均值最高为井研(104.29cm),最低为酉阳(78.12cm);地径平均值最高为游仙(14.05cm),最低为巫山(10.89cm);侧根数平均值最高为井研(10.41条),最低为会东(7.61条);主根长平均值最高为朝天(40.44cm),最低为万源(32.37cm);分枝数平值数最高为会东(5.08枝),最低为巫山(2.91枝)。
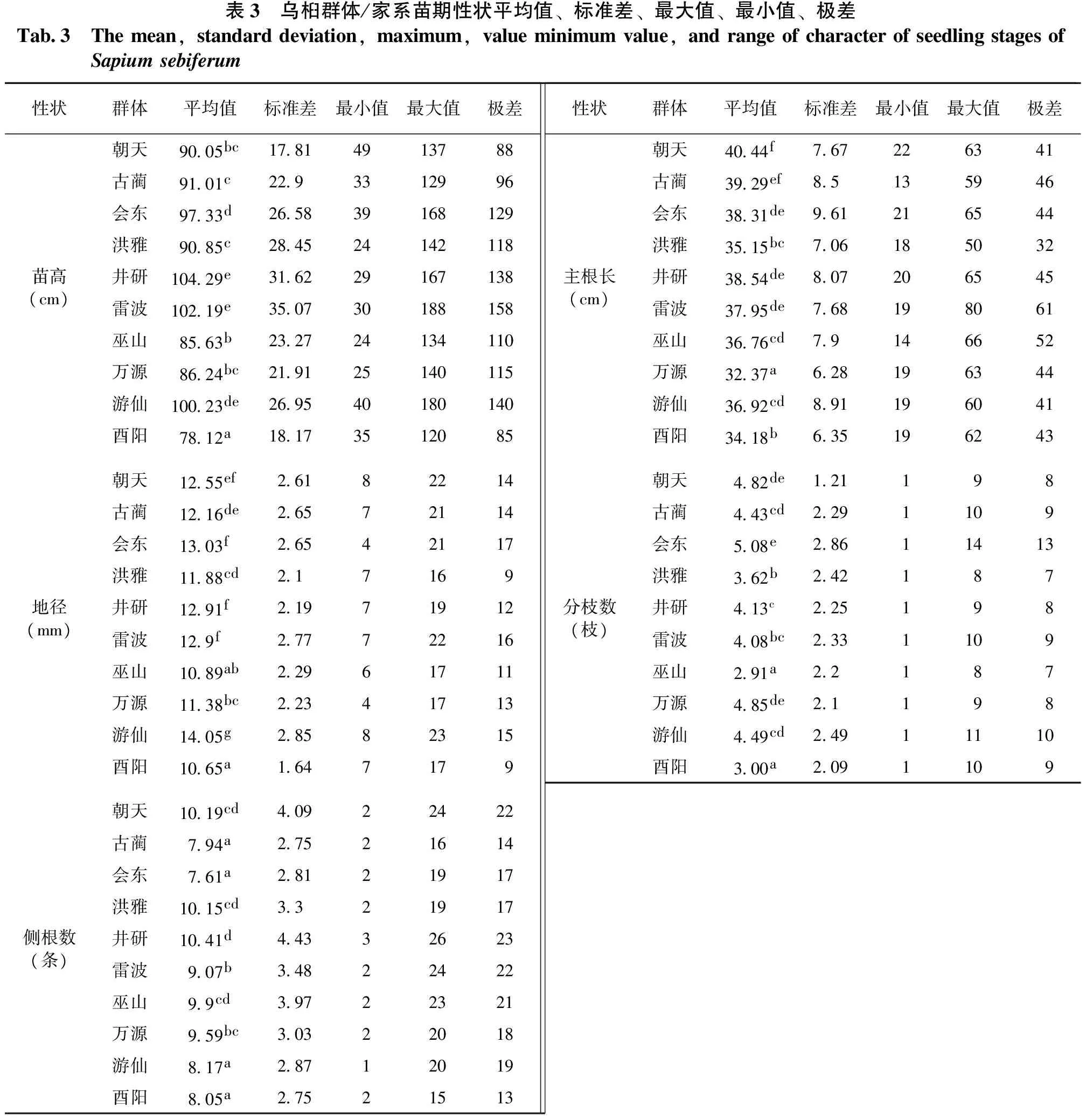
表3 乌桕群体/家系苗期性状平均值、标准差、最大值、最小值、极差Tab3 Themean,standarddeviation,maximum,valueminimumvalue,andrangeofcharacterofseedlingstagesofSapiumsebiferum性状群体平均值标准差最小值最大值极差朝天9005bc17814913788古蔺9101c2293312996会东9733d265839168129洪雅9085c284524142118苗高(cm)井研10429e316229167138雷波10219e350730188158巫山8563b232724134110万源8624bc219125140115游仙10023de269540180140酉阳7812a18173512085朝天1255ef26182214古蔺1216de26572114会东1303f26542117洪雅1188cd217169地径(mm)井研1291f21971912雷波129f27772216巫山1089ab22961711万源1138bc22341713游仙1405g28582315酉阳1065a1647179朝天1019cd40922422古蔺794a27521614会东761a28121917洪雅1015cd3321917侧根数(条)井研1041d44332623雷波907b34822422巫山99cd39722321万源959bc30322018游仙817a28712019酉阳805a27521513性状群体平均值标准差最小值最大值极差朝天4044f767226341古蔺3929ef85135946会东3831de961216544洪雅3515bc706185032主根长(cm)井研3854de807206545雷波3795de768198061巫山3676cd79146652万源3237a628196344游仙3692cd891196041酉阳3418b635196243朝天482de121198古蔺443cd2291109会东508e28611413洪雅362b242187分枝数(枝)井研413c225198雷波408bc2331109巫山291a22187万源485de21198游仙449cd24911110酉阳300a2091109
3.2乌桕苗期性状群体内变异特征
乌桕10个群体苗期性状的变异系数见表4。从表4可以看出:乌桕家系苗高、地径、侧根数、主根长、分枝数的平均变异系数有一定差异。分枝数的平均变异系数最大,为55.556%;,其次为侧根数,变异系数为36.613%;最小为地径,变异系数为19.535%。说明乌桕苗的地径变异程度最小,性状最为稳定;分枝数变异程度最大,性状最不稳定。从表4中还可看出,同一性状的变异系数在不同群体间有所差异,说明生长环境是引起不同群体家系苗期性状变异的原因。
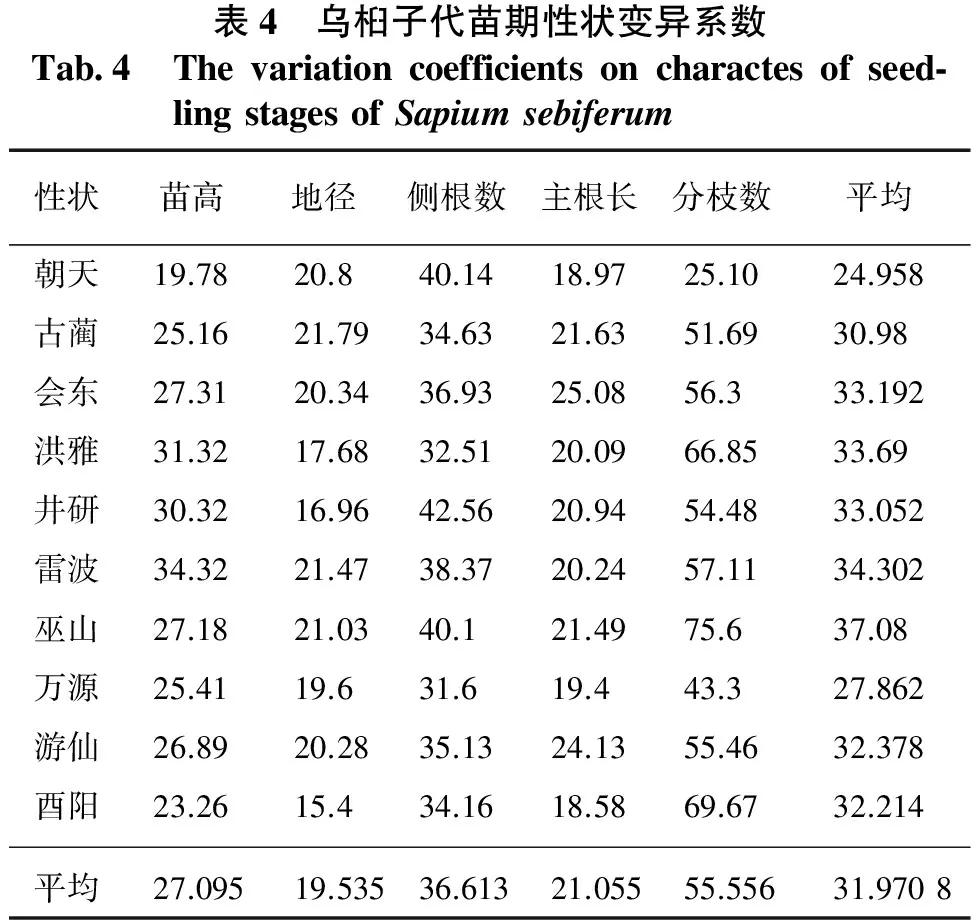
表4 乌桕子代苗期性状变异系数Tab4 Thevariationcoefficientsoncharactesofseed⁃lingstagesofSapiumsebiferum性状苗高地径侧根数主根长分枝数平均朝天19.7820.840.1418.9725.1024.958古蔺25.1621.7934.6321.6351.6930.98会东27.3120.3436.9325.0856.333.192洪雅31.3217.6832.5120.0966.8533.69井研30.3216.9642.5620.9454.4833.052雷波34.3221.4738.3720.2457.1134.302巫山27.1821.0340.121.4975.637.08万源25.4119.631.619.443.327.862游仙26.8920.2835.1324.1355.4632.378酉阳23.2615.434.1618.5869.6732.214平均27.09519.53536.61321.05555.55631.9708
3.3乌桕家系苗期表型分化系数
乌桕群体家系苗期性状方差分量与苗期表型分化系数见表5。从表5可知:各性状表型分化系数均小于25%,其中地径表型分化系数最大(20.3836%);分枝数表型分化系数最小(11.3832%)。各性状表型分化系数较小,说明群体内变异远远大于群体间变异。这一结果与乌桕呈连续性分布,地理隔离没有明显界限有关。
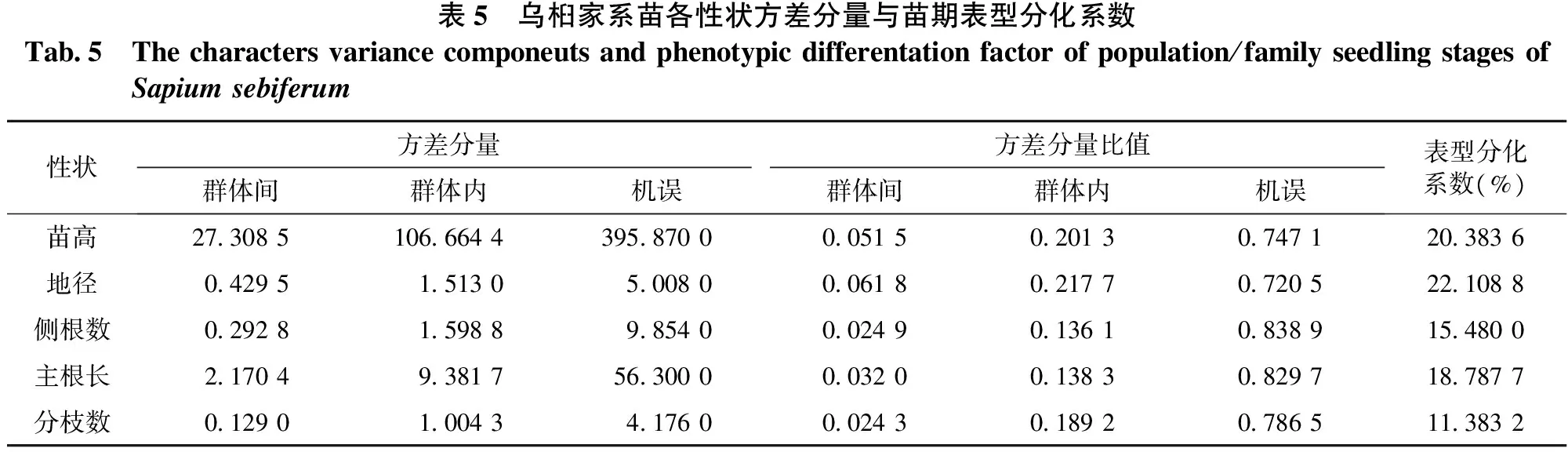
表5 乌桕家系苗各性状方差分量与苗期表型分化系数Tab5 Thecharactersvariancecomponeutsandphenotypicdifferentationfactorofpopulation/familyseedlingstagesofSapiumsebiferum性状方差分量方差分量比值群体间群体内机误群体间群体内机误表型分化系数(%)苗高27308510666443958700005150201307471203836地径042951513050080006180217707205221088侧根数029281598898540002490136108389154800主根长2170493817563000003200138308297187877分枝数012901004341760002430189207865113832
3.4乌桕苗期性状遗传力估算
遗传力会随着测定年份、栽植环境变化而变化,但在不同条件下,不同性状遗传力大小的排列次序是稳定的。乌桕家系/单株苗期各性状的遗传力见表6。从表6可以看出:乌桕苗期5个性状的家系遗传力在0.49~0.60间,单株遗传力在0.55~0.87间;家系苗期5个性状受中等强度的遗传控制,而单株苗期5个性状受中等强度到高度的遗传控制。说明通过家系、单株选择,能获得较高的遗传增益和改良效果,特别是单株选择,其效果尤其显著。
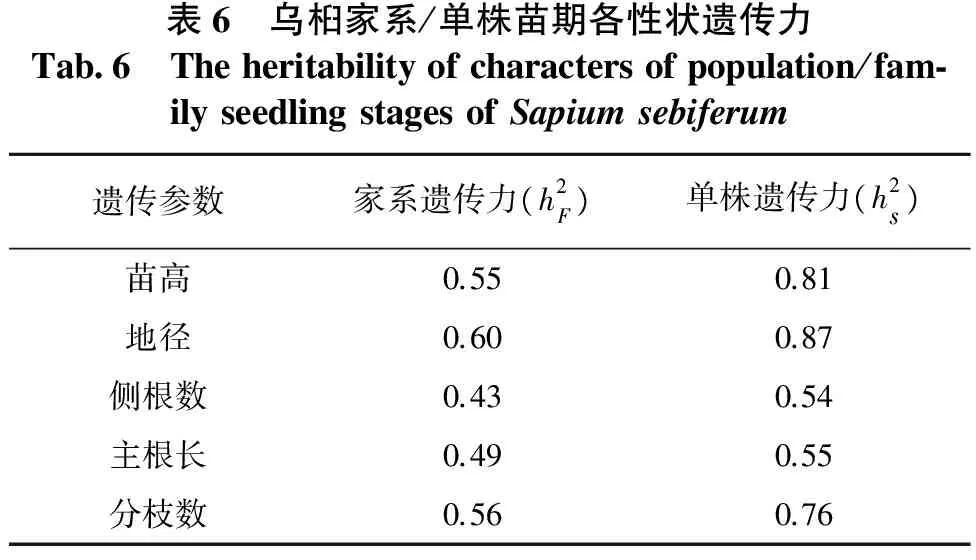
表6 乌桕家系/单株苗期各性状遗传力Tab6 Theheritabilityofcharactersofpopulation/fam⁃ilyseedlingstagesofSapiumsebiferum遗传参数家系遗传力(h2F)单株遗传力(h2s)苗高0.550.81地径0.600.87侧根数0.430.54主根长0.490.55分枝数0.560.76
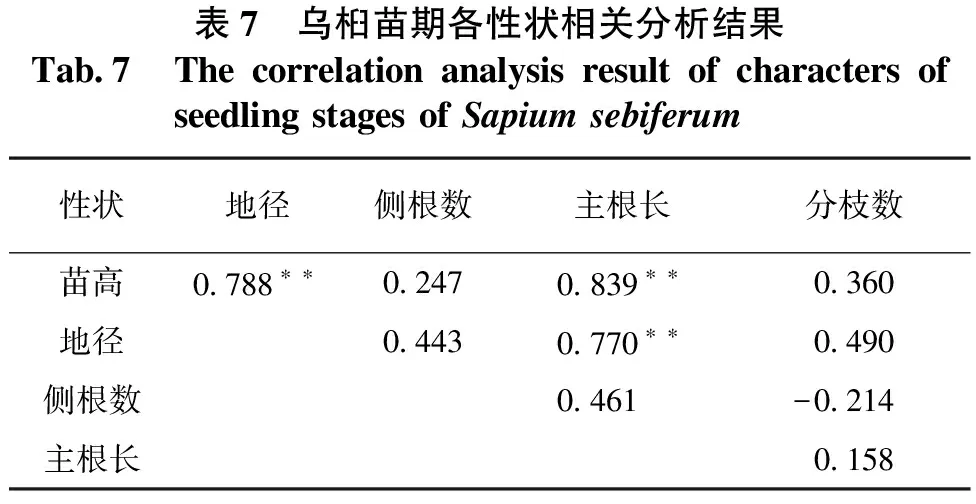
表7 乌桕苗期各性状相关分析结果Tab7 ThecorrelationanalysisresultofcharactersofseedlingstagesofSapiumsebiferum性状地径侧根数主根长分枝数苗高0788∗∗02470839∗∗0360地径04430770∗∗0490侧根数0461-0214主根长0158
3.5乌桕苗期性状相关性分析
数量性状的遗传受到多个基因的遗传控制,由于多个基因之间的相互作用使得性状间彼此关联、相互影响。只有摸清性状间的相关程度,才能在改良育种中取舍性状,从而提高林木改良的效率。从表7可知:乌桕苗高与地径、主根长呈极显著正相关,相关系数分别为0.788和0.839;地径与主根长存在极显著正相关,相关系数为0.770。说明主根的生长有助于苗高、地径的生长。侧根数与分枝数2个性状均与其他性状相关性不大,说明侧根数、分枝数独立遗传,可以独立选择。
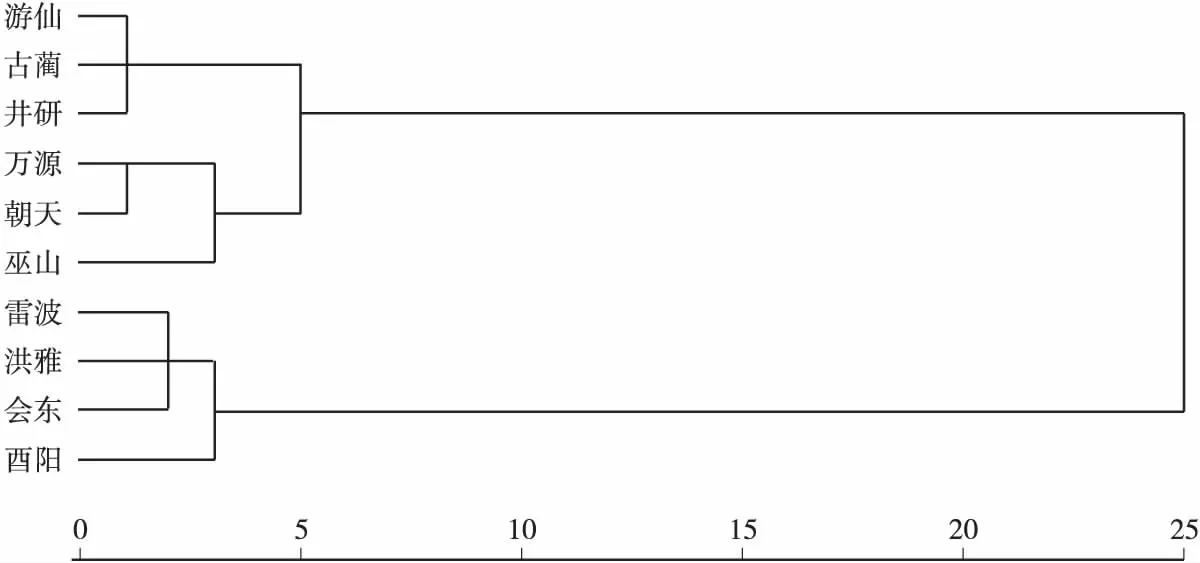
图1 乌桕苗期性状树状聚类图Fig.1 The tree dendrogram of characters of seedling stages of Sapium sebiferum
3.6乌桕苗期性状聚类分析
以欧式平均距离5为阈值,从聚类图可以看出,10个乌桕群体可以聚为3大类,其南部群体包括会东、洪雅、酉阳、雷波4个纬度较低的群体,中部群体包括游仙、古蔺和井研群体,北部群体包括万源、朝天与巫山。从聚类分析还可以看出,乌桕苗期性状的变异明显以纬度变异为主,其中南部群体长势较弱,可能是由于达州苗圃地理位置靠北,纬度偏低的群体到纬度偏高的地方不适应的原因所致。
4 结论与讨论
(1) 乌桕种内存在着丰富的遗传变异,参试群体/家系的苗高、地径、主根长、侧根数及分枝数均存在极显著的差异,其变异主要受遗传因素制约,这为开展乌桕优良群体和优良个体选择提供了依据。
(2) 乌桕5个苗期性状中,分枝数变异最大,其次为侧根数,再依次为苗高、主根长和地径;表型分化系数平均为17.63%,从大到小依次为地径、苗高、主根长、侧根数、分枝数;群体内的变异显著大于群体间的变异,这与乌桕呈连续性分布,地理隔离没有明显界限有关。
(3) 乌桕5个苗期性状的家系遗传力受中等强度的遗传控制,单株遗传力受中等到高等强度的遗传控制,因此,开展家系和优良单株的选择是非常有效的。在科研工作中,需根据不同研究和育种目标,对遗传力高的性状加以运用,从而有效提高选择和育种效率。
(4) 以欧式距离5为阀值可以将乌桕的10个群体聚为3大类,分别是北部群体、中部群体和南部群体。
(5) 乌桕天然林资源大部分已被毁,零星大树也很少见,故群体的采种林分多为次生林分,且采到的群体数量较少,这对试验结果会产生一定的影响。因此,针对乌桕现存资源的分布特点,应在群体/家系试验结果的基础上,进一步开展优良群体内的优良家系及单株选择,以丰富乌桕的种质资源。
[1] 金代钧,黄惠坤,唐润琴,等.中国乌桕品种资源的调查研究[J].广西植物,1997,17(4):345-362.
[2] 金代均,黄慧坤.乌桕的地理分布和环境的关系[J].广西植物,1984,4(1):71-80.
[3] 李冬林,黄栋,王瑾,等.乌桕研究综述[J].江苏林业科技,2009,36(4):43-47.
[4] 时宏,郭洪.用乌桕脂生产类可可脂的研究进展和前景[J].中国油脂,2001,26(5):91-94.
[5] 刘火安,姚波.乌桕油脂成分作为生物柴油原料的研究进展[J].基因组学与应用生物学,2010,29(2):402-408.
[6] 罗希,王明勇.利用乌桕梓酸化油生产生物柴油的条件优化[J].贵州农业科学,2010,38(10):193-196.
[7] 张乃春,陈波涛,邓伯龙,等.贵州省乌桕资源调查与品种选育策略初探[J].资源开发与市场,2008,24(4):318-320.
[8] 王洪庆,赵春阳,陈若芸,等.乌桕叶化学成分研究[J].中国中药杂志,2007,32(12):1179-1181.
[9] 杨志斌,齐玉堂,王晓光,等.乌桕籽制取生物柴油研究初报[J].湖北林业科技,2007,(6):32-34.
[10] 张克迪.中国乌桕[M].北京:中国林业出版社,1991.
[11] 徐濂泉.乌桕的开发与利用[J].福建林业科技,1992,19(30):73-75.
[12] 郭锡昌,胡承海译.森林遗传学[M].北京:中国林业出版社,1981.
[13] Falconer D S,Mackay T FC.数量遗传学导论[M].储明星,译.北京:中国农业科技出版社,2000.
[14] 中华人民共和国农业部教育司.遗传模型分析方法[M].北京:中国农业出版社,1997.
[15] 盛志廉,吴常信.数量遗传学[M].北京:中国农业出版社,1995:1-73.
(文字编校:唐效蓉)
Geneticvariationinpopulation/familyofSapiumsebiferumseedling
GU Yunjie1, FANG Zehong2, LUO Jianxun1, FENG Yi3
(1.Sichuan Academy of Forestry,,Chengdu 610081, China;2.General Station of Forest Pest Management and Quarantine of Sichuan Province,Chengdu 610081, China3.Chengdu Academy of Agriculture and Foresty, Chengdu 610011, China)
An experiment on seedling cultivation was conducted using 10 populations a total of 300 family seed material which collected in Sichuan and Chongqing areas in November 2009 and sowed in the center of sichuan Dazhou forestry nursery.The results showed that the seedling traits ofSapiumsebiferumwere diverse. In height, ground diameter, main root length, lateral root number and branch number had significant differences. The mean phenotypic differentiation coefficient was 17.63%, the variation within populations was greater than that among populations. Family heritability about five traits were moderately controlled by genetic factors,while the individual heritability was moderately or highly controlled by genetic factors.10 populations could be divided into three categories with European average distance five threshold.
Sapiumsebiferum; seedling stages; phenotypical differentiation coefficient; heritability
2013-11-18
林业公益性行业科研专项“重要树种种质资源保存与可持续利用关键技术研究”(201204307)。
辜云杰(1979-),男,四川省乐山市人,副研究员,主要从事林木遗传育种技术研究。
S 792.99
A
1003 — 5710(2014)01 — 0029 — 06
10. 3969/j. issn. 1003 — 5710. 2014. 01. 006

