肿瘤患者血浆抗凝血酶Ⅲ、FDP和D-二聚体的结果分析
陈喜军,窦敏,林一
(1、福建省立医院省临检中心,福建 福州 350001;2、福建省立医院检验科,福建 福州 350001)
在肿瘤病人,由于肿瘤组织对周围组织的侵袭、转移的形成以及恶性肿瘤细胞和恶性肿瘤患者血管的本身变化,均可导致患者凝血和纤溶系统功能发生紊乱[1,2]。检测血浆抗凝血酶Ⅲ、FDP和D-二聚体活性及含量是肿瘤患者弥漫性血管内凝血(DIC)及纤溶系统的敏感的指标。本文通过检测636例恶性肿瘤患者血浆中的抗凝血酶Ⅲ、FDP和D-二聚体水平,探讨其指标与疾病的临床意义,并比较不同恶性肿瘤患者的继发性纤溶。
1 材料与方法
1.1 临床资料 选择在2012年7月至2013年7月我院住院的恶性肿瘤患者共636例,其中男性306例,女性330例,平均年龄56.22±7.2岁。所有患者均经手术、影像(B超、CT等)或病理学检查确诊,且均无口服抗凝药物史。其中急性白血病68例,男 30例,女 38例,平均年龄 52.1±5.92;肝癌94例,均为男性,平均年龄56.8±6.31;肺癌152例,男 101例,女 51例,平均年龄 56.8±7.92;肠癌297例,男58例,女239例,平均年龄68.2±10.21;乳腺癌25例,全为女性,平均年龄52.1±5.63。对照组60例,为来自我院体检中心体检的40~60岁的健康人群,其中男性35例,女性25例,平均年龄51.2±7.22。
1.2 检验方法 采用法国Stago公司STAR全自动血凝仪及原装配套试剂盒对ATⅢ活性、FDP和DD含量进行检测,其中ATⅢ采用发色底物法,FDP、DD采用免疫比浊法。
2 结果
2.1 正常对照组与恶性肿瘤组ATⅢ活性、FDP及DD含量测定结果及比较 在ATⅢ活性中,肝癌患者与健康对照组比较有显著差异(P<0.05);在FDP和DD含量中,肿瘤患者与健康对照组比较有显著差异(P<0.05);在FDP含量中,急性白血病、肝癌和肺癌与其它肿瘤患者之间比较有显著差异 (P<0.05)。 见表1。
表1 正常对照组与恶性肿瘤组ATⅢ活性、FDP及DD含量测定结果及比较(±s)
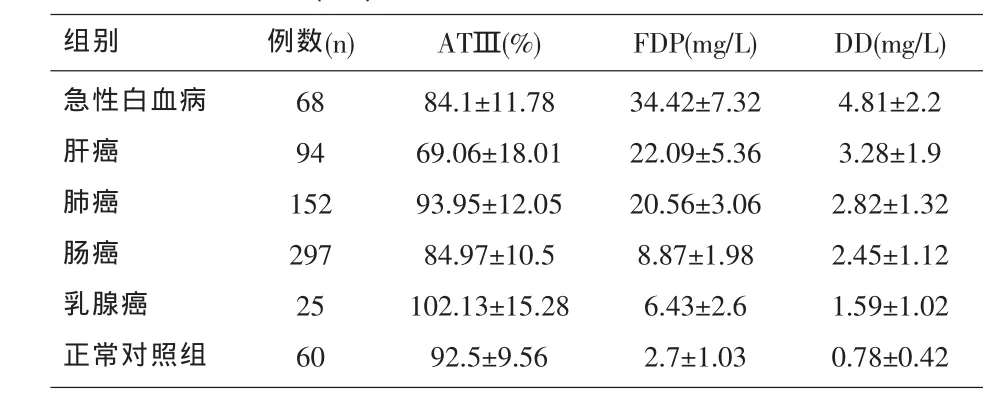
表1 正常对照组与恶性肿瘤组ATⅢ活性、FDP及DD含量测定结果及比较(±s)
组别 例数(n) ATⅢ(%) FDP(mg/L) DD(mg/L)急性白血病肝癌肺癌肠癌乳腺癌正常对照组68 94 152 297 25 60 84.1±11.78 69.06±18.01 93.95±12.05 84.97±10.5 102.13±15.28 92.5±9.56 34.42±7.32 22.09±5.36 20.56±3.06 8.87±1.98 6.43±2.6 2.7±1.03 4.81±2.2 3.28±1.9 2.82±1.32 2.45±1.12 1.59±1.02 0.78±0.42
2.2 恶性肿瘤患者各组血浆ATⅢ、FDP及DD阳性检出率比较 在ATⅢ活性中,肝癌患者的阳性率较高;在FDP含量中,肝癌、急性白血病患者的阳性率较高;在DD含量中,五种肿瘤患者的阳性率都较高。见表2。
3 讨论
恶性肿瘤是危害人类健康的重要疾病之一,其发生发展是一个多因素参与、经过多个阶段才最终形成的极其复杂的生物学现象。恶性肿瘤患者易引发静脉血栓的形成,其发生血栓的机制十分复杂[2]。由于恶性肿瘤患者长期的活动受限再加上肿瘤的压迫等,导致其静脉血流处于瘀滞状态,又因恶性肿瘤细胞破坏机体的凝血、纤溶系统的平衡,直接激活凝血系统,诱导促凝因子产生,抑制血管内皮细胞、血小板、单核细胞、巨噬细胞的抗凝活性[3],不同程度的存在着凝血和纤溶异常,使机体处于易栓状态。

表2 恶性肿瘤患者各组血浆ATⅢ、FDP及DD阳性检出率比较
ATⅢ由肝脏、血管内皮细胞和巨核细胞合成,是抗凝血系统的一个重要的组成部分[4]。肝癌患者由于肝脏功能遭到破坏,肝脏凝血因子合成减少或凝血因子大量消耗而致不同程度的凝血功能障碍。ATⅢ降低的主要原因是肝癌患者严重肝损害导致其获得性合成减少,同时也与肝癌患者癌组织崩解,坏死释放促凝物质破坏凝血及纤溶系统的动态平衡有关[5]。
FDP是反映血循环中纤维蛋白原在纤溶酶作用下生成的X、Y、D、E碎片含量,它反映纤溶系统激活和FDP生成[6]。本文结果显示了在人类多种恶性肿瘤病人中,纤溶活性明显增高,呈现不同程度的纤溶亢进。我们还发现纤溶活性的增高程度与肿瘤的组织来源及恶性程度有一定关系,呈正比。从表1中的FDP值的分布来看,恶性程度较高的急性白血病、肝癌和肺癌FDP升高的幅度较明显,远远高于其它两类肿瘤。其阳性率依次为急性白血病>肝癌>肠癌>肺癌>乳腺癌。这可能与急性白血病细胞可释放凝血活酶样物质激活凝血系统,产生典型的DIC。白血病细胞的促凝活性增高是发生DIC的起因,因此需要早期进行化疗,然而化疗又使白血病细胞大量破坏,常又诱发或加重DIC,引起继发性纤溶。另外,肝细胞是体内产生纤溶酶原的重要细胞。在细胞恶变后,其产生纤溶酶样物质的活性得到增强,也可能因为肝癌瘤体血管丰富,这些血管或因不成熟以及它们的本身改变而具有较高的纤溶活性。
DD是交联纤维蛋白的特异性降解产物,是特异性反映体内高凝状态和继发性纤溶亢进的标志物之一[7]。本文结果说明五种恶性肿瘤都有不同程度的纤溶亢进,DD与肿瘤的恶性程度呈正相关,恶性程度越高的其DD含量升高就越显著。其阳性率的高低与FDP相同。
因此动态监测ATⅢ活性、FDP及DD含量,不仅可以有利于了解恶性肿瘤患者的高凝与纤溶状态,对DIC和血栓形成的诊断有重要意义,而且对于疗效评估及预后发展均具有十分重要的临床应用价值。
[1]马敬垒,耿晓星.分化相关基因NDRG1在恶性肿瘤中的研究进展[J].现代肿瘤医学,2009,l7(12):2432-2434.
[2]Liotta LA.Tumor extracellular matrix[J].Lab Invest,1982,47(2):112-113.
[3]Furie B,Furie BC.Cancer-associated thrombosis[J].Blood Cells Mol Dis,2006,36(2):177-181.
[4]李家增,贺石林,王鸿利.血栓病学[M].北京:科学技术出版社,1998:53.
[5]罗冰.肝硬化和肝癌患者血浆D-二聚体、纤维蛋白原的检测[J].血栓与止血学,2005,11(1):26-27.
[6]戴庆忠,吴素碧.肝病患者血浆D-二聚体、FDP测定的临床意义[J].医学理论与实践,2008,21(10):1140-1141.
[7]叶晓芳,刘双,杨京华.血浆D-二聚体水平测定在不同肺部疾病中的临床意义[J].心肺血管病杂志,2009,28(1):7-9.

