混合C4芳构化反应的热力学研究
程亮亮,马应海,程 琳
(中国石油石油化工研究院兰州化工研究中心, 甘肃 兰州 730060)
长期以来,石化企业炼化装置生产的混合 C4一直作为民用液化气使用,附加值较低。因此,研究混合 C4的有效利用途径成为石化企业亟待解决的问题之一。近年来,混合C4在ZSM-5沸石上的芳构化引起人们的广泛关注[1-3],该技术实现了大规模应用,不仅实现了C4资源的优化利用,而且为芳烃的生产开辟了新的原料来源。
本文对混合C4芳构化过程进行热力学计算,阐述反应温度对芳构化反应的影响,为混合C4芳构化的研究提供热力学依据。
1 C4芳构化反应体系描述
混合C4芳构化涉及的化学物质较多,原料及其反应产物中的主要组分如下:
反应原料:1-C4H8、iC4H8、c-2-C4H8、t-2-C4H8、nC4H10、iC4H10。
反应产物:H2、CH4、C2H4、C2H6、C3H6、nC3H8、iC3H8、1-C4H8、iC4H8、c-2-C4H8、t-2-C4H8、nC4H10、iC4H10、C6H6、C7H8、C8H10、C9H12、C10H14。
混合C4芳构化过程涉及裂解、齐聚、环化、加氢、脱氢等多种反应,全面准确地描述所有反应是非常困难的。在查阅芳构化反应物及其产物的热力学数据时,发现烷烃、烯烃、芳烃各自的同分异构体的物性数据比较接近[4],因此,为简化反应过程,在描述混合C4芳构化所涉及的反应方程时用丙烷、1-丁烯、正丁烷、1,4-二甲苯、1,3,5-三甲苯、1,4-二乙基苯分别代表C3烷烃、C4烯烃、C4烷烃、C8芳烃、C9芳烃、C10芳烃。
本文用19个方程来描述混合C4芳构化过程:

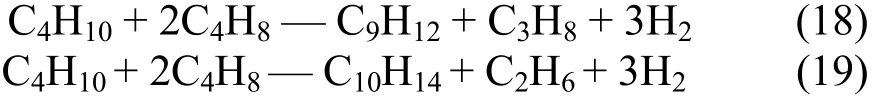
2 C4芳构化反应的热力学计算
2.1 热力学计算原理[5]






通过以上公式,可以计算出任意反应在某一温度下的标准摩尔反应焓、标准摩尔反应熵、标准摩尔反应吉布斯自由能和标准平衡常数。
2.2 热力学计算
依据热力学计算原理,对本文描述的混合 C4芳构化涉及的各个反应方程的、和进行计算。在热力学计算时,反应体系中各物质的热力学数据来源于文献[4]。
3 热力学计算结果与讨论
3.1 各反应在不同温度下的DrHqm
混合C4芳构化过程中,各反应在不同温度下的标准摩尔反应焓如表1所示。
根据以上分析,提高反应温度,对于丁烷裂解反应和大部分芳构化反应有利,还能对丁烯加氢反应起到抑制作用。
3.2 各反应在不同温度下的
在恒温恒压条件下,化学反应的净推动力可以用吉布斯自由能来度量,其条件是=0。如果某反应的<0,说明该反应可自发进行,且的绝对值越大,则表示化学反应净推动力越大。各反应在不同温度下的吉布斯自由能见表2。
从表2可以看出,在低温(298.15 K)时,芳烃生成反应11~14、18、19的D均小于0;随着温度升高,均有不同程度的减小,在600 K时除丁烷不能发生芳构化反应以外,丁烯或丁烯与丁烷都可生成芳烃;与在700 K时除反应9的大于0之外,其余反应的小于0;在800 K时各芳烃生成反应的均小于0。对于丁烷裂解反应1~3,逐渐下降,在500 K以上下降至0,说明丁烷在500 K以上才能发生裂解反应生成丙烯。加氢反应4,在298.15~900 K温度范围内均小于 0,说明丁烯在低温条件下即可与氢气反应生成相应的丁烷。
从以上分析可知,丁烯在低温(298.15 K)时就可自发生成芳烃,丁烯具有热力学方面的优势。为了更好地促进混合C4原料中丁烷、丁烯最大限度地生成芳烃,混合 C4芳烃化反应的温度应控制在 655 K以上。
表1 各反应在不同温度下的Table 1 Standard molar enthalpy of reaction varies with temperature

表1 各反应在不同温度下的Table 1 Standard molar enthalpy of reaction varies with temperature
反应编号 298.15 K 400 K 500 K 600 K 700 K 800 K 900 K 1 000 KD / (kJ·mol-1)qm rH 1 93.99 93.51 92.77 91.87 90.89 89.91 89.00 88.26 2 71.98 71.85 71.30 70.51 69.62 68.71 67.84 67.06 3 125.77 127.19 128.21 128.98 129.59 130.02 130.31 130.57 4 -125.77 -127.19 -128.21 -128.98 -129.59 -130.02 -130.31 -130.57 5 544.66 557.39 567.87 576.09 582.37 587.14 590.85 593.99 6 1 083.88 1 110.68 1 132.48 1 149.42 1 162.30 1 172.11 179.89 1 186.74 7 270.54 277.53 283.11 287.54 291.04 293.84 296.11 298.05 8 1 071.14 1 100.90 1 124.38 1 142.19 1 155.52 1 165.68 1 173.99 1 181.80 9 590.61 607.56 621.27 632.25 641.07 648.26 654.32 659.74 10 167.36 175.82 183.25 189.15 193.62 197.08 199.91 202.26 11 203.51 220.35 235.04 246.55 255.20 261.96 267.70 272.72 12 19.00 23.15 26.70 29.57 31.87 33.80 35.48 36.90 13 -60.77 -43.82 -29.48 -18.64 -10.75 -4.50 1.17 6.63 14 -38.23 -28.40 -19.76 -12.66 -6.86 -1.84 2.75 6.87 15 125.01 128.81 131.92 134.21 135.79 136.91 137.79 138.59 16 102.17 106.27 109.49 111.76 113.30 114.37 115.26 116.13 17 144.77 150.34 154.91 158.56 161.46 163.82 165.80 167.47 18 7.08 10.94 14.14 16.46 18.07 19.29 20.43 21.61 19 22.22 26.70 30.42 33.31 35.56 37.45 39.21 40.90
表2 各反应在不同温度下的Table 2 Gibbs freeenergy ofreaction varies with temperature
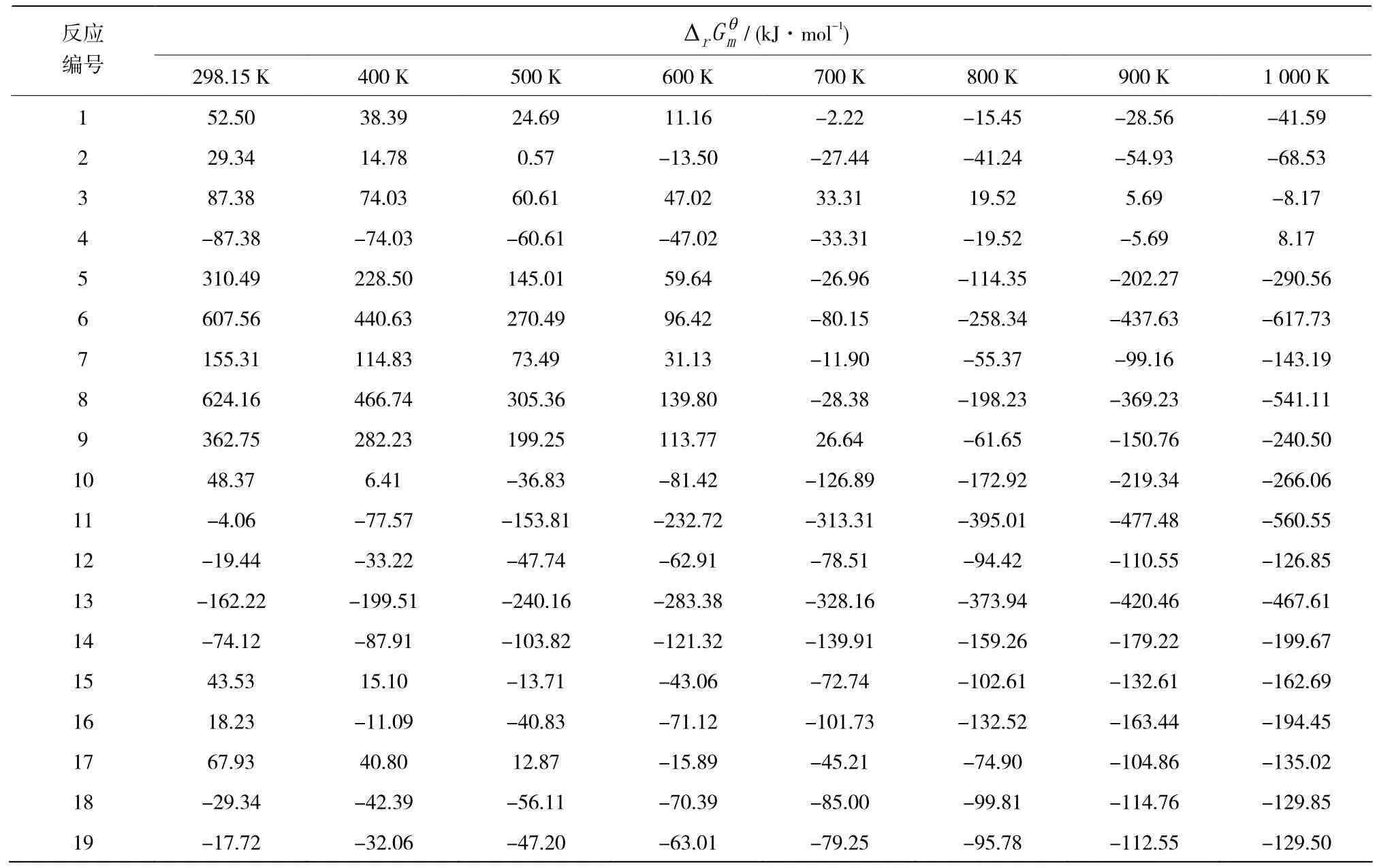
表2 各反应在不同温度下的Table 2 Gibbs freeenergy ofreaction varies with temperature
反应编号 298.15 K 400 K 500 K 600 K 700 K 800 K 900 K 1 000 KD / (kJ·mol-1)qm rG 1 52.50 38.39 24.69 11.16 -2.22 -15.45 -28.56 -41.59 2 29.34 14.78 0.57 -13.50 -27.44 -41.24 -54.93 -68.53 3 87.38 74.03 60.61 47.02 33.31 19.52 5.69 -8.17 4 -87.38 -74.03 -60.61 -47.02 -33.31 -19.52 -5.69 8.17 5 310.49 228.50 145.01 59.64 -26.96 -114.35 -202.27 -290.56 6 607.56 440.63 270.49 96.42 -80.15 -258.34 -437.63 -617.73 7 155.31 114.83 73.49 31.13 -11.90 -55.37 -99.16 -143.19 8 624.16 466.74 305.36 139.80 -28.38 -198.23 -369.23 -541.11 9 362.75 282.23 199.25 113.77 26.64 -61.65 -150.76 -240.50 10 48.37 6.41 -36.83 -81.42 -126.89 -172.92 -219.34 -266.06 11 -4.06 -77.57 -153.81 -232.72 -313.31 -395.01 -477.48 -560.55 12 -19.44 -33.22 -47.74 -62.91 -78.51 -94.42 -110.55 -126.85 13 -162.22 -199.51 -240.16 -283.38 -328.16 -373.94 -420.46 -467.61 14 -74.12 -87.91 -103.82 -121.32 -139.91 -159.26 -179.22 -199.67 15 43.53 15.10 -13.71 -43.06 -72.74 -102.61 -132.61 -162.69 16 18.23 -11.09 -40.83 -71.12 -101.73 -132.52 -163.44 -194.45 17 67.93 40.80 12.87 -15.89 -45.21 -74.90 -104.86 -135.02 18 -29.34 -42.39 -56.11 -70.39 -85.00 -99.81 -114.76 -129.85 19 -17.72 -32.06 -47.20 -63.01 -79.25 -95.78 -112.55 -129.50
3.3 各反应在不同温度下的
表3 各反应在不同温度下的Table 3 Equilibrium constants of reaction varies with temperature
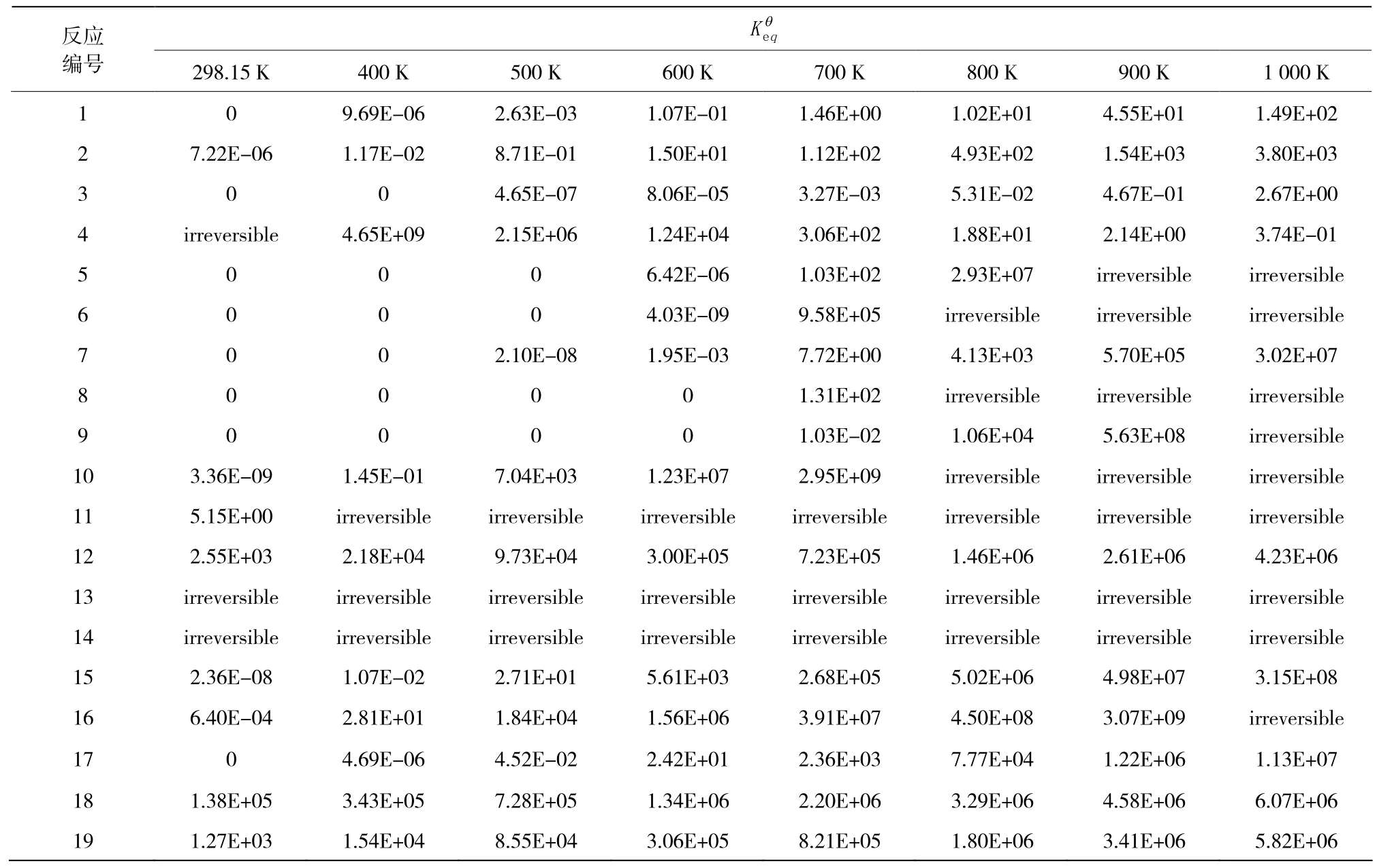
表3 各反应在不同温度下的Table 3 Equilibrium constants of reaction varies with temperature
注: <1.00E-09的反应标记为0,>1.00E+10的反应几乎完全进行,为不可逆反应,标记为irreversible。
反应编号 298.15 K 400 K 500 K 600 K 700 K 800 K 900 K 1 000 K Keqq 1 0 9.69E-06 2.63E-03 1.07E-01 1.46E+00 1.02E+01 4.55E+01 1.49E+02 2 7.22E-06 1.17E-02 8.71E-01 1.50E+01 1.12E+02 4.93E+02 1.54E+03 3.80E+03 3 0 0 4.65E-07 8.06E-05 3.27E-03 5.31E-02 4.67E-01 2.67E+00 4 irreversible 4.65E+09 2.15E+06 1.24E+04 3.06E+02 1.88E+01 2.14E+00 3.74E-01 5 0 0 0 6.42E-06 1.03E+02 2.93E+07 irreversible irreversible 6 0 0 0 4.03E-09 9.58E+05 irreversible irreversible irreversible 7 0 0 2.10E-08 1.95E-03 7.72E+00 4.13E+03 5.70E+05 3.02E+07 8 0 0 0 0 1.31E+02 irreversible irreversible irreversible 9 0 0 0 0 1.03E-02 1.06E+04 5.63E+08 irreversible 10 3.36E-09 1.45E-01 7.04E+03 1.23E+07 2.95E+09 irreversible irreversible irreversible 11 5.15E+00 irreversible irreversible irreversible irreversible irreversible irreversible irreversible 12 2.55E+03 2.18E+04 9.73E+04 3.00E+05 7.23E+05 1.46E+06 2.61E+06 4.23E+06 13 irreversible irreversible irreversible irreversible irreversible irreversible irreversible irreversible 14 irreversible irreversible irreversible irreversible irreversible irreversible irreversible irreversible 15 2.36E-08 1.07E-02 2.71E+01 5.61E+03 2.68E+05 5.02E+06 4.98E+07 3.15E+08 16 6.40E-04 2.81E+01 1.84E+04 1.56E+06 3.91E+07 4.50E+08 3.07E+09 irreversible 17 0 4.69E-06 4.52E-02 2.42E+01 2.36E+03 7.77E+04 1.22E+06 1.13E+07 18 1.38E+05 3.43E+05 7.28E+05 1.34E+06 2.20E+06 3.29E+06 4.58E+06 6.07E+06 19 1.27E+03 1.54E+04 8.55E+04 3.06E+05 8.21E+05 1.80E+06 3.41E+06 5.82E+06
4 结 论
(1) 从热力学的影响分析可知,温度是影响混合C4芳构化过程的重要因素。
(2) 相对于丁烷芳构化,在适宜的温度范围内,丁烯的存在对芳构化反应更有利,具有明显的热力学方面的优势。
(3) 在混合 C4芳构化工艺生产过程中,要想促进丁烷和丁烯最大限度地转化成芳烃,其反应温度应控制在655 K以上。
[1] 张英华, 路川, 张晓彤,等. 混合碳四在SO42-/TiO2/HZSM-5上低温芳构化研究[J]. 工业催化, 2006, 14(7): 23-26.
[2]郝代军, 朱建华, 王国良. 液化石油气制芳烃技术开发及工业应用[J] . 现代化工, 2006, 26(10) : 55- 60.
[3]王中乾. C4液化气非临氢低温芳构化反应的研究[D]. 大连: 大连理工大学, 2009.
[4]Lemmon Erik W., McLinden Mark O., Huber Marcia L. et al. NIST Standard Reference Database 23 (Fluids), REFPROP version 7.0 2002[C]. Physical and Chemical Properties Division, U.S. Secretary of Commerce.
[5] 胡英, 吕瑞东, 刘国杰,等. 物理化学(上册)[M]. 北京: 高等教育出版社, 1999: 40-221.

