早产儿视网膜病变患儿血清谷氨酸浓度变化及其相关关系
李志萍 吴焕卿 陈惠军
早产儿视网膜病变(retinopathy of prematurity,ROP)是一种眼部血管增殖性疾病,是当今世界儿童致盲的主要原因,在发达国家中,ROP的发病率为6%~18%[1],占儿童致盲的1/3;在我国随着 NICU的开展及早产儿抢救技术的提高,ROP的发病率逐年上升,但其发病机制尚不清楚,治疗效果仍不十分理想,寻找预防和治疗ROP的方法成为当今新生儿科和眼科医师共同关注的焦点。细胞凋亡是所有视网膜疾病的共同途径[1-2],高浓度谷氨酸诱导视网膜神经节细胞凋亡。本研究探讨谷氨酸浓度变化与ROP的关系,现报告如下。
1 资料与方法
1.1 一般资料 选取2009年1月至2013年7月新乡市中心医院收治的100例早产儿为研究对象,胎龄<34周或出生体质量 <2000 g,胎龄(32.36±1.34)周。
1.2 诊断标准 研究对象于生后4周或矫正胎龄32周由眼科医师进行间接眼底镜筛查并随访。ROP诊断标准[3-5]:发现视网膜无血管区,与血管区之间形成分界线(Ⅰ期);分界线隆起呈脊样(Ⅱ期);脊上视网膜血管扩张增生,伴纤维组织增生(Ⅲ期);纤维血管增生引起牵拉性视网膜脱离,先起于周边,逐渐向后极部发展(Ⅳ期);视网膜全脱离(Ⅴ期);视网膜后极部血管迂曲扩张(Plus病)。
1.3 检测方法 生后7 d常规无菌采取外周血1.5 mL,室温血液自然凝固10~20 min,离心20 min收集血清,后置于-20℃冰箱内保存,利用酶联免疫吸附试验测出OD值,利用已知样本浓度计算出谷氨酸浓度。矫正胎龄32周或生后4~6周检查眼底,如确诊为ROP,于生后6周(42 d)再次检查血清谷氨酸浓度。
2 结果
2.1 ROP诊断及分期结果 根据筛查结果分为3组,Ⅰ组为轻度 ROP(Ⅰ-Ⅱ期)共 36例,胎龄(32.32±1.34)周,出生体质量(1.83±0.25)kg;Ⅱ组为重度 ROP(Ⅲ-Ⅴ期)共18例,胎龄(30.30±0.81)周,出生体质量(1.44±0.17)kg;Ⅲ组为未发生 ROP的早产儿共 46例,胎龄(34.33±1.34)周,出生体质量(1.44±0.17)kg。各组之间胎龄、出生体质量比较差异均无统计学意义(均为P>0.05)。2.2 谷氨酸检测结果 各组生后不同时间血清谷氨酸浓度比较见表1。从表1可知,生后7 dⅢ组与Ⅰ组血清谷氨酸浓度比较,差异有统计学意义(t=2.418 5,P <0.05);Ⅲ组与Ⅱ组血清谷氨酸浓度比较,差异有显著统计学意义(t=6.083 4,P<0.001);Ⅰ组与Ⅱ组血清谷氨酸浓度比较,差异有统计学意义(t=3.796 43,P <0.05)。生后 42 d Ⅰ组与Ⅱ组血清谷氨酸浓度比较,差异有统计学意义(t=3.611 3,P <0.05)。
表1 各组生后不同时间血清谷氨酸浓度比较Table 1 Comparison of glutamate in serum at different time points after birth between three groups(,c/mmol·L -1)
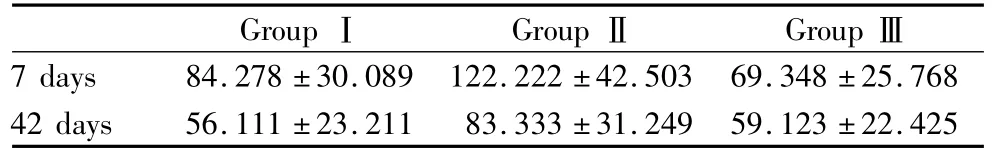
表1 各组生后不同时间血清谷氨酸浓度比较Table 1 Comparison of glutamate in serum at different time points after birth between three groups(,c/mmol·L -1)
GroupⅠ GroupⅡ GroupⅢ7 days 84.278±30.089 122.222±42.503 69.348±25.768 42 days 56.111±23.211 83.333±31.249 59.123±22.425
2.3 血清谷氨酸浓度与 ROP关系 以 ROP为因变量,血清谷氨酸为自变量,回归方程为 y=-13.532 3+0.197 0 x,血清谷氨酸升高与 ROP呈正相关(r=0.971 6,P <0.05)。
3 讨论
ROP是一种以视网膜血管发育不成熟和病理性新生血管增殖为主要病理改变的疾病,是儿童致盲的主要疾病之一,其发病机制不十分清楚。目前学者认为,ROP与早产、胎龄、吸氧浓度和吸氧时间密切相关[3-4],针对ROP尚无有效的治疗方法,早期诊断和早期治疗是ROP诊治的关键。
谷氨酸是一种兴奋性氨基酸递质,是视网膜上主要的兴奋性神经递质,光感受器、双极细胞和神经节细胞都是通过谷氨酸递质实现突触联系的,谷氨酸通过谷氨酸-谷氨酰胺循环保持一定浓度,在正常生理状态下,谷氨酸浓度维持靠谷氨酸转运体来完成,谷氨酸转运体能逆浓度梯度从胞外向胞内摄取谷氨酸,使胞外谷氨酸维持在较低水平,保护神经元不受谷氨酸毒性侵害,当谷氨酸转运体功能失调时,引起突触间隙或胞内谷氨酸蓄积或谷氨酸浓度低于正常水平,导致细胞凋亡的发生。视网膜谷氨酸转运体主要分布在 Müller细胞膜和突起上,Müller细胞通过谷氨酸天冬氨酸转运体摄取光感受器、双极细胞和神经节细胞释放的谷氨酸,并在细胞内合成谷氨酰胺,达到降低谷氨酸神经毒性作用。
在早产儿视网膜发育成熟过程中,视网膜缺氧缺血,谷氨酸释放,浓度升高,积聚的谷氨酸与相应受体结合,受体激活后引起下游的蛋白激酶为主的细胞内瀑布式级联反应,促进细胞外Ca2+内流,导致细胞内Ca2+浓度增加,同时,Ca2+释放和谷氨酸诱导的细胞去极化引起电压门控钙通道开放,Ca2+进一步内流,最终导致细胞内钙超载,干扰线粒体呼吸链功能,导致细胞死亡。此外,谷氨酸浓度升高造成视网膜继发性损伤,加重视网膜缺血缺氧,导致视网膜神经节细胞及Müller细胞释放血管生长因子增多,加重视网膜新生血管的产生,相对缺氧使视网膜血管闭塞、缺血造成谷氨酸释放增多,形成恶性循环,最终视网膜神经节细胞、光感受器细胞凋亡。Clarke等[5]提出视网膜疾病中光感受器细胞变性与谷氨酸等兴奋性氨基酸在局部积聚有关。多项研究证明,谷氨酸兴奋性毒性反应是触发视网膜缺血缺氧性神经细胞损伤级联反应的重要因素[6-8]。
本研究证实,血清谷氨酸浓度的升高与ROP呈正相关,陈惠军等[9]研究发现高氧致新生鼠视网膜损伤中谷氨酸的升高与视网膜神经节细胞凋亡呈正相关,朱远军等[10]证实视网膜缺血再灌注兔眼模型视网膜组织中游离谷氨酸升高是视网膜损害的机制之一。因此,谷氨酸升高是预测ROP的指标之一,早期发现ROP,阻断谷氨酸兴奋毒性作用,可以达到早治疗和减少ROP的发生、减轻ROP程度等作用,有助于临床医师更全面地观察ROP的发生、发展和预后。
1 Haine JL,Hauser MA,Schmidt S,Scott WK,Olson LM,Gallins P,et al.Complement factor H variant increases the risk of age-related macular degeneration[J].Science,2005,308(5720):419-421.
2 Maubare C,Hamel C.Genetics of retinitis pigmentosa metabolic classification and phenotype/genotype correlations[J].J Fr Ophtalmol,2005,28(1):71-92.
3 罗黎力,陈大鹏,屈艺,母得志.早产儿218例视网膜病变筛查分析[J].中华实用儿科临床杂志,2013,28(14):1058-1061.
4 中国内地新生儿专业发展现状调查协作组.国内109家医院早产儿视网膜病防治现状调查[J].中华实用儿科临床杂志,2013,28(2):86-89.
5 Clarke G,Collins RA,Leavitt BR,Andrews DF,Hayden MR,Lumsden CJ,et al.A one-hit model of cell death in inherited neuronal degenerations[J].Nature,2000,406(6792):195-199.
6 Tanaka K.Role of glutamate transporters in astrocytes[J].Brain Nerve,2007,59(7):677-688.
7 Shen Y,Liu XL,Yang XL.N-methyl-D-aspartate receptors in the retina[J].Mol Neurobiol,2006,34(3):163-179.
8 曲虹,牛膺筠,王建波.低氧预适应对新生人鼠视网膜神经元谷氨酸损伤的保护作用[J].眼科研究,2007,25(11):827-830.
9 陈惠军,宋舜意,李志萍,杨红梅,娄莹,杨廷桐.高氧致新生鼠视网膜损伤的分子机制探讨[J].中国新生儿杂志,2011,26(6):411-415.
10 朱远军,金敏,高宗银,杨为中,胡燕飞,郝绮红,等.雌激素对兔视网膜缺血再灌注损伤中谷氨酸浓度的影响[J].中华眼底病杂志,2007,23(9):321-323.

