视网膜光损伤中TIMP-1、ERK-1的表达及促红细胞生成素对其影响△
王颖立 牛膺筠
近年的研究发现年龄相关性黄斑变性(age-related macular degeneration,AMD)的病理改变[1]与脉络膜和玻璃膜上的基质金属蛋白酶(metrix metalloproteinases,MMPs)和基质金属蛋白酶抑制物(tissue inhibitor of metalloproteinases,TIMPs)水平的改变密切相关[2]。
众所周知,视网膜光损伤是研究视网膜变性类疾病(例如AMD)的良好动物模型[3]。因此本研究通过建立小鼠光损伤动物模型,着重观察视网膜色素上皮(retinal pigment epithelium,RPE)细胞中金属蛋白酶组织抑制剂-1(tissue inhibitor of metalloproteinase-1,TIMP-1)及细胞外信号调节激酶蛋白1(extracellular regulated proteinkinase-1,ERK-1)表达的变化,同时应用重组人促红细胞生成素(recombination human erythropoietin,rhEPO)进行小鼠腹腔注射,检测其产生的影响,以进一步完善我们对EPO视网膜神经保护作用的认识,从而为AMD的治疗寻求新的思路和方法。
1 材料与方法
1.1 材料
1.1.1 动物与分组 健康成年近交系 BALB/c小鼠52只(104眼),4周龄,体质量18 g左右,购自山东医科大学动物实验中心,雄性,动物基因背景为Rpe65 450Leu450,对光损伤具有高度敏感性。严格遵守SPF级小鼠喂养条件。实验动物及实验使用条件符合国家科学技术委员会的《实验动物管理条例》。将动物随机分为单纯光照组(24只)、EPO处理组(24只)和正常对照组(4只)。其中前两组按光照后处死时间的不同又分为6 h、12 h、36 h、72 h、96 h和7 d 6个亚组,每个亚组各4只8眼。
1.1.2 主要试剂 TIMP-1兔 IgG多抗、ERK-1羊IgG多抗(美国 Santa Cruz公司),封闭血清、复合消化液、PV6001免疫组织化学试剂盒、DAB显色试剂盒、APES黏片剂(北京中山生物技术有限公司),生物素化兔抗山羊抗体(武汉博士德生物技术有限公司),3000 U·mL-1rhEPO(沈阳三生制药公司)。
1.2 实验方法
1.2.1 实验前准备 将单纯光照组和EPO处理组小鼠在12 h明/12 h暗的循环光照环境中喂养10 d,暗适应10 h。
1.2.2 动物模型及给药 采用自制光照箱建立大鼠光损伤模型(光照箱由中国海洋大学光学研究室研制),单纯光照组小鼠光照前1 h在红光下用托品酰胺眼液散瞳,共2~3次后,置于6000 Lux光照箱中照射4 h;EPO处理组小鼠光照前2 h腹腔注射rhEPO,剂量为5000 U·kg-1,再散瞳置于同样条件光照箱中照射4 h。光照过程中,实验人员戴防护墨镜注视小鼠,当观察到小鼠闭睑时立刻敲动光照箱防止其闭睑。光照后将小鼠置于暗室中喂养,并分别于光照后6 h、12 h、36 h、72 h、96 h 及7 d 将动物处死。
1.2.3 标本的取材、固定与切片 将小鼠用颈椎脱臼法处死即刻摘除眼球,脱水、固定。将石蜡包埋好的眼球标本,以平行于视神经矢状轴为平面进行连续切片,厚约4 μm。
1.2.4 HE染色 石蜡切片彻底脱蜡、水化,苏木素染色5 min,氨水返蓝30 s,伊红染色30 s,脱水、透明,中性树胶封片[4];观察RPE细胞形态学变化。
1.2.5 免疫组织化学染色 烤片、脱蜡、水化,加体积分数3%H2O21滴,10 min后水洗、擦片;切片加1滴或者50 μL非免疫动物血清,放入湿盒10 min;切片加1滴或者50 μL一抗,湿盒内4℃冰箱过夜;PBS冲洗,振荡;切片加1滴或者50 μL PV6001,37℃孵育30 min,PBS冲洗;DAB溶液显色,自来水终止反应,流水冲洗2~3 min;苏木素复染15~20 s,自来水冲洗;酒精脱水、透明、中性树胶封片。
1.3 结果观察与数据处理 在光学显微镜下,TIMP-1、ERK-1蛋白阳性表达均为棕黄色,位于RPE细胞胞浆。阴性细胞经苏木素复染后,RPE细胞呈蓝色或浅蓝色。每只眼球取两张切片,应用Imagepro plus图像分析系统对免疫组织化学切片进行图像分析(每张切片取4个视野,以视神经为基准分别向两侧各取2个视野),计算每组8个眼球的平均OD值,作为阳性细胞的平均OD值,从而对RPE细胞中TIMP-1和ERK-1蛋白表达进行相对定量分析。
2 结果
2.1 HE染色结果
2.1.1 形态学观察 正常对照组 BALB/c小鼠视网膜结构层次分明,视杆细胞内、外节排列整齐规则,分界清晰;外核层排列紧密,染色均匀,RPE细胞呈单线状排列,细胞形态规整(图1)。
单纯光照组光照后6 h,视网膜杆状细胞外节轻微空泡变性,其余各层未见明显改变;光照后12 h,杆状细胞内、外节排列稍紊乱,外核层变薄,RPE细胞排列疏松;光照后36 h,内、外节排列紊乱,分界不清,外核层明显变薄,细胞间隙加大,出现核浓染及一些不规则细胞核,RPE细胞明显肿胀、边界不清、形态不规则;光照后7 d,内、外节出现大的空泡样变性,外核层部分消失,仅残留少量破碎的细胞核,RPE细胞出现丢失、双层现象(图2)。
EPO处理组,小鼠视网膜组织学改变较晚发生且不明显,光照后6 h和12 h,未见明显改变;光照后36 h,内、外节出现轻度空泡样变,RPE细胞出现轻度肿胀;光照后7 d,内、外节排列稍紊乱,外核层细胞间间隙加大,未见明显RPE细胞丢失、双层现象。
2.1.2 RPE细胞密度变化 正常对照组RPE细胞密度为(1.61±0.22)mm-2;随光照后时间延长,单纯光照组RPE细胞密度逐渐减少(表1),光照后7 d RPE细胞密度与正常对照组比较差异有统计学意义(P<0.01)。光照后相同时间点,EPO处理组的RPE细胞密度较单纯光照组稍有增加,光照后7 d二者差别有统计学意义(P<0.01)。

Figure 1 Normal mouse retinal tissue and RPE(arrow,HE,×400).Figure 2 RPE cell disappeared and RPE layer doubledecked at 7 days after irradiation in simple irradiation group(HE,×400) 图1 正常对照组小鼠视网膜组织以及RPE形态(箭头,HE,×400)。图2 单纯光照组光照后7 d RPE细胞出现丢失、双层现象(HE,×400)

表1 光照后不同时间点单纯光照组和EPO处理组RPE细胞密度变化Table 1 Changes of RPE cell density at different time after irradiation in two groups(cell density/cell·mm -2)
2.2 免疫组织化学染色
2.2.1 ERK-1免疫组织化学染色 ERK-1蛋白阳性表达为棕黄色,位于RPE细胞的胞浆。正常对照组视网膜组织无ERK-1阳性表达(图3)。单纯光照组:不同光照时间点,与正常对照组中RPE的ERK-1表达差异无统计学意义(均为P>0.05)。EPO处理组:从光照后6 h起,各亚组均可见到阳性表达细胞,且随光照后时间的推移,阳性表达呈现逐渐递增的趋势,光照后72 h表达强度达到高峰(图4),光照后7 d ERK-1阳性表达强度较前降低(表2);EPO处理组与正常对照组差异均有统计学意义(均为P<0.05)。光照后各个时间点,EPO处理组均较单纯光照组中ERK-1的表达明显增强(均为P<0.05,见表2)。
2.2.2 TIMP-1免疫组织化学染色 TIMP-1蛋白阳性表达为棕黄色,主要表达于RPE细胞的胞浆。正常对照组RPE细胞中可以检测到少量棕黄色染色,即TIMP-1弱阳性表达,OD值为23.75±5.75。单纯光照组:光照后各时间点RPE层TIMP-1阳性表达与正常对照组相比无明显变化(均为P>0.05)。EPO处理组:光照后6 h,RPE层开始出现明显TIMP-1阳性表达,随着光照后时间的推移,阳性RPE细胞棕黄色染色强度递增,光照后96 h TIMP-1表达强度达到高峰,而后TIMP-1在RPE层表达降低(表3)。
光照后6 h、7 d,单纯光照组和 EPO处理组中TIMP-1的表达差异均无统计学意义(均为 P>0.05),自光照后12 h起至光照后96 h,各时间点EPO处理组较单纯光照组中TIMP-1的表达增强(均为P <0.05,见表3)。
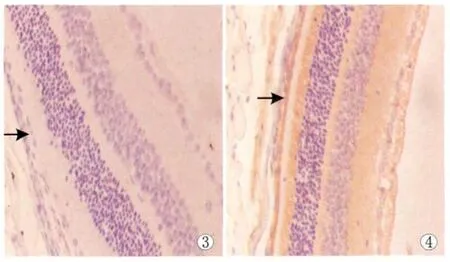
Figure 3 No ERK-1 expression in normal rat retinal tissue(×400).Figure 4 ERK-1 expression in RPE cell was increased at 72 hours after irradiation in EPO treated group(×400) 图3 正常对照组小鼠视网膜组织无ERK-1表达(×400)。图4 EPO处理组光照后72 h视网膜RPE细胞ERK-1表达明显增强(×400)
表2 光照后不同时间点RPE细胞ERK-1表达变化的情况Table 2 Expression of ERK-1 in RPE cell at different time after irradiation (IOD,)

表2 光照后不同时间点RPE细胞ERK-1表达变化的情况Table 2 Expression of ERK-1 in RPE cell at different time after irradiation (IOD,)
Note:SL:Simple light-induced group;ET:EPO treated group;Compared with control group,bP <0.05,cP <0.01
t P 6 hours 8 3.91±1.02 10.09±5.76b Time Case SL ET-2.988 2 <0.05 12 hours 8 4.25±1.11 33.15±3.32b-23.350 4 <0.05 36 hours 8 5.02±0.57 39.16±4.04c-23.667 2 <0.05 72 hours 8 3.76±2.90 49.22±3.93c-26.326 0 <0.05 96 hours 8 4.83±1.08 42.83±4.83c-21.716 4 <0.05 7 days 8 3.86±0.81 28.75±2.38c-28.002 3 <0.05
表3 光照后不同时间点RPE细胞TIMP-1的表达变化Table 3 Expression of TIMP-1 in RPE cell at different time after irradiation (IOD,)

表3 光照后不同时间点RPE细胞TIMP-1的表达变化Table 3 Expression of TIMP-1 in RPE cell at different time after irradiation (IOD,)
Note:Compared with control group,bP <0.05,cP <0.01(one-way ANOVA,Dunnett t test)
Time Case SL ET t P 6 hours 8 20.50±3.79 22.93±3.80 1.280 6 0.221 1 12 hours 8 26.25±5.36 31.05±3.22b 2.171 2 0.047 6 36 hours 8 25.62±7.57 38.16±4.04c 4.133 3 0.000 5 72 hours 8 26.59±8.45 42.62±4.93c 4.634 5 0.000 2 96 hours 8 24.83±5.08 48.83±7.83c 7.272 9 0.000 0 7 days 8 18.86±3.81 18.75±7.38c 0.037 5 0.970 6
2.2.3 TIMP-1与 ERK-1相关性 EPO处理组中TIMP-1的表达与 ERK-1的水平直线相关(图5)。EPO处理组RPE中TIMP-1的表达与ERK-1的表达正相关(r=0.79,P=0.03)。

Figure 5 Relationship scatterplot between TIMP-1 and ERK-1 expressions in RPE cell in EPO treated group EPO处理组RPE细胞中TIMP-1与ERK-1表达相关性分析散点图
3 讨论
EPO是一种主要影响红细胞生成的细胞因子,在临床试验中应用rhEPO可以模拟内源性EPO在神经系统发挥多种作用。在视网膜缺血、缺氧损伤中,rhEPO也表现出相应的神经保护和促神经细胞生长的作用[5]。以往的研究中[6],发现 rhEPO 腹腔注射后可通过小鼠血-视网膜屏障进入视网膜组织,并且可以有效抑制视网膜感光细胞凋亡,证明外源性EPO具有抑制光损伤造成的视网膜感光细胞凋亡的作用。本实验中EPO处理组小鼠RPE细胞组织学光损伤改变较晚发生且不明显,也进一步证实了这一结论。但是EPO到底是通过什么样的机制抑制了视网膜细胞的凋亡尚不清楚。
MMPs是参与细胞外基质降解的内源性蛋白水解酶。TIMPs是MMPs的内源性抑制剂,共有4种,其中TIMP-1广泛分布于组织和体液中[7]。在正常生理状态下,TIMPs与MMPs协同产生,维持动态平衡,在组织重建、肿瘤细胞迁移、血管生成、伤口愈合等过程中发挥关键作用。但是当这种平衡被打破时,可导致各种疾病和促进疾病的恶化。
RPE是血-视网膜屏障的重要组成部分,体外培养的RPE细胞能分泌 MMPs和 TIMPs[8]。AMD病变过程中MMPs/TIMPs平衡的改变可能与RPE分泌作用的变化密切相关。因此本研究中,我们将RPE细胞随着光损伤后时间的延长TIMP-1表达的变化作为观察的重点。在研究中发现,光照后随时间延长,EPO处理组中TIMP-1较单纯光照组表达明显增强。这证明外源性的EPO可以增加RPE细胞TIMP-1的表达。
TIMP-1的主要功能是对 MMP-2、MMP-9的抑制作用,调节细胞外基质的代谢;同时还在细胞生长、繁殖、凋亡及刺激血管生成等生理和病理学方面发挥一定的作用[9]。因此我们考虑,小鼠视网膜光损伤后,给予外源性的EPO,RPE细胞TIMP-1的表达增加可能发挥以下几方面作用:(1)可以与增多的MMP-2、MMP-9相拮抗,抑制其过强的细胞外基质降解作用,促进瘢痕的生成,重建MMPs/TIMPs二者的平衡状态,维持玻璃膜正常的结构、功能和视网膜光感受器正常的生理功能。(2)TIMP-1可以活化c-Src、PI3-K、Akt等抗凋亡因子,发挥其抗细胞凋亡的作用[10],抑制光损伤造成的感光细胞、RPE等的凋亡。(3)通过影响内皮细胞的趋化性,抑制新生血管生成过程中的内皮细胞迁移[11],从而抑制视网膜脉络膜新生血管的生成。以上这些作用还需要进一步实验证实。总之,我们可以认为外源性EPO发挥对视网膜光损伤的保护作用可能与增加RPE细胞TIMP-1的表达有关。
此外,本研究还发现,EPO处理组从光照后6 h起,各亚组均可见到ERK-1阳性表达的RPE细胞,且随光照后时间的推移阳性表达呈现逐渐递增的趋势,光照后72 h表达强度达到高峰,并且 ERK-1表达增高的趋势与TIMP-1直线相关。因此推测,EPO引起的TIMP-1的分泌和表达可能经由MAPK途径。
总之,视网膜光损伤过程中MMPs/TIMPs平衡破坏的发现,为AMD等与光照损伤有关的疾病的研究打开了一个新的视窗。EPO对RPE细胞TIMP-1分泌调节作用的证实,也为我们进一步分析EPO发挥视网膜光损伤保护作用的机制提供了依据。
1 闫焱,王玲.年龄相关性黄斑变性发病机制的研究进展[J].国际眼科杂志,2008,9(8):1888-1890.
2 Leu ST,Batni S,Radeke MJ,Johnson LV,Anderson DH,Clegg DO.Drusen are cold spots for proteolysis:expression of matrix metalloproteinases and their tissue inhibitor proteins in age-related macular degeneration[J].Exp Eye Res,2002,74(1):141-154.
3 Organisciak DT,Darrow RM,Barsalou L.Light history and age-related changes in retinal light damage[J].Invest Ophthalmol Vis Sci,1998,39(7):1107-1116.
4 Stevens H,Mainwaring RL.Modified hematoxylin and eosin staining technique for paraffin sections[J].Am J Med Technol,1967,33(2):148-149.
5 Junk AK,Mammis A,Savitz SI,Singh M,Roth S,Malhotra S,et al.Erythropoietin administration protects retinal neurons from acute ischemia-reperfusion injury[J].Proc Natl Acad Sci USA,2002,99(16):10659-10664.
6 张跃红,牛膺筠,王红云,周占宇,刘成桂.低氧预适应对小鼠视网膜光感受器细胞光损伤的防护作用[J].中华眼科杂志,2005,41(7):631-635.
7 Visse R,Hideaki N.Matrix metalloproteinases and tissue inhibitors of metalloproteinases structure,function,and biochemistry[J].Circ Res,2003,92(3):827-839.
8 Yang C,Zeng S,Lv M.Effect of shRNA inhibiting HiF1alpha gene on TIMP1 expression in RPE cells[J].J Huazhong Univ Sci Technol Med Sci,2006,26(1):133-136.
9 Walther SE,Denhardt DT.Directed mutagenesis reveals that two histidines in tissue inhibitor of metalloproteinase-1 are each essential for the suppression of cell migration,invasion,and tumorigenicity[J].Cell Growth Differ,1996,7(12):1579-1588.
10 Lee SJ,Yoo HJ,Bae YS,Kim HJ,Lee ST.TIMP-1 inhibits apoptosis in breast carcinoma cells via a pathway involving pertussis toxin-sensitive G protein and c-Src[J].Biochem Biophys Res Commun,2003,312(4):1196-1201.
11 Thorgeirsson UP,Yoshiji H,Sinha CC,Gomez DE.Breast cancer;tumor neovasculature and effect of tissue inhibitor of metalloproteinases 1(TIMP-1)on angiogenesis[J].In Vivo,1996,10(2):137-144.

