局部应用地塞米松对翼状胬肉组织中趋化因子受体CCR3表达的影响及意义△
赫雪飞 刘高勤 陈志刚 陆培荣
翼状胬肉是眼科常见病、多发病,其确切发病机制尚不明了。病理上翼状胬肉可见较多的新生血管及纤维增生性改变,其特征是细胞增殖、组织重组及血管新生[1]。CC-类趋化因子是一类具有结构相似性、相对分子质量为8000~11 000的细胞因子样分泌蛋白,与其相应受体结合后参与细胞增殖、迁移以及血管新生等多种生物学行为过程[2-3]。CC-类趋化因子及其受体在调控血管新生及白细胞的迁移过程中起到重要作用[4],因而CC-类趋化因子及其受体可能在翼状胬肉的发病发展过程中起重要作用。我们前期研究发现CCR3信号促进实验性角膜新生血管的发生[5]。因此推测CCR3信号可能参与翼状胬肉的发生发展。本实验采用RT-PCR和免疫组织化学法检测CCR3在翼状胬肉组织中的表达,并分析局部应用地塞米松后CCR3表达的变化,为明确CCR3信号在翼状胬肉发病中所起的作用奠定基础,并分析地塞米松在预防翼状胬肉术后复发中的可能作用。
1 材料与方法
1.1 试剂 RNeasy Mini Kit及RNALater购自Qiagen公司;rTaq酶、逆转录试剂盒均购自日本TaKaRa生物技术公司;引物由南京金斯瑞公司合成;多聚甲醛、TAE、琼脂糖、DEPC水等购自上海生物工程技术有限公司;兔抗人 CCR3抗体购自美国 BD Biosciences公司;免疫组织化学试剂盒购自武汉博士德生物工程有限公司;封片剂购自美国Dako公司;其他试剂均为国产分析纯。
1.2 样本来源及分组 典型的翼状胬肉组织来源于在我院行翼状胬肉切除术的患者,共30例,男9例,女21例,年龄44~69(56.5±7.1)岁。所有患者均无其他角结膜疾病,翼状胬肉均长入角膜缘内3~4 mm,无外伤及手术史。确诊后均行翼状胬肉切除联合带角膜缘上皮的自体结膜移植术。事先征得患者同意,随机分为用药组15例,对照组15例。用药组术前2周局部滴用3 g·L-1妥布霉素地塞米松眼液(典必舒),每日3次,每次1滴;对照组术前2周滴用3 g·L-1妥布霉素眼液(托百士),每日3次,每次1滴。用药前及术前监测眼压无明显变化。术中切除组织后将其分成3份,沿翼状胬肉长轴剪切,每份均包含头部、颈部及体部的上皮组织、纤维血管组织,分别用于RT-PCR、免疫组织化学和Western blot检测。其中用于RT-PCR检测的样本立即置RNA Later保存液中保存于-86℃低温冰箱,1周内提取总RNA。免疫组织化学检测样本使用40 g·L-1多聚甲醛溶液固定,而Western blot检测样本则置-86℃低温冰箱冷冻保存。
1.3 RT-PCR检测CCR3 mRNA在翼状胬肉组织中的表达 取出保存于RNA Later中的翼状胬肉样本,应用Qiagen公司的mRNA Mini试剂盒抽取角膜组织的总 RNA,紫外分光光度计测定 A260/280>1.8。20 μL逆转录体系中含5 μg总RNA在逆转录酶催化下42℃逆转录1 h,合成cDNA。PCR反应体系 25 μL,包含0.5 μL cDNA 模板,dNTP 200 μmol·L-1,人趋化因子受体 CCR3 引物(表1)1 mmol·L-1及rTaq DNA聚合酶1 U在PTC-100上扩增。起始热变性94℃ 2 min;接以94℃ 30 s,58℃ 30 s,72℃30 s,35个循环;最后续以72℃ 10 min延伸反应产物。以GAPDH(25个循环反应,引物见表1)为内对照。取扩增后产物10 μL在15 g·L-1琼脂糖凝胶中电泳并进行溴化乙锭染色,1 kb DNA Ladder作为Marker标记DNA分子量,经凝胶成像分析系统观察DNA电泳条带,获取数码图像,经NIH Image Analysis software分析处理,得出以GAPDH为对照的相对值[6]。

表1 RT-PCR引物序列与退火温度Table 1 Sequences of primers and annealing temperature of RT-PCR
1.4 免疫组织化学染色检测CCR3在翼状胬肉组织中的表达及分布 组织经40 g·L-1多聚甲醛固定,蔗糖梯度脱水后,OCT包埋冰冻,切片,常规PBS洗片。体积分数0.3%H2O2孵育30 min,以清除内源性过氧化物酶。PBS洗涤3~5 min。加入正常血清封闭,置于室温湿盒1 h。吸去封闭液,加以稀释液配制的抗人CCR3的一抗工作液,4℃过夜。PBS洗涤3~5 min,3次。加以稀释液配制的生物素化二抗工作液,室温1 h。PBS洗涤3~5 min,3次。加以稀释液配制的亲和素-辣根过氧化物酶复合物室温湿盒中孵育1 h。PBS洗涤3~5 min,3次。DAB染色。镜下控制显色强度,显色完成后 PBS洗涤10 min,终止显色。苏木素复染封片[7]。
1.5 Western blot法检测翼状胬肉样本中 CCR3蛋白的表达 SDS-PAGE结束后,进行免疫印迹。硝酸纤维膜用封闭液封闭,4℃过夜。第2天加入兔抗人CCR3抗体,室温孵育1 h,用TBST洗去未结合的抗体,加入辣根过氧化物酶羊抗兔IgG多抗,室温孵育1 h,加入底物ECLA和ECLB混合液显色。底片曝光后扫描图片,经 NIH Image Analysis software分析处理,得出以GAPDH为对照的相对表达值[8]。
1.6 统计学分析 采用SPSS 18.0统计学软件进行统计分析。本研究测量指标的数据资料用W检验呈正态分布,以表示,组间均数经 Levene检验方差齐性。采用完全随机分组量水平实验设计,对照组与用药组之间各测量指标的差异比较均采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 CCR3 mRNA在翼状胬肉组织中的表达及差异 CCR3 mRNA在所有翼状胬肉组织中均有不同程度的表达(图1A),但用药组明显低于对照组,差异有统计学意义(t=-5.713,P=0.013;图1B),提示翼状胬肉组织中CCR3表达水平的改变与药物作用相关。

Figure 1 Expression of CCR3 mRNA in pterygium tissue.A:Representative graphs of CCR3 mRNA expression in dexamethasone(dex)group and control(con)group(5 cases in each group);B:CCR3 mRNA relative expression level in dexamethasone group and control group 翼状胬肉组织中CCR3 mRNA的表达。A:用药组和对照组CCR3 mRNA表达的代表图(每组选5例);B:用药组和对照组CCR3 mRNA表达的相对值
2.2 CCR3在翼状胬肉组织中的表达及分布 30例胬肉组织中均有不同程度的CCR3表达,其表达主要分布在结膜上皮细胞及部分血管内皮细胞上,镜下见用药组CCR3的表达较对照组表达低(图2)。
2.3 CCR3蛋白在翼状胬肉组织中表达的差异30例胬肉组织标本中均有不同程度的CCR3蛋白的表达。经内参GAPDH半定量分析法分析比较发现,用药组CCR3的蛋白表达明显低于对照组,差异有统计学意义(t=-3.915,P=0.001;图 3)。
3 讨论
翼状胬肉是一慢性增生性眼病,临床表现为新生的组织不断生长、增厚,并逐渐侵入角膜,手术切除后易复发,其确切发病机制不明。病理学研究表明,翼状胬肉组织中伴有大量增生的成纤维细胞、血管增生和退变,以及球结膜上皮细胞的异常增殖[1]。而地塞米松属于皮质类固醇激素,能抑制免疫反应,抑制成纤维细胞的生长,诱导细胞凋亡,常常应用于翼状胬肉术后,可抑制增生结膜向角膜缘生长,从而防止术后复发。近年研究认为翼状胬肉的发病与组织中 IL-1、IL-6、IL-8、TNF-α、bFGF 等多种细胞因子的表达增高相关[9]。有研究报道[10],术前应用地塞米松可减少术后复发,本研究为了探索趋化因子CCR3在翼状胬肉术后复发中的作用,采用术前应用3 g·L-1妥布霉素地塞米松眼液局部滴眼,观察翼状胬肉组织内CCR3表达的变化。
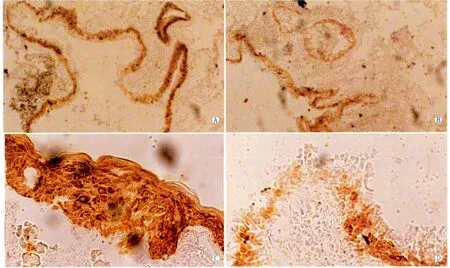
Figure 2 Immunocytochemical analysis showed CCR3 protein in pterygium tissue in control group and dexamethasone group.A,C:Control group;B,D:Dexamethasone group(A and B:×100;C and D:×400) 免疫组织化学分析对照组和用药组CCR3在翼状胬肉组织中的分布。A、C:对照组;B、D 用药组(A、B:×100;C、D:×400)

Figure 3 Expression of CCR3 in dexamethasone group and control group by Western blot.A:Representative graphs of CCR3 protein expression in dexamethasone group and control group(5 cases in each group);B:CCR3 protein relative expression level in dexamethasone group and control group Western blot检测用药组和对照组CCR3蛋白表达。A:用药组和对照组CCR3蛋白表达的代表图(每组选5例);B:用药组和对照组CCR3蛋白表达的相对值
CCR3及其配体 Eotaxin是与炎症、血管发生等相关的重要的趋化因子-受体信号通路。以往报道认为Eotaxin表达于年龄相关性黄斑变性患者视网膜色素上皮层[11]。Eotaxin能通过其受体 CCR3发挥作用,促进年龄相关性黄斑变性患者脉络膜新生血管的形成[12]。但CCR3信号在翼状胬肉发病及发展过程中的作用的研究还不多见。我们前期研究发现CCR3信号在实验性角膜新生血管形成过程中发挥重要作用。使用CCR3拮抗剂抑制CCR3表达后,角膜新生血管的发生明显降低。提示CCR3信号是角膜新生血管发生的促进因素。为进一步探讨CCR3信号与翼状胬肉发病及发展的相关性,本研究收集了人的翼状胬肉标本,通过检测CCR3基因和蛋白水平的表达,了解CCR3在翼状胬肉组织中的分布情况以及表达程度,初步分析和判断出 CCR3信号与翼状胬肉的发病关系。
本研究中翼状胬肉标本根据术前用药不同分为两组:用药组和对照组。病理性新生血管的发生是翼状胬肉发病的根本因素,而用药组患者使用的地塞米松具有抑制新生血管发生发展的作用,从而具有控制翼状胬肉生长的效果。研究检测结果显示用药组翼状胬肉组织内CCR3 mRNA和蛋白水平的表达均较对照组明显降低。同时,CCR3在翼状胬肉组织上皮和新生血管内皮细胞中有不同程度的表达。提示CCR3信号极有可能是翼状胬肉发病及发展过程中重要的参与因素。
我们课题组前期体外实验研究了CCR3信号参与调节人视网膜血管内皮细胞的管腔形成能力,证实CCR3能促进其管腔形成及细胞增殖以及促进NOS表达[13]。本研究中,用药组患者局部使用地塞米松后引起CCR3表达下降,提示CCR3信号与药物干预具有直接相关性。通过使用 CCR3拮抗剂、以CCR3信号作为干预靶点控制翼状胬肉及其他新生血管性眼病的发生发展是值得进一步深入探索的良好路径。
1 Coroneo MT,Di Girolamo N,Wakefield D.The pathogenesis of pterygia[J].Curr Opin Ophthalmol,1999,10(4):282-288.
2 Lu P,Nakamoto Y,Nemoto-Sasaki Y,Fujii C,Wang H,Hashii M,et al.Potential interaction between CCR1 and its ligand,CCL3,induced by endogenously produced interleukin-1 in human hepatomas[J].Am J Pathol,2003,162(4):1249-1258.
3 Yang X,Lu P,Ishida Y,Kuziel WA,Fujii C,Mukaida N.Attenuated liver tumor formation in the absence of CCR2 with a concomitant reduction in the accumulation of hepatic stellate cells,macrophages and neovascularization[J].Int J Cancer,2006,118(2):335-345.
4 Hwang J,Son KN,Kim CW,Ko J,Na DS,Kwon BS,et al.Human CC chemokine CCL23,a ligand for CCR1,induces endothelial cell migration and promotes angiogenesis[J].Cytokine,2005,30(5):254-263.
5 Zhou WJ,Liu GQ,Li LB,Zhang XG,Lu PR.Inhibitory effect of CCR3 signal on alkali-induced corneal neovascularization[J].Int J Ophthalmol,2012,5(3):251-257.
6 刘高勤,陈磊,肖艳辉,陈志刚,陆培荣.血管内皮钙粘蛋白对实验性角膜新生血管的作用及机制[J].中华眼视光学与视觉科学杂志,2013,15(3):174-180.
7 Liu G,Lu P,Li L,Jin H,He X,Mukaida N,et al.Critical role of SDF-1α-induced progenitor cell recruitment and macrophage VEGF production in the experimental corneal neovascularization[J].Mol Vis,2011,17:2129-2138.
8 刘高勤,陈源,陈磊,肖艳辉,陈志刚,陆培荣.一氧化氮合成酶及其抑制剂在碱烧伤诱导的角膜新生血管中的作用[J].中华实验眼科杂志,2013,31(10):908-913.
9 Di Girolamo N,Chui J,Coroneo MT,Wakefield D.Pathogenesis of pterygia:role of cytokines,growth factors,and matrix metalloproteinases[J].Prog Retin Eye Res,2004,23(2):195-228.
10 邓文香,吴良成.术前控制局部炎症对翼状胬肉术后复发的影响[J].中国眼耳鼻喉科杂志,2003,3(6):389.
11 Mo FM,Proia AD,Johnson WH,Cyr D,Lashkari K.Interferon gammainducible protein-10(IP-10)and eotaxin as biomarkers in age-related macular degeneration[J].Invest Ophthalmol Vis Sci,2010,51(8):4226-4236.
12 Ahmad I,Balasubramanian S,Del Debbio CB,Parameswaran S,Katz AR,Toris C,et al.Regulation of ocular angiogenesis by Notch signaling:implications in neovascular age-related macular degeneration[J].Invest Ophthalmol Vis Sci,2011,52(6):2868-2878.
13 赫雪飞,刘高勤,陈志刚,周文娟,肖艳辉,陆培荣.CCR3拮抗剂对视网膜血管内皮细胞管腔形成的影响及机制的研究[J].眼科新进展,2013,33(12):1106-1109,1114.

