兔球虫PCR检测方法的改进和应用*
汪运舟 陶鸽如 崔玉娟 李 超 王 丹 焦雅清索 勋 刘贤勇
(中国农业大学动物医学院,北京 100193)
兔艾美耳球虫是一类专性寄生于兔消化系统的寄生原虫,能够引起严重的兔球虫病。当前兔球虫共有11个有效种,各个种之间致病性存在较大的差异,对兔群的危害程度也不尽相同。因此有效的虫种鉴别,对评估球虫病暴发的风险有着十分重要的意义。
传统兔球虫的检测方法主要是利用饱和食盐水漂浮观察粪便中球虫卵囊,根据形态学差异进行虫种区分(Pakandl, 2009);随着PCR技术的应用,对虫种间高度特异的靶基因进行检测,可以更加灵敏准确地鉴定球虫种类。Oliveira等(2011)利用11种兔球虫ITS序列设计特异性引物,从而建立了能够区分11个兔球虫种的PCR检测方法;Yan等(2013)建立了兔球虫多重PCR检测技术,可以对多个高致病性虫种进行鉴定。但是PCR检测需要一定量的卵囊制备DNA模板,当样品中卵囊含量较少时,制备的基因组含量不易达到PCR检测的阈值,使其应用受到了限制。因此提高检测的灵敏度,克服卵囊数量少的阻碍,对于该技术在田间检测中更广泛的应用有着重要意义(Barbaraetal., 2008)。
当前全基因组扩增技术(Whole genome amplification,WGA)能够对微量样品中的DNA进行随机扩增,扩大初始模板,提高PCR的灵敏度和检测的成功率(Hawkinsetal., 2002)。基于该技术,我们建立了兔球虫单卵囊PCR技术,能够在单个卵囊的水平上进行虫种鉴定,从而大大提高PCR反应的灵敏度(Wangetal., 2014)。因此,将该技术应用于田间样品的检测有着较大的可行性。
本研究对田间样品卵囊裂解过程进行优化,引入WGA技术处理制备后的基因组模板,以提高后续PCR反应的灵敏度,最后通过对田间样品的检测,验证优化后的方法在田间样品检测中的可应用性。
1 材料与方法
1.1 卵囊样品
用于验证裂解方法的卵囊:实验室保存的斯氏艾美耳球虫Eimeriastiedai张家口分离株。田间样品为实验室保存的采集自河北省多家新西兰白兔养殖场的兔粪样品。
1.2 卵囊裂解液
取10% 的SDS溶液溶液,用无菌去离子水倍比稀释,使终浓度分别为0.01%、0.1%和1%,作为卵囊裂解液;蛋白酶K(10 mg/mL)购自德国默克公司。
1.3 单卵囊的分离与裂解
取斯氏艾美耳球虫卵囊,利用倍比稀释法稀释至约1~2个/μL。将卵囊悬液滴至0.5 cm×0.5 cm的透析膜上,用镊子将带有卵囊的透析膜移入含有5 μL卵囊裂解液(0.01%、0.1%或1%SDS)的PCR管中;将PCR管置于液氮中反复冻融5次,之后加入0.5 μL蛋白酶K(20 mmol/L),55℃孵育2 h,95℃孵育30 min以灭活蛋白酶K。同时验证化学裂解和不同方法单独处理后的裂解效果,不同裂解程序见表1,通过对裂解处理样品进行PCR检测,确定最佳裂解方法。
1.4 田间样品的纯化
本研究所用的田间样品中卵囊含量较低,低于或接近麦克马斯特计数法的检测阈值(每毫升不足100个卵囊),因此须先用饱和盐水浓集法对卵囊进行富集。取田间粪便样品混液1 mL,3 600 r/min离心5 min,弃去上清;沉淀中加入饱和食盐水,重悬,3 600 r/min离心5 min,用移液器吸取含卵囊的上清移至另一离心管中;加入约5倍体积的无菌双蒸水,3 600 r/min离心5 min,弃去上清;沉淀即为样品中卵囊。沉淀用5 μL卵囊裂解液(SDS)重悬后进行裂解处理,方法见1.3。样品卵囊用于PCR检测前进行形态学观察。
1.5 全基因组扩增
卵囊裂解产物进行全基因组扩增。向卵囊裂解产物中加10×Phi29 DNA 聚合酶缓冲液1 μL,随机引物(100 μmol/L)2.5 μL,95℃加热3 min,立即置于冰上冰浴15 min;加入0.5 μL dNTP(10 mmol/L),0.5 μL 100 ×BSA,0.5 μL Phi 29 DNA聚合酶(10 U/μL,NEB公司),30℃温育过夜;过夜产物65℃温育10 min,使Phi 29 DNA聚合酶失活;取1 μL 上述全基因扩增产物作为模板进行PCR反应。
1.6 ITS-1序列的扩增
兔球虫属特异性和种特异性ITS-1序列引物根据Oliveira(2011)报道进行合成。实验前将所有11对引物序列与NCBI已知各虫种ITS-1序列进行比对,确定各对特异性引物仅能与特定序列结合,而不能与其他虫种ITS-1序列结合,具有良好的特异性。选用巢式PCR进行检测,首先将全基因组扩增产物取1 μL作为模版,利用兔球虫属特异性引物进行PCR扩增,再以第一轮PCR扩增产物1 μL作为模板进行种特异性引物扩增。两轮PCR扩增体系与程序相同,扩增体系为:上下游特异性引物各0.5 μL(25 μmol/L),2×Taq Mix 12.5 μL(CwBio),ddH2O 10.5 μL,模板1 μL;反应体系为94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,共计25个循环,72℃ 10 min。PCR产物进行琼脂糖凝胶电泳检测,特异性条带回收后测序,结果与NCBI已报道的兔球虫ITS-1序列进行比对。
2 结果
2.1 兔球虫PCR检测方法的优化
根据表1的不同方法,我们对单个斯氏艾美耳球虫卵囊进行了裂解,裂解产物进行WGA扩增后用于PCR检测。结果显示结合液氮冻融、0.01% SDS和蛋白酶K消化的方法能够有效裂解卵囊释放基因组,处理后的产物能够成功进行PCR扩增(图1);而使用其他方法,则因为裂解不充分或者有抑制PCR成分而扩增效果不佳(表1)。利用优化后的裂解方法,我们对10个斯氏艾美耳球虫单个卵囊进行了扩增,PCR后均获得相应大小的条带,测序结果显示扩增成功(图2)。结果表明利用优化后的裂解方法,结合WGA技术对卵囊模板进行预扩增能够保证基因组模板的含量,可在单个卵囊的水平上进行虫种鉴定,体现了较高的灵敏度。
2.2 田间样品的PCR检测
对10份田间样品,我们首先进行了镜检,通过形态学特征对其中的卵囊种类进行判断。之后利用优化后的方法,进行PCR检测。结果显示10份样品的PCR扩增均获成功,图3为其中一份卵囊样品的PCR检测结果。各虫种特异性引物所对应泳道中出现的条带大小其对应大小相吻合;我们选取11份代表各虫种的PCR产物进行测序,测序结果表明各种特异性引物所对应的产物序列,均为其所对应的虫种,序列比对后相似性均大于97%,证明PCR方法成功鉴定了样品中所含虫种。10份样品的成功检测表明了优化后的PCR检测方法能够用于田间卵囊含量较少的样品检测。
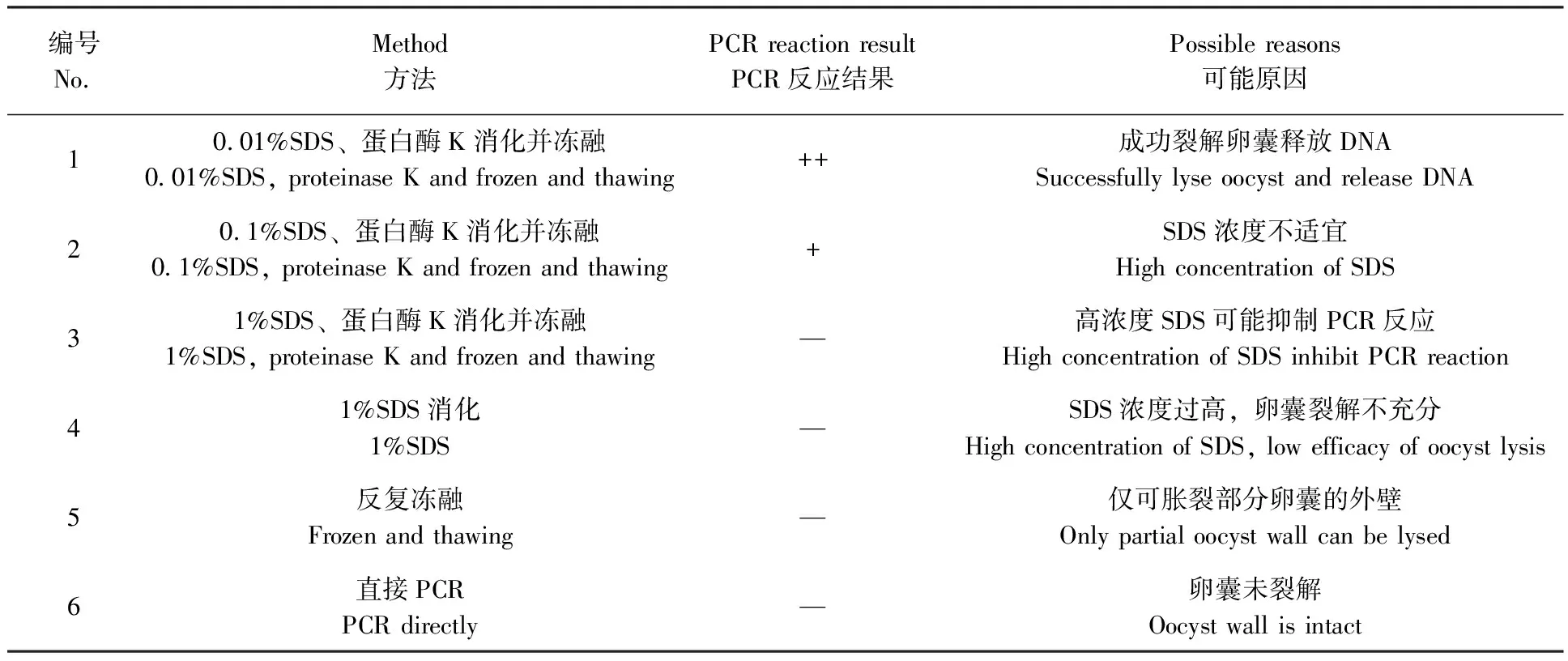
表 1 不同裂解方法以及效果Tab. 1 The comparison of the effect with different lysis methods
注:++ 代表成功扩增,+代表部分能够扩增,— 代表扩增失败。
Note: ++ represents fully successful amplification, + represents partially successful amplification, — represents negative amplification.
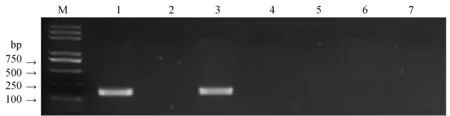
图1 不同裂解方法裂解后斯氏艾美耳球虫PCR检测结果Fig.1 PCR detection results of E. stiedai with single oocyst after different lysis methods1~6: 不同裂解方法(表1)裂解后获得DNA进行PCR反应的电泳结果; 7: 为阴性对照; M:DNA marker D2000 plus。1-6: Individual PCR product after different lysis methods (Tab. 1); 7: Negative control; M:DNA marker D2000 plus.
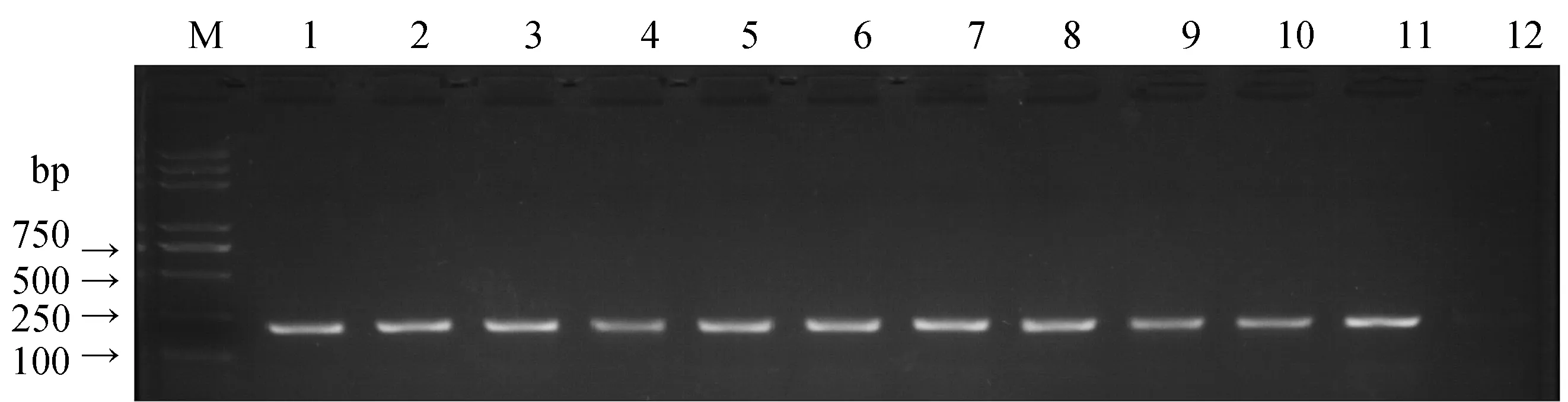
图2 斯氏艾美耳球虫单卵囊PCR检测结果Fig. 2 Single oocyst PCR detection results of E. stiedaiwith single oocyst1~10: 10个斯氏艾美耳球虫单卵囊PCR扩增产物; 11: 阳性对照;M:DNA marker D2000 plus;12 :阴性对照。1-10: Ten single oocyst PCP product of E. stiedai individually;11: Positive control; M: DNA marker D2000 plus; 12: Negative control.
2.3 形态学观察与PCR检测结果比较
对形态学鉴定结果与PCR检测结果进行比较。结果显示,样品中形态学鉴定出的虫种都可以应用PCR方法检测确认,符合率100%(表2);其中有6份田间样品中含有大量未孢子化的卵囊,因此无法从外残体、卵膜孔的特征等方面进行具体的虫种鉴定,因此依据PCR鉴定的方法对其虫种进行了判定。总体来看,对于样品中形态特征明显的虫种检测呈现了良好的一致性,对于不易判断的虫种,PCR检测给予更为可靠的检测结果。
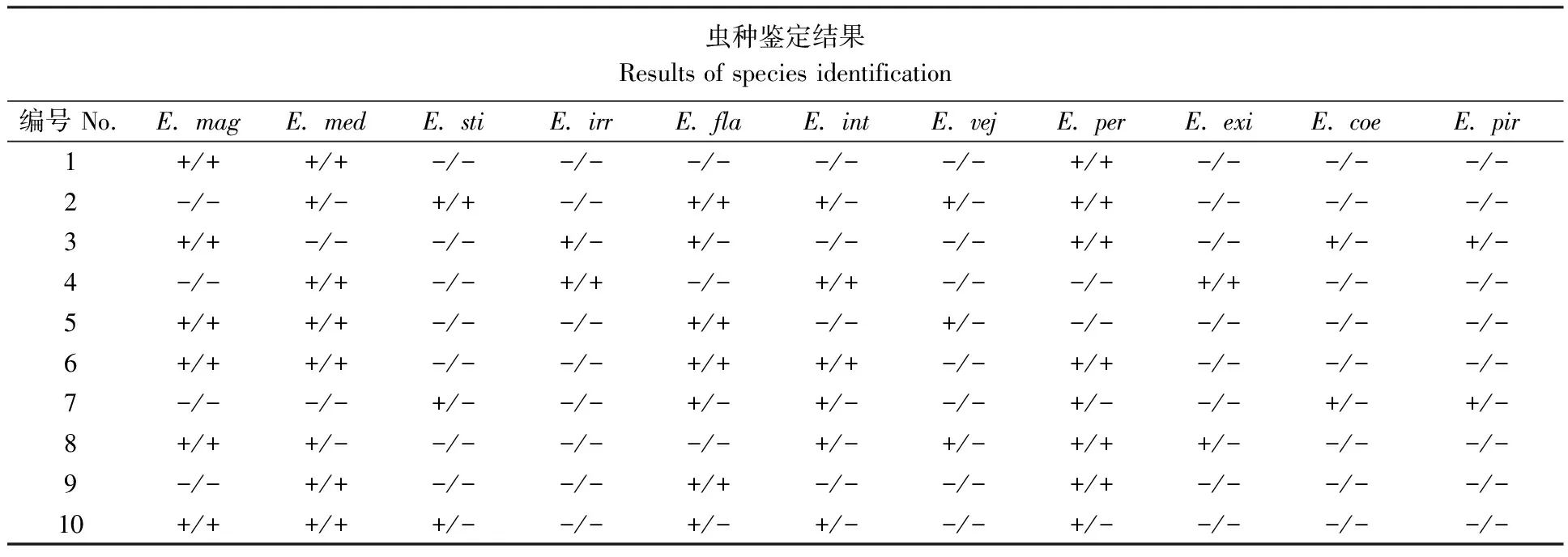
表2 田间样品形态学与PCR检测结果对比Tab. 2 Comparison between morphological and PCR identification
E.mag:大型艾美耳球虫;E.med:中型艾美耳球虫;E.int:肠艾美耳球虫;E.vej:维氏艾美耳球虫;E.sti:斯氏艾美耳球虫;E.per:穿孔艾美耳球虫;E.coe:盲肠艾美耳球虫;E.irr:无残艾美耳球虫;E.pir:梨形艾美耳球虫;E.exig:小型艾美耳球虫;E.fla:黄艾美耳球虫。“+”:有;—:无;“/”前为PCR鉴定结果,后为形态学鉴定结果。
PCR identification showed before the mark‘/’, while morphological identification after ‘/’;‘+’: positive; ‘—’: negative.
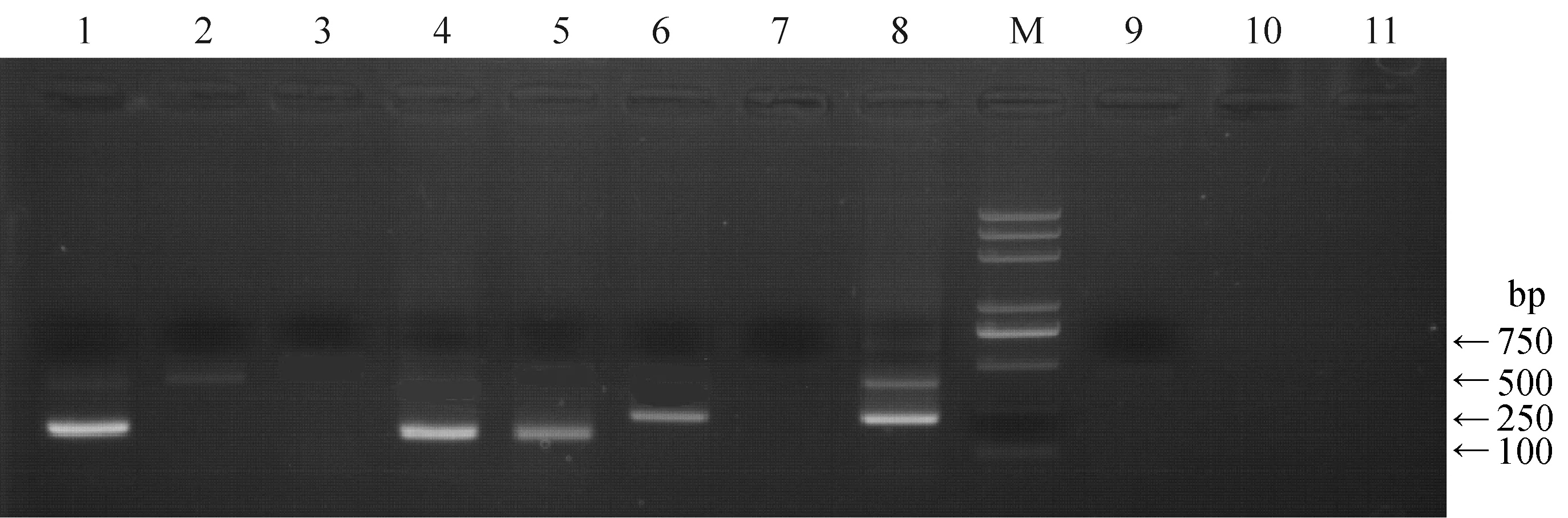
图3 田间样品的PCR检测结果Fig. 3 PCR detection results of ten field samples1:大型艾美耳球虫;2:维氏艾美耳球虫;3:肠艾美耳球虫;4:穿孔艾美耳球虫;5:中型艾美耳球虫;6:斯氏艾美耳球虫;7:盲肠艾美耳球虫;8:无残艾美耳球虫;9:梨形艾美耳球虫;10:小型艾美耳球虫;11:黄艾美耳球虫;M:DNA marker D2000 plus。1: E. magna; 2: E. vejdovskyi; 3: E. intestinalis; 4: E. perforans; 5: E. media; 6: E. stiedai; 7: E. coecicola; 8: E. irresidua; 9: E. piriformis; 10: E. exigua; 11: E. flavescens; M: DNA Marker D 2000 plus.
3 讨论
兔球虫的虫种有11个之多,进行准确的虫种鉴定对于流行病学调查以及虫株纯度检验有着十分重要的意义。本研究对PCR检测方法进行了改进,通过优化卵囊的裂解方法和引入WGA技术,提高PCR检测的灵敏度,并以此成功地对卵囊含量较少的田间样品进行检测。
田间样品采集及鉴定常遇到待检微生物含量较少、基因组提取过程中有所损失的问题,导致达不到PCR的检测阈值而呈假阴性结果(Lynnetal., 2009)。因此本研究将常见的裂解方法进行组合,探索适于检测的田间样品的PCR模板快速制备方法。该体系中,液氮冻融和蛋白酶K(需灭活)的使用不会引入PCR反应的抑制成分,是很好的裂解手段,但是由于单独使用不能够完全裂解卵囊,所以需要引入其他的辅助方法;而SDS作为一种阴离子去污剂,能够破坏蛋白质的分子结构,而被广泛的利用于蛋白质的裂解,但是SDS的存在会影响PCR反应的进行(Wilson, 1997),因此需要控制其使用浓度。试验中我们通过比较试验,表明了SDS的适用浓度为0.01%,能够有效裂解卵囊且不抑制PCR反应的进行。利用上述裂解方法,能够将DNA的获取和后续反应在同一PCR管中进行,减少了模板在不同反应空间内的转移次数,进行有效避免了模板的损失。
田间样品中卵囊含量少时难于提供足够的检测模板用于PCR反应,因此很多样品的检验只能使用眼观镜检的方法来确定,使虫种鉴定的准确性大大降低。因此有必要对田间样品进行有效的处理,以达到PCR反应的阈值,利用全基因组扩增技术正是克服模板含量低的有效方法(Deanetal., 2002)。我们已成功的将WGA技术应用于兔球虫基因组的扩增,能够在单个卵囊的水平上对ITS-1这一虫种鉴定的重要序列进行PCR扩增(Wangetal., 2014)。因此我们将WGA技术引入到田间虫种鉴定中来。利用该方法,鉴定出了眼观并未确认的虫种,证明了起在田间样品检测中应用的可行性。因此该方法较传统先提取基因组再进行PCR检测方法,更为灵敏;且准确性较形态学观察的方法大大提高。
综上所述,我们通过探索卵囊的裂解方法和引入WGA技术,提高了PCR检测手段在兔球虫田间样品检测中的灵敏度,扩大了其应用范围,能够成为有效的田间虫种检测手段。

