添加不同类型脂肪酸对罗非鱼肝脏原代细胞内脂类代谢相关基因表达的影响
韩春艳,郑清梅,陈桂丹,刘丽霞
(嘉应学院 生命科学学院,广东 梅州 514015)
近年来研究发现脂肪酸作为一种基因表达的调控物可以直接和独立地调节基因表达.尤其是n-3和n-6系列多不饱和脂肪酸(PUFA)与基因调节之间的关系最为密切[1].对于鱼类来讲,脂肪作为能量的主要来源,其代谢的主要场所是肝脏,因此研究鱼类肝脏中的脂类代谢就显得尤为重要.
已有大量的研究表明,饲料中不同来源脂肪直接影响鱼类(包括:草鱼[2]、鲤鱼[3]和罗非鱼[4]等)体内的脂肪代谢.但目前研究主要以活体动物为主,未见细胞水平的相关研究.随着细胞培养技术的发展,体外培养的原代鱼肝细胞在不同领域已得到广泛应用[5].研究表明,来自活体经原代培养的肝细胞在合适培养条件下可以保持1周到数周的活力[6],而且保持了大部分初始活体特征[7].因此,利用原代培养肝细胞进行相关研究不失为一种快速、经济的研究手段.由于鱼类的种类繁多,与哺乳动物比较鱼类肝脏较小且血管系统不发达,因此采用灌注法对仪器要求高、操作难度大,一般实验室内很难完成.与之比较目前常用酶消化法进行肝脏细胞分离和制备,操作较为容易,但因肝脏内血细胞丰富如分离纯度不高会影响进一步的研究.本研究拟以奥尼罗非鱼为研究对象初步探索肝脏细胞分离方法,并进一步研究培养基中添加不同类型的脂肪酸对其中与脂类代谢有关的酶(包括:脂蛋白脂酶(LPL)和苹果酸脱氢酶(MDH))及相应的转录因子(PPARα(过氧化物酶体增殖物激活受体 -α))基因表达的影响,旨在为不同类型脂肪酸对鱼类脂类代谢影响机制及进一步的营养调控提供理论依据.
1 材料与方法
1.1 材料及试剂
150g左右的奥尼罗非鱼由华南师范大学生物园提供.基础培养基是 DMEM(Gibco),添加10%FBS.主要试剂:Ⅱ型胶原酶(CollagenaseⅡ)、DEPC(Sigma公司)、胎牛血清(NCS)、PrimeScript RT Kit(Perfect Real Time)200次量反转录试剂盒、Premix Taq(Takara)、RNA提取试剂盒 TRIZOL(Invitro-gen)、DL2000(天根生化公司),其余化学试剂均为分析纯.
脂肪酸标准液(Sigma):使用无水乙醇配制成1M的储备液于-80℃冻存,使用时用培养基配制成最终浓度.
1.2 仪器设备
无菌手术器械,IX70-S8F2倒置显微镜(日本Olympus,IX70),22R台式冷冻离心机(德国Eppendrof),超净工作台,CO2培养箱.
1.3 罗非鱼肝脏细胞的分离及纯化
无菌条件下,取罗非鱼肝脏、剪成小块,PBS液反复洗涤至液体澄清.静置后吸除洗液.加入Ⅱ型胶原酶溶液置于冰上消化30 min.120目尼龙网过滤,以除去结缔组织和细胞团块.将细胞滤液于4℃离心机中离心.分别采用90 g,60 g和30 g反复进行离心,每次用PBS液洗涤.最后除去上清液,加入含胰岛素、1%青霉素和链霉素细胞培养液制成肝细胞悬液.血细胞计数板计算细胞数,根据镜下细胞形态判断肝细胞和杂质细胞,肝细胞数所占细胞总数的百分率,即纯度.台盼蓝拒染法测活力.
1.4 肝脏细胞的原代培养
用细胞培养液将肝细胞悬液稀释至细胞密度为5×105个/ml,取3 ml稀释液接种于细胞培养板中(Coring,6孔),随机分为6组,每组3孔,于27℃的CO2恒温培养箱内培养.24h后小心移除培养基以添加16:0脂肪酸的培养基为对照组,以培养基中分别添加不同饱和度的脂肪酸(18:1 n-9,18:2n-6,20:4 n-6,20:5 n-3和22:6 n-3)为实验组,继续培养48h后提取细胞RNA,每个处理3个重复,整体实验重复2次.
1.5 定量方法
细胞RNA的提取参照Invitrogen试剂说明书;采用分光光度计测定提取RNA浓度及OD260/280,样品 RNA浓度均保持在 150~200 ng/μL,OD260/280测定值在1.8~2.0.反转录时采用800 ng RNA/20μL体系,参照Takara试剂盒说明书.
采用相对定量方法,以β-actin为参照基因,对目的基因mRNA表达丰度进行测定,引物见表1.

表1 本研究所使用的引物序列及相关参数
1.6 数据处理
采用 SPSS 16.0 软件(SPSS Inc.,USA)对所得相关数据进行单因素方差分析(One-Way ANOVA),并进行 Duncan's多重比较,P <0.05 具有显著性差异.所有结果以平均值±标准差(mean±SD.)表示.
2 结果与分析
2.1 肝细胞的产量、纯度及活力
本实验以胶原酶冷消化法消化分离罗非鱼肝细胞,胶原酶的浓度为0.25%,用量为所消化肝组织的3~5倍,消化时间为0.5h.新分离的肝细胞透亮,近似圆形,有立体感,呈单个分散状态,细胞核清晰,偶有小细胞团,其中含有少量血细胞.依表2可见,反复低速离心可有效去除杂细胞,经24h的培养,细胞贴壁状况良好,细胞间出现索状排列、岛状连接,为进一步研究提供保证.
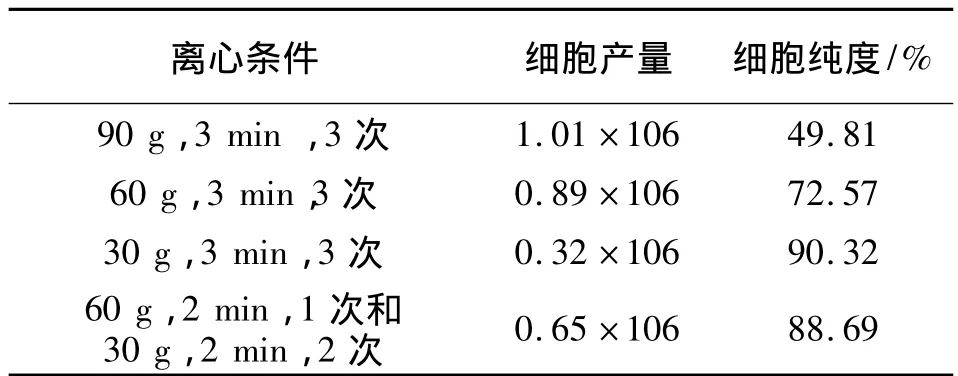
表2 不同离心条件下罗非鱼肝细胞的产量和纯度
2.2 不同类型的脂肪酸对肝脏细胞内与脂类代谢相关基因表达的影响
由表3可见,随着脂肪酸不饱和程度的增加LPL和PPARα的基因表达明显上升.其中培养基中添加了20:5 n-3(EPA)和22:6 n-3(DHA)两种脂肪酸的肝脏细胞内LPL和PPARα的表达量显著高于添加饱和性脂肪酸组.其余各组间差异不显著.而MDH表达则呈现相反趋势.

表3 不同类型的脂肪酸对肝脏细胞内与脂类代谢相关基因表达的影响
3 讨论
目前,鱼类肝细胞分离的方法主要有两种,直接消化法和两步灌注法[5].两步灌流法因其得到的细胞纯度高、活力好,得到广泛应用.但这一方法只适用于肝组织具有比较发达门静脉系统的鱼类,如蛙鱼类等.对于没有门静脉的鱼类(如罗非鱼),灌流时通常需从腹部的动脉或是心脏插入针管,这种操作难度大,常常达不到理想效果,且灌注法多适用于个体比较大的成鱼,个体较小的鱼极难成功.因此,对于个体较小的鱼一般均采用直接消化法.但由于肝脏中血管丰富,直接消化法会导致肝脏细胞与血细胞混杂在一起,需进一步的分离.另外如消化时间过长还会影响肝脏细胞的活力.
因此,在本研究尝试采用低温消化,多次分级离心的方法得到了较好的细胞纯度及产量.
LPL是脂质代谢和转运过程中的关键酶,其参与各种脂蛋白的代谢并对其进行调控.使血浆中富含脂质的脂蛋白降解,以供机体组织储存和利用,因此与机体的脂质代谢及肥胖密切相关[2~3].对人等哺乳动物的研究表明,肝脏LPL基因仅在胚胎期表达,出生后不久即被关闭[8~9],而鱼类肝脏已证实存在具有LPL活性.本实验室前期研究表明其活性及基因表达受饲料中脂肪水平和脂肪来源的调控[4],其他研究者也有类似的发现[10,11].相关研究显示,不同脂肪酸对鱼类脂类代谢的影响很大程度上与不饱和脂肪酸,尤其与高度不饱和脂肪酸的差异有关[2,10-12].本研究表明,随脂肪酸的不饱和程度增加,LPLmRNA的表达显著提高,特别是添加了DHA和EPA后其表达量增加至最大,这与以上的研究结果类似.
PPARα是一个枢纽型的转录因子,在肝脏、骨骼肌及肾脏中高度表达,主要是通过配体结合后的活化而发挥其生物学效应.作为依赖配体的核转录因子,PPARα与9-顺式视黄酸类受体(RXR)形成异二聚体后,PPARα-RXR复合物与靶基因启动子上的特异DNA反应元件(PPRE)结合,发挥转录调控作用.目前已知天然配体有亚油酸、亚麻酸和花生四烯酸代谢产物白三烯等.Ruby等[14]发现,极低密度脂蛋白(VLDL)水解所释放的脂肪酸作为配体可以激活PPARα.PPARα调控与甘油三酯(TG)、VLDL代谢相关的载脂蛋白(Apo)CIII和LPL关键基因的表达,进而促进 TG和 VLDL代谢[15].Rudkowska等[16]报道,在人肝细胞HepG2培养液中添加n-3脂肪酸可以通过PPARα促进LPL的转录活性.Rakhshandehroo等[17]利用基因芯片技术发现,活化或阻断肝组织PPARα能够调控一系列与脂类代谢相关基因的表达,包括激素敏感脂肪激酶(HSL)、脂肪甘油三酯脂肪酶(ATGL)等.梁旭芳等已发现真鲷LPL基因5'侧翼区序列中存在顺式元件--过氧化酶体增殖物反应元件,同时发现饲料中脂肪酸的不饱和度影响LPL的表达,因此推断脂肪酸通过氧化代谢来促进PPAR表达对真鲷肝脏LPL基因表达水平的作用应大于脂肪酸直接作为配基激活LPL基因表达的影响[10].本研究发现,LPL和PPARα受脂肪酸不饱和程度的影响具有一致性,但究竟二者之间以何种关系相互关联,值得进一步探讨.
NADPH是动物体内脂肪酸合成及其碳链延长的重要辅酶,是脂肪酸还原合成中氢的供给者,体内NADPH供应情况直接影响脂肪及类脂的合成.脂肪代谢酶主要包括能生成 NADPH的酶,如乙酰CoA羧化酶 (ACX)、MDH、异柠檬酸脱氢酶(ICDH)、葡萄糖 -6-磷酸脱氢酶(G-6-PDH)等[18].周继术[3]对鲤肝胰脏该两类酶的研究发现,鱼油组鲤肝胰脏MDH、G-6-PDH活力均低于富含亚油酸的对照组,且MDH的活性显著降低,显示出富含EPA、DHA的鱼油抑制了鲤肝胰脏脂质合成,这与EPA、DHA比亚油酸更能有效抑制大鼠肝脏中脂肪酸合成酶活性一致[19].本研究发现,DHA可明显降低MDH mRNA的表达,MDH与PPARα之间并无显著关联.
[1]许友卿,逄劭楠,丁兆坤.多不饱和脂肪酸对基因表达的影响及其机理[J].饲料工业,2011,32(2):56-60.
[2]吉红,曹艳姿,刘品,等.饲料中HUFA影响草鱼脂质代谢的研究[J].水生生物学报,2009,33(5):882-890.
[3]周继术,吉宏,王建华,等.鱼油对鲤生长及脂质代谢的影响[J].中国海洋大学学报,2008,38(2):275-280
[4]CHUNYAN H,QINGMEI ZHENG,LINA F.Effects of total replacement of dietary fish oil on growth performance and fatty acid compositions of hybrid tilapia(Oreochromis niloticus × O.areus)[J].Aquaculture International,2013,DOI 10.1007/s 10499-013-9624-y{在线}
[5]贾睿,曹丽萍,丁炜东.鱼类肝细胞分离、原代培养与应用研究综述[J].江西农业大学学报,2012,34(1):147-157.
[6]PESONEN M,ANDERSSON T B.Fish primary hepatocyte culture;An important model for xenobiotic metabolism and toxicity studies[J].Aquatic toxicology,1997,37(2/3):253-267.
[7]SEGNER H.Isolation and primary culture of teleost hepatocytes[J].Comparative Biochemistry and Physiology - Part A:Molecular& Integrative Physiology,1998,120(1):71-81.
[8]BURGAYA F,PEINADO J,VILARO S,et al.Lipoprotein lipase activity in neonatal- rat liver cell types[J].Biochem.J.1989(259)159 -166.
[9]PEINADO - ONS RBE J,STAELS B,DEEB S,et al.Neonatal extinction of liver lipoprotein lipase expression[J].Biochim.Biophys.Acta,1992(1131)281-286.
[10]梁旭芳,李月琴,李贵生,等.真鲷脂蛋白酯酶基因顺式元件PPRE及在肝脏活体调控作用[J].热带海洋学报,2004,4(23):49-56.
[11]王煜恒,王爱民,刘文斌,等.不同脂肪源对异育银鲫鱼种生长、消化率及体成分的影响[J].动物营养学报,2011,23(4):604-614.
[12]BOBBAN S,REBECCA L,STEVEN R,et al.Effect of dietary lipid source on the growth,tissue com position and hematological parameters of large mouth bass(Micropterus salmoides)[J].Aquaculture,2006,255:210-222.
[13]SANG M L,JONG H L,KYOUNG D K.Effect of dietary essential fatty acids on growth,body com position and blood chemistry of juvenile starry flounder(Platichthys stellatus)[J].Aquaculture,2003(225):269-281.
[14]RUBY MA,GOLDENSON B,ORASANU G,et a1.VLDL hydrolysis by LPL activates PPAR-alpha through generation of unbound fatty acids[J].J Lipid Res.2010,51(8):2275-81.
[15]PHILIPPE L,GIULIA G,JEAN - CHARIES F,et al.Sorting out the roles PPAR - αin the energy metabolism and vascular homeostasis[J].J Clin Invest.2006,116(3):571-580.
[16]RUDKOWSKA I,CARON -DORVAL D,VERREAULT M,et a1.PPAR-alpha L162V polymorphism alters the potential of n-3 fatty acids to increase lipoprotein lipase activity[J].Mol Nutr Food Res,2010,54(4):543 -550.
[17]RAKHSHANDEHROO M,SANDERSON LM,MATILAINEN M,et a1.Comprehensive analysis of PPAR alpha-dependent regulation of hepatic lipid metabolism by expression profiling[J].PPAR Res,2007(26):839.
[18]杨海玲,曾勇庆,魏述东,等.莱芜猪脂肪代谢酶活性的发育性变化及其对肌内脂肪沉积的影响[J].畜牧兽医学报,2005,36(11):1150-1154.
[19]CLARKE S D,ARMST RONG M K,J UMP D B.Dietary polyunsaturated fat uniquely suppress rat liver fatty acid synthase and s14 mRNA content[J].J of Nutr.,1990(12):225-231.

