移植BDNF和GDNF基因修饰的hMSCs对大鼠大脑中动脉阻塞的影响*
钟慧霖, 陈文明, 李翠莹, 王茜婷, 张静远, 兰 丹, 刘海霞, 邹清雁△
(1广州赛吉生物科技有限公司,广东广州510633;2广东三九脑科医院神经医学研究中心,广东广州510510)
中风是致残最大诱因,也是第二大致死性疾病[1-2],在我国每年中风患者有300多万。传统治疗手段如药物治疗和溶栓治疗时间窗短,限制因素多,存在很大的缺陷[3],因此迫切需要研发新的治疗方法。越来越多的研究提示干细胞治疗有可能为中风治疗提供一种新的方法[4]。间充质干细胞(mesenchymal stem cells,MSCs)来源广泛,有高分化潜能,免疫原性弱,并且骨髓MSCs能从骨髓迁移到周边血管最终进入中枢神经系统影响神经损伤[5],现有报道的作用机制包括神经元替换、分泌细胞因子,对神经有保护和营养支持作用以及抑制炎症、免疫调节等[6-8]。
不少学者用功能基因修饰人MSCs(human MSCs,hMSCs)用于疾病治疗并取得了很好的治疗效果。早在2005年,Kurozumi等[9-10]使用腺病毒转染方法,将脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)或胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)基因转入MSCs进行脑室移植治疗大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)大鼠模型,取得了较好的治疗效果。然而腺病毒在进行基因治疗实验中曾经有导致患者死亡的报道[11]。
与病毒转染技术相比,非病毒载体转染更为安全,有较好的临床适用性。本研究选择高效非病毒表达载体,采用脂质体转染技术将BDNF和GDNF基因转入hMSCs,获得高表达的hMSCs,再通过股静脉注射移植到MCAO大鼠模型体内,观察hMSCs和高表达BDNF、GDNF的hMSCs联合移植对MCAO的影响,旨在探索非病毒载体转染hMSCs的效率及其对MCAO的影响,为脑血管病治疗临床研究提供一种干细胞相关的基因治疗方法。
材料和方法
1 动物、细胞和载体
SPF级Wistar大鼠30只(最终纳入实验),体重270~300 g,由南方医科大学实验动物中心提供,许可证号为SCXK(粤)2011-0015。hMSCs由广东三九脑科医院神经医学研究中心提供。质粒pEGFPN2、pCAG-Kan-Neo、pCMV-Neo 和大肠杆菌菌株TOP10由中国科学院广州生物医药与健康研究院惠赠。
2 主要试剂
基因组 DNA提取试剂盒、质粒提取试剂盒、RNA提取试剂盒、反转录试剂盒和DNA回收试剂盒(北京天根生化科技公司);DNA聚合酶和限制性内切酶(TaKaRa);胎牛血清和α-MEM(HyClone);L-谷氨酰胺、丙酮酸钠、非必须氨基酸、磷酸盐缓冲液(phosphate buffered solution,PBS)、DMSO、Lipofectamine® 2000 transfection reagent和0.05%胰蛋白酶(Invitrogen);G418(Merk);维生素C(vitamin C,Vit C)(Sigma);BDNF和GDNF ELISA试剂盒(RD System)。所用引物由华大基因设计合成。
3 主要方法
3.1 hMSCs的分离培养 从健康成人志愿者体内采集骨髓血,采用我们自行研发的专利分离液分离单个核细胞,加自配改良细胞培养基(89% α-MEM、10%FBS、1%GlutaMAX、0.1% β-巯基乙醇、50 mg/L Vit C、5 ng/L血小板源性生长因子)进行体外培养扩增,传至第3代做流式细胞术鉴定。经鉴定MSCs纯度较高的用于后续基因提取以及细胞转染。
3.2 载体构建 从原代hMSCs中提取总RNA,再反转录成cDNA(方法参照试剂盒说明书)。设计GDNF引物正义链 5′-ATGCAGTCTTTGCCTAACAGCAATG-3′,反 义 链 5′-TCAGATACATCCACACCTTTTAGCG-3′;BDNF 引 物 正 义 链 5′-ATGACCATCCTTTTCCTTACTAT-3′,反义链 5′-CTATCTTCCCCTTTTAATGGTC-3′。以此 cDNA为模板进行 PCR克隆BDNF和GDNF并送公司测序与NCBI上序列进行比对(GDNF:AY052832;BDNF:EF674517),经测序证实序列与GenBank上一致。在BDNF和GDNF基因片段两端加上合适的酶切位点分别连接到pCAGKan-Neo和 pCMV-Neo上。将构建好的载体转化TOP10大肠杆菌扩增,提质粒酶切鉴定并送公司测序,比对测序结果,将测序正确无突变克隆的用于扩增转染细胞。
3.3 质粒扩增、线性化 将质粒pCAG-BDNF、pCMV-GDNF或pEGFP-N2转化TOP10大肠杆菌,扩增后进行质粒提取,用ApaL I进行酶切线性化,经电泳鉴定确认线性化完全后乙醇沉淀,用无菌水溶解。保证终总量在24 μg以上。
3.4 脂质体转染细胞 复苏细胞于10 cm培养皿,长满后以1∶3传代至新10 cm培养皿,培养24 h后分别进行pCAG-BDNF、pCMV-GDNF和pEGFP-N2脂质体转染(方法依照试剂盒说明书),转染后4~6 h换液,24 h取上清进行ELISA检测并以1∶3传代。在荧光倒置显微镜下观察荧光表达情况。48 h后加G418(300 mg/L)进行筛选。每2 d换液1次,大约10~15 d长出克隆,然后将克隆细胞传代扩增,冻存。将ELISA检测中BDNF和GDNF蛋白表达量高的细胞用于动物实验。
3.5 动物行为训练 对所有大鼠(体重约260 g)进行行为学训练:(1)贴附物移除实验,将圆形标签纸(直径16 mm)贴到大鼠两前爪,放回笼子,记录其撕纸时间,大于1 min按1 min计算。每天3次中间间隔10 min以上。(2)转棒实验,将大鼠放到疲劳仪转棒上,设定疲劳仪转动时间3 min,20 r/min训练2次,25 r/min训练2次,30 r/min训练5次。每天训练3次,间隔10 min以上。
3.6 制作MCAO模型 将训练合格的大鼠(12 s内移除贴附物,转棒仪跑步测序持续170 s以上)制作MCAO模型,方法参照 Kurozumi等[10]的制作方法。24 h后对模型鼠进行功能评分,参照Longa评分并进行改良,具体如下:0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:提尾对侧肩内收,身体绻起;3分:提尾放地上向对侧转圈或轻微自发向对侧转圈;4分:向对侧倾倒;5分:意识丧失,不能自发行动。选取评分为2~3分的大鼠18只随机分成3组,每组6只,分别为PBS对照组、hMSCs治疗组和转基因hMSCs治疗组。另制作假手术大鼠6只。
3.7 细胞移植前准备 复苏待移植细胞,培养传代至细胞足量。移植前用0.05%胰酶消化细胞,收集到离心管,离心,弃上清,加10 mL PBS重悬后离心重复3次以彻底洗去血清,用血小板计数器计数。加适量PBS重悬使细胞密度为1.5×109/L。将细胞转入无菌EP管中,密封,置冰上,待移植。
3.8 MCAO后24 h股静脉移植细胞 麻醉大鼠,固定,从股静脉进针移植细胞,速度控制在1 mL/5 min左右(其中假手术组和PBS对照组移植1 mL PBS;hMSCs治疗组移植1 mL hMSCs;转基因治疗组移植0.5 mL BDNF-hMSCs和0.5 mL GDNF-hMSCs细胞混合液;另移植EGFP-hMSCs 1 mL于3只正常大鼠和3只MCAO模型鼠。所有细胞密度都是1.5×109/L)。
3.9 体重变化及行为评估 从手术造模开始每天称量大鼠体重。手术后3、5、7、10和14 d进行行为学测试。方法同训练,贴附物移除实验计时改为5 min,大于5 min按5 min计算,每天2次,中间间隔10 min以上;转棒仪实验参数设定为25 r/min 3 min,每天2次,间隔10 min以上。
3.10 灌注取脑观察 2周后深度麻醉大鼠,打开胸腔腹腔充分暴露心脏,用注射器经心尖通过左心室插入主动脉,剪开右心耳后灌注生理盐水250 mL左右至右心耳流出透明液体。换4%多聚甲醛液继续灌注,出现肌颤后缓慢灌注至肝脏的颜色变白变硬,约灌注250mL。取出大脑,置4%多聚甲醛中固定1 d后观察梗死区域并拍照。
3.11 HE染色观察及脑梗死体积计算 将所有实验组大鼠脑组织于4%多聚甲醛中固定1 d后将脑组织切成2 mm厚的5个冠状切片(从松果体腺往嗅球方向每隔2 mm切1片)。将切片于4%多聚甲醛中固定2 d,做常规石蜡切片,HE染色,显微镜下观察,拍照。用图像处理软件处理图像,测量切片梗死区域面积,计算脑梗死相对体积,参照 Neumann-Haefelin等的脑相对梗死体积百分比计算公式:各切片梗死面积=对侧面积-梗死侧非梗死区域面积;各切片梗死体积=切片两面梗死面积之和×切片厚度/2;相对梗死体积百分比=各切片梗死体积之和/大脑体积。
3.12 振动切片观察细胞迁移 取移植了EGFP-hMSCs大鼠的脑组织于4%多聚甲醛中固定1 d后将脑组织切成2 mm厚的5个冠状切片(方法如前所述)。配4%琼脂糖包埋各切片,于振动切片仪上进行切片,50 μm/片,然后将切片置于荧光倒置显微镜下观察。
4 统计学处理
用SPSS 19.0统计软件分析。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 细胞的分离与体外扩增
采用我们自行研发的专利分离液分离hMSCs,体外培养使用培养基在传统hMSCs培养基基础上添加血小板源性生长因子、β-巯基乙醇和Vit C。此改良培养基培养细胞增殖较快,且传代至第16代以上仍未见有细胞老化和分化迹象,优于传统培养基,见图1。取培养后的细胞做流式细胞术鉴定,结果表明培养第3代的hMSCs已经有了较高的纯度,见图2。
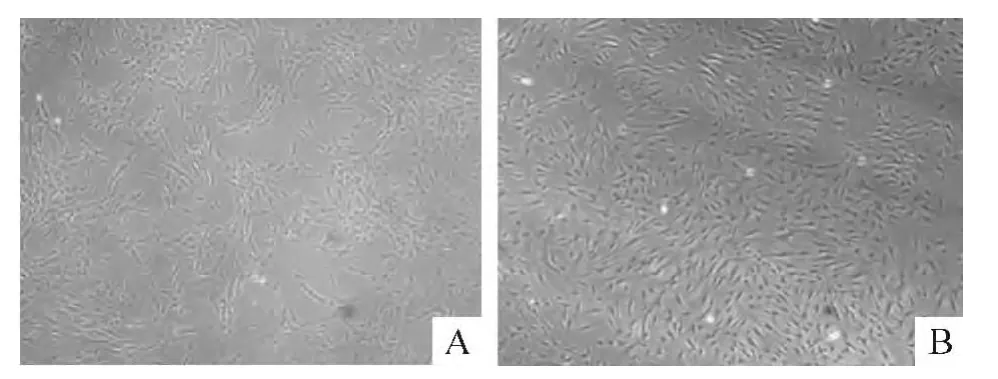
Figure 1.Effects of our self-made medium and traditional medium on hMSCs culture(×40).A:traditional medium;B:our self-made medium.图1 自配改良培养基与传统培养基培养hMSCs的效果比较
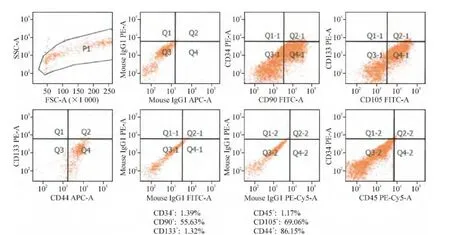
Figure 2.Flow cytometry analysis of the hMSCs(passage 3).图2 第3代hMSCs的流式细胞术鉴定结果
2 细胞基因转染修饰
将载体 pCAG-BDNF、pCMV-GDNF和 pEGFP-N2分别用Lipofectamine 2000转染至hMSCs。转染效率在70%左右,见图3。通过ELISA检测转基因细胞上清液中的BDNF和GDNF表达量,结果非转基因细胞和转pEGFP-N2细胞表达量较少,转入pCMV-GDNF和pCAG-BDNF细胞2种营养因子表达量远大于非转基因细胞和转入载体pEGFP-N2的细胞,见表1。
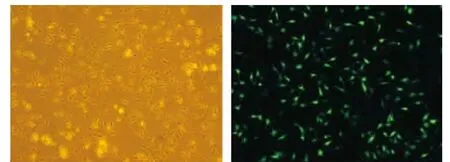
Figure 3. The cell transfection rate 24 h after transfection(×40).图3 脂质体转染后24 h的细胞转染率
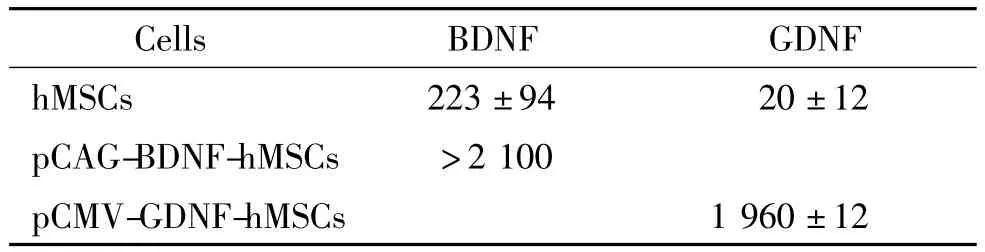
表1 基因转染对hMSCs BDNF和GDNF表达的影响Table 1.Effect of gene transfection on the expression of BDNF and GDNF in hMSCs(ng/L.Mean±SD.n=3)
3 细胞移植前后各组动物体重的变化
从大鼠体重下降到最低的时间和2周后动物体重恢复比例对其体重变化进行分析,结果转基因组体重开始恢复的时间与PBS组相比显著提前(P<0.05),平均开始恢复时间早于hMSCs组,体重在第14天能够恢复到原体重的90%左右,显著高于PBS对照组(P<0.05),平均体重恢复高于hMSCs组;hMSCs组平均体重开始恢复时间比PBS组早,14 d后平均体重恢复高于PBS组,但由于其组内差异比较大,hMSCs组体重变化与PBS组以及转基因组之间差异无统计学意义(P>0.05),见图4。
4 细胞移植前后各组动物行为学变化及脑梗死体积的比较
4.1 左腿贴附物移除时间 在第3天两治疗组贴附物移除时间要显著短于PBS对照组(P<0.05),第5天后差异不显著(P>0.05),说明干细胞能促进脑损伤大鼠较早期的身体机能恢复,见图5。
4.2 右腿贴附物移除时间 转基因组在第7天开始其右腿贴附物移除要显著快于PBS对照组(P<0.05),平均时间比hMSCs组短;hMSCs组与PBS组相比在第14天有显著改善(P<0.05),在其它时点平均时间比PBS组短;PBS组大鼠的贴附物移除时间2周内与假手术组相比明显延长(P<0.05),而两治疗组从第5天开始贴附移除时间接近于假手术组(P >0.05),见图5。
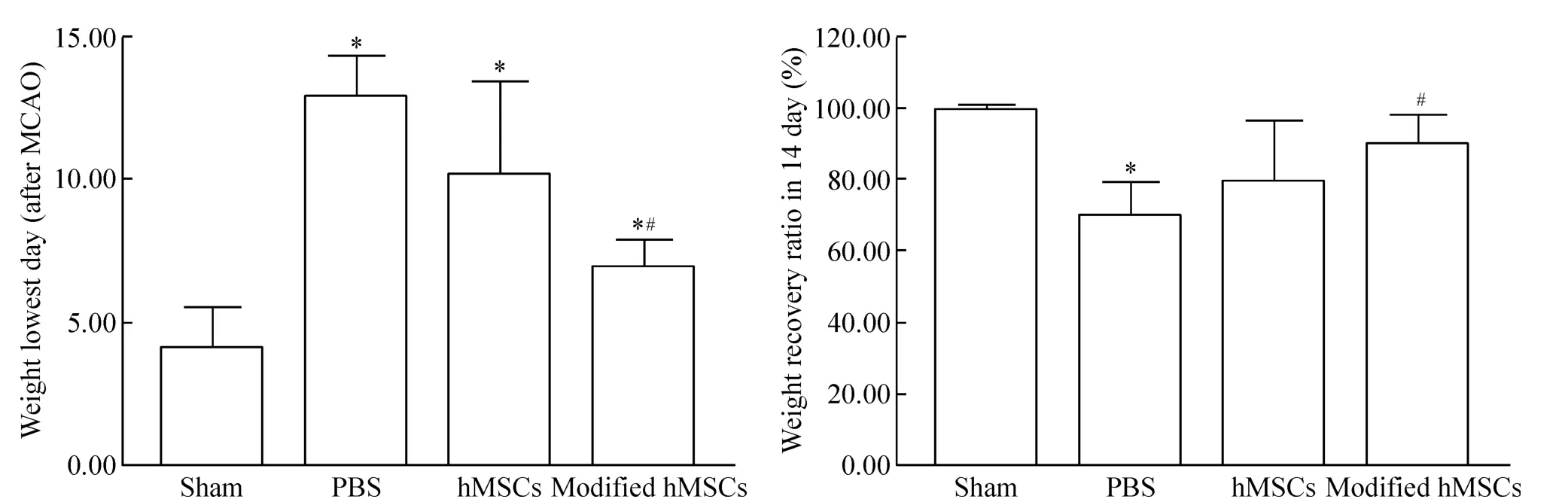
Figure 4.The changes of the body weight of the rats with different treatments.Mean±SD.n=6.*P<0.05 vs sham;#P<0.05 vs PBS.图4 各组大鼠体重的变化
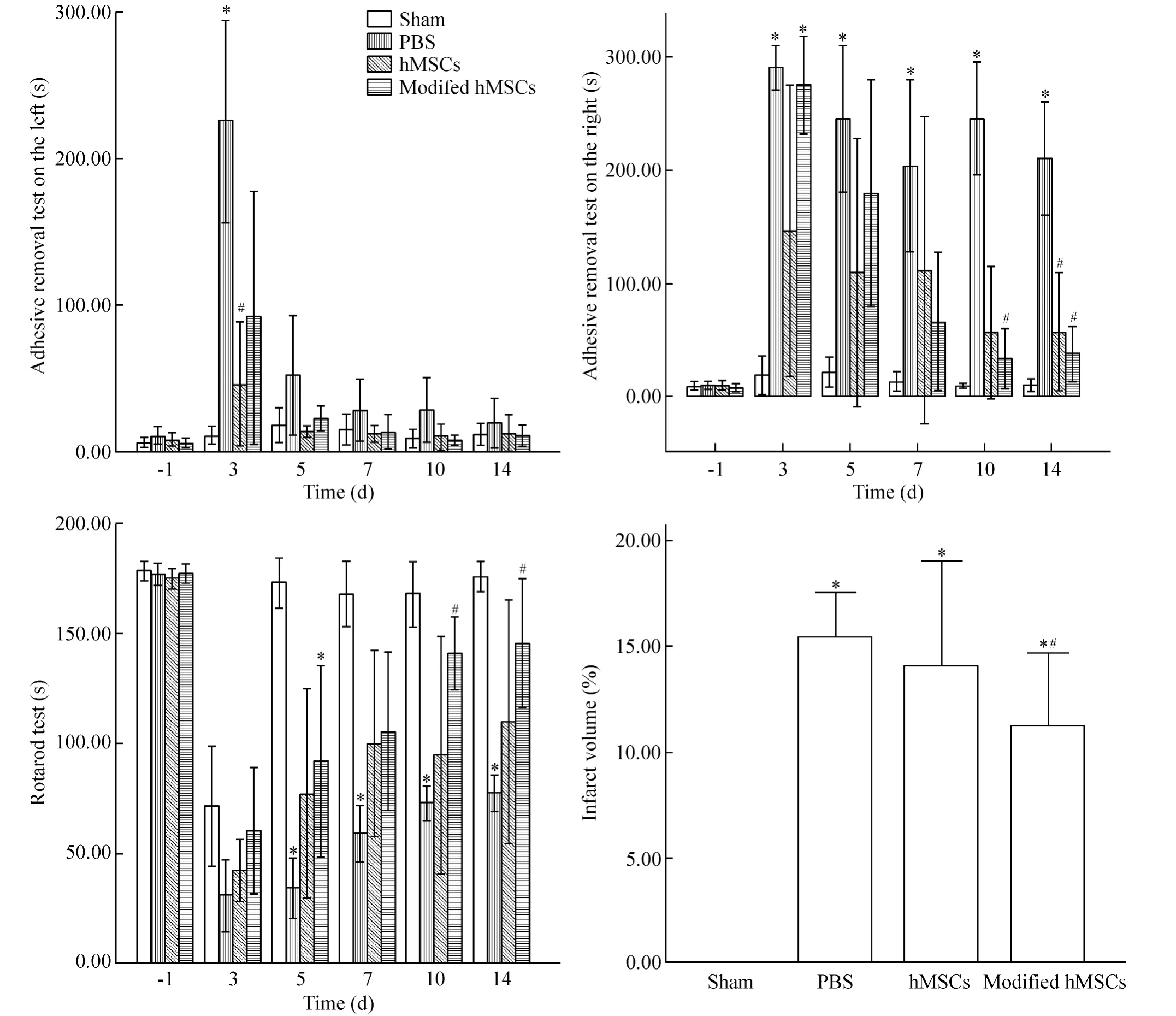
Figure 5.Behavioral test and infarction volume analysis.Mean±SD.n=6.*P<0.05 vs sham;#P<0.05 vs PBS.图5 行为学评估和脑梗死体积分析
4.3 转棒仪跑步持续时间 从第10天开始转基因组跑步能力显著高于PBS组(P<0.05),其平均水平在所有时点均高于hMSCs组;hMSCs组平均跑步能力在所有时点均高于PBS组;PBS组与假手术组相比跑步能力一直未有显著恢复(P<0.05),从第7天开始两治疗组与假手术组跑步差异不显著(P>0.05);hMSCs组组内差异比较大,其与PBS组以及转基因组无显著差异,见图5。
4.4 脑梗死体积百分比 转基因治疗组脑梗死体积占总脑体积百分比(11.16% ±2.21%)比PBS组(15.42% ±1.34%)显著缩小(P<0.05),平均值小于hMSCs组(13.95% ±3.21%);hMSCs治疗组脑梗死体积平均值小于PBS组;hMSCs治疗组组内差异较大,与PBS组以及转基因组相比均无显著差异,见图5。
5 脑组织外观及HE染色
5.1 脑外观 (1)假手术组脑组织表面光滑完整;(2)PBS组脑组织表面粗糙,有一定程度的萎缩和较大面积的梗死区域;(3)转基因治疗组脑组织较为光滑,萎缩程度和梗死区域明显减小;(4)hMSCs治疗组治疗效果组内差异较大,部分治疗大鼠脑组织如转基因治疗组(4例)表现为梗死区域减小,部分治疗大鼠脑组织(2例)与PBS组类似差异不明显,见图6。
5.2 HE染色 (1)假手术组脑组织细胞间紧密相连无梗死区域;(2)PBS组有较大面积梗死区域,梗死区域细胞稀疏排布;(3)转基因组梗死区域面积较hMSCs组和PBS组小,梗死区细胞排布稀疏程度低;(4)hMSCs组有4例梗死区域比PBS组小,梗死区域细胞密度比PBS组大,也有2例其结果与PBS对照组相似,见图6。
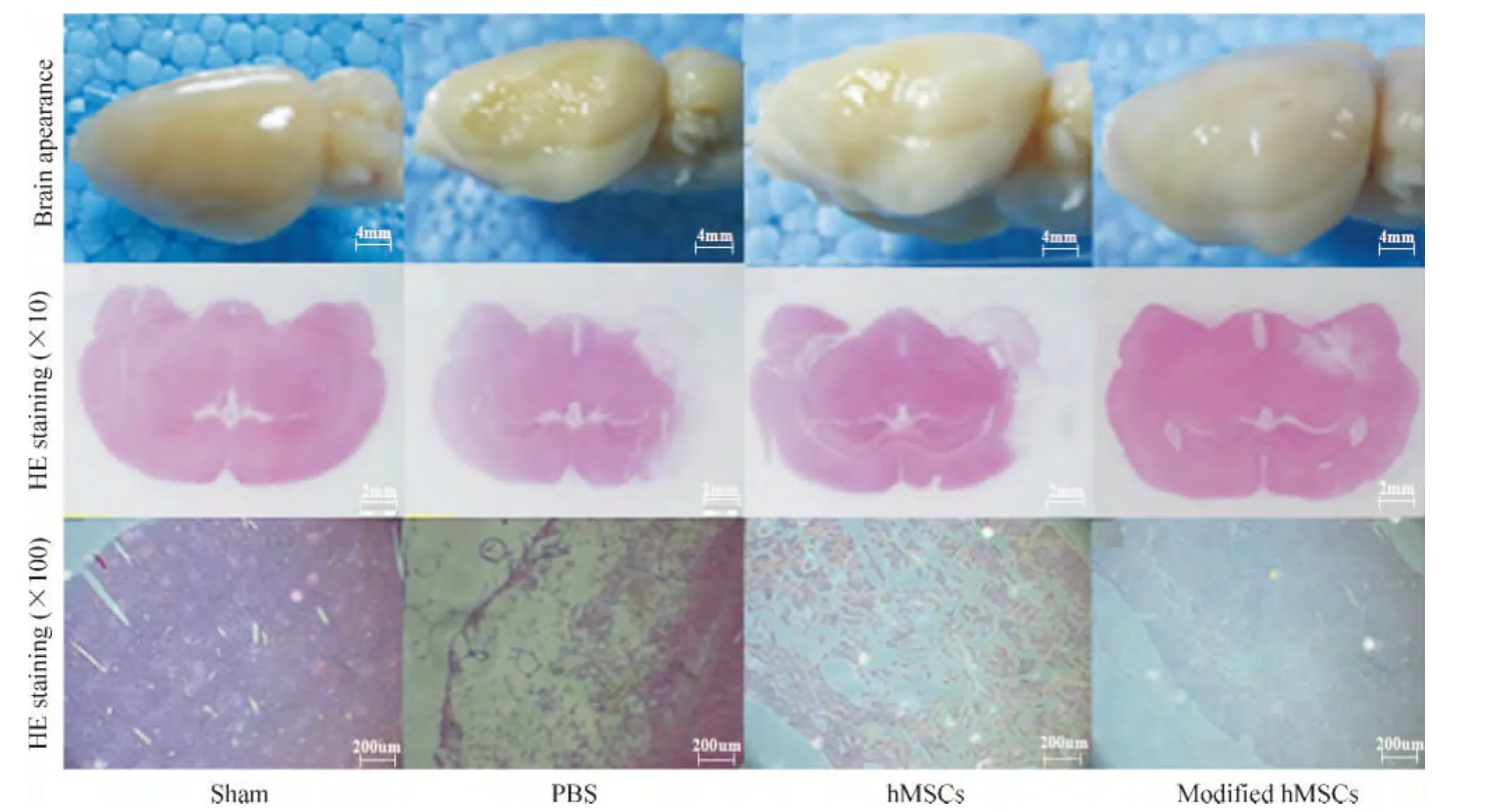
Figure 6.Infarct region obsrvation.In sham group,the surface of the rat brain was glossy and the cells of the brain were compact.In PBS group,the brain of the rats was rough and shriveled,and some interspaces between the cells in the infarct zone were observed.In hMSCs group,the rat brain also shriveled and there were some interspaces between the cells in the infarct area,but smaller than those in PBS group.In modified hMSCs group,the brain shriveled,infarct area was not significant,and the interspaces between the cells in the infarct area were the smallest in MCAO groups.图6 脑梗死区域观察
6 细胞迁移
通过GFP示踪,我们在健康大鼠脑部和中风模型大鼠脑组织未梗死区域均未发现荧光细胞,仅在极少数切片的脑梗死区域发现少量绿色荧光细胞,见图7。
讨 论
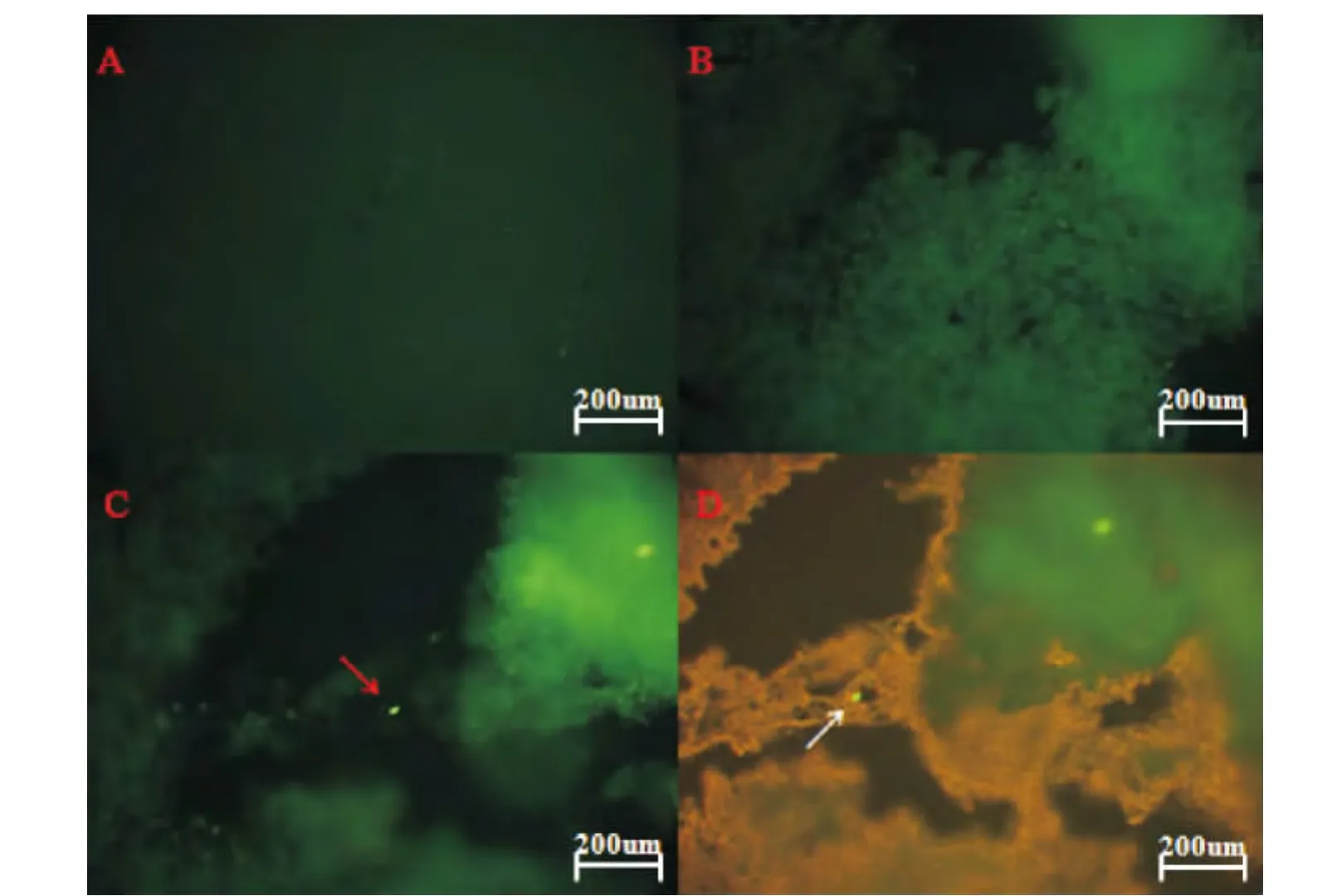
Figure 7.Migration of the hMSCs.A:sham;B:PBS;C:hMSCs;D:modified hMSCs.At day 14 after hMSCs were injected to the MCAO rats through the femoral vein,the hMSCs migrated to the infarcted hemisphere.A few exogenous cells only survived in the infarct area of the brain in the MCAO rats and they had no differentiation.图7 hMSCs在大鼠脑部的迁移
已有研究报道hMSCs脑室移植治疗MCAO模型大鼠取得了良好的效果[12]。一些学者研究认为hM SCs移植治疗MCAO模型大鼠效果与对照组相比无显著差异,而用腺病毒介导BDNF或GDNF基因修饰的hMSCs移植治疗MCAO模型大鼠有良好的效果[9-10]。然而其研究使用腺病毒载体,具有较大的临床风险。本研究选择非病毒高效表达载体并进行优化,用脂质体法介导基因修饰,与病毒载体相比更安全,有较好的临床应用前景。
BDNF和GDNF是极为重要的神经营养因子,它们能够为感觉神经元、运动神经元以及多巴胺神经元提供强大的营养支持作用,减少神经元凋亡并在神经元修复和结构重建过程中起重要作用[13]。目前研究表明当脑缺血后BDNF和GDNF的表达会受到影响[14]。本研究原拟进行双基因修饰hMSCs,然而在实际中发现,双基因修饰存在一定缺陷:双基因修饰细胞并非能同时高表达两种蛋白,其中一种蛋白表达会受到明显抑制。因此本研究分别用单基因修饰干细胞,然后将二种干细胞混合用于移植治疗。
本研究首次用脂质体介导BDNF基因修饰的hMSCs和GDNF基因修饰的hMSCs联合股静脉移植治疗MCAO模型大鼠,跟PBS对照组相比,能促进神经功能恢复并且能有效减小脑梗死体积。而hMSCs治疗组间差异大,效果不稳定,但综合水平优于PBS组。这说明细胞转入BDNF基因和GDNF基因能够对脑中风模型有更有效、更稳定的治疗效果。
我们采用绿色荧光蛋白示踪,观察静脉移植的hMSCs,15 d后在大鼠脑组织中的存活以及迁移情况,发现只有少数的细胞在中风大鼠脑梗死区域中存活,未见分化现象。这说明在MSC静脉移植治疗中,神经元替换作用有限。BDNF和GDNF 2种重要的神经营养因子可加强了hMSCs的作用,说明营养因子在对抗神经损伤和在损伤后修复中起着重要作用。有研究报道,通过静脉移植hMSCs至MCAO模型大鼠体内,第2天能够在脑损伤区域检测到较多的存活hMSCs,随着时间的推移,细胞逐渐减少[15]。由此可见,细胞治疗脑缺血病的作用机制可能是迁移到脑损伤区域,分泌多种营养因子对抗神经损伤和促进修复,而细胞本身受到机体免疫等相关机制的调节而逐渐死亡消失。
本研究首次用脂质体介导非病毒的BDNF基因修饰的hMSCs和GDNF基因修饰的hMSCs,通过股静脉移植治疗MCAO模型大鼠,与hMSCs相比有更好的治疗效果。我国干细胞临床研究管理办法即将出台,本研究中所使用的非病毒载体、脂质体转染法以及静脉移植均具有较大的临床适用性,能够为干细胞相关的基因治疗脑血管病研究提供参考。
(致 谢:感谢中国科学院广州生物医药与健康研究院赖良学研究组各成员的指导和帮助!)
[1] Lopez AD,Mathers CD,Ezzati M,et al.Global and regional burden of disease and risk factors,2001:systematic analysis of population health data[J].Lancet,2006,367(9524):1747-1757.
[2] Kolominsky-Rabas PL,Heuschmann PU,Marschall D,et al.Lifetime cost of ischemic stroke in Germany:results and national projections from a population-based stroke registry:the Erlangen Stroke Project[J].Stroke,2006,37(5):1179-1183.
[3] Sahota P,Savitz SI.Investigational therapies for ischemic stroke:neuroprotection and neurorecovery[J].Neurotherapeutics,2011,8(3):434-451.
[4] Wechsleer L,Steindler D,Borlongan C,et al.Stem cell therapies as an emerging paradigm in stroke(STEPS):bridging basic and clinical science for cellular and neurogenic factor therapy in treating stroke[J].Stroke,2009,40(2):510-515.
[5] Borlongan CV,Glover LE,Tajiri N,et al.The great migration of bone marrow-derived stem cells toward the ischemic brain:therapeutic implications for stroke and other neurological disorders [J].Prog Neurobiol,2011,95(2):213-228.
[6] Mine Y,Tatarishvili J,Oki K,et al.Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats[J].Neurobiol Dis,2013,52:193-201.
[7] Abdi R,Fiorina P,Adra CN,et al.Immunomodulation by mesenchymal stem cells:a potential therapeutic strategy for type 1 diabetes[J].Diabetes,2008,57(7):1759-1767.
[8] Kitada M,Dezawa M.Induction system of neural and muscle lineage cells from bone marrow stromal cells;a new strategy for tissue reconstruction in degenerative diseases[J].Histol Histopathol,2009,24(5):631-642.
[9] Kurozumi K,Nakamura K,Tamiya T,et al.BDNF genemodified mesenchymal stem cells promote functional recovery and reduce infarct size in the rat middle cerebral artery occlusion model[J].Mol Ther,2004,9(2):189-197.
[10] Kurozumi K,Nakamura K,Tamiya T,et al.Mesenchymal stem cells that produce neurotrophic factors reduce ischemic damage in the rat middle cerebral artery occlusion model[J].Mol Ther,2005,11(1):96-104.
[11] Helledie T,Nurcombe V,Cool SM.A simple and reliable electroporation method for human bone marrow mesenchymal stem cells[J].Stem Cell Dev,2008,17(4):837-848。
[12] Chen J,Li Y,Katakowski M,et al.Intravenous bone marrow stromal cell therapy reduces apoptosis and promotes endogenous cell proliferation after stroke in female rat[J].J Neurosci Res,2003,73(6):778-786.
[13] Crigler L,Robey RC,Asawachaicharn A,et al.Human mesenchymal stem cell subpopulations express avariety of neuro-regulatory molecules and promote neuronal cell survival and neuritogenesis [J].Exp Neurol,2006,198(1):54-64.
[14]Arvidsson A,Collin T,Kirik D,et al.Neuronal replacement from endogenous precursors in the adult brain after stroke[J].Nat Med,2002,8(9):963-970.
[15] Liu YP,Seckin H,Izci Y,et al.Neuroprotective effects of mesenchymal stem cells derived from human embryonic stem cells in transient focal cerebral ischemia in rats[J].J Cereb Blood Flow Metab,2009,29(4):780-791.

