慢性酒精摄入所致的肝细胞上皮-间充质转化参与小鼠肝纤维化形成*
孙玉生, 林 波, 王思谦, 刘 悦, 张优敬, 郑乃芮, 皇甫超申△
(河南大学1护理学院,2医学院环境医学研究所,河南开封475004)
随着酗酒人群的增加,慢性酒精性肝病(alcoholic liver disease,ALD)发病率逐年上升。ALD可表现为酒精性肝炎,酒精性肝脂肪变,酒精性肝纤维化(alcoholic hepatic fibrosis,AHF)和酒精性肝硬化。肝纤维化是肝脏损伤后进行纤维化修复的一个过程,启动这个过程的是酒精性肝损伤时产生的过氧化物质及激活的库夫氏细胞、浸润的白细胞,甚至有损伤的肝细胞释放的细胞因子,尤其是转化生长因子 β1(transforming growth factor β1,TGF-β1)、肿瘤坏死因子、白细胞介素等。活性氧或细胞因子激活静止的肝星状细胞,使之转化为活化的肌成纤维细胞,产生大量胶原纤维,分割肝小叶,造成假小叶,最终导致肝硬化。肝纤维化进程能否被逆转是治疗和预防肝纤维化的关键。中药预防和逆转肝纤维化的实践已经提示我们肝纤维化是可以部分逆转的[1],但是其具体机制尚不清楚。
最近发现,肝细胞通过上皮-间充质转化(epithelial-mesenchymal transition,EMT)产生胶原纤维参与肝纤维化进程[2]。在体外用 TGF-β1可诱导肝细胞发生EMT[3],在人肝纤维化活检标本内也发现了肝细胞发生EMT现象[4]。但是,在用四氯化碳急性肝毒性诱导肝纤维化的小鼠模型上出现了两种截然相反的实验结果:同样是用世系追踪技术,将肝细胞和肝星状细胞分别转入标签基因,Taura等[5]发现肝细胞内白蛋白不能与间充质标志物α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和成纤维细胞特异性蛋白-1(fibroblast-specific protein 1,FSP-1)共定位,认为肝细胞不可能发生EMT;Zeisberg等[6]发现肝纤维化进程中肝细胞内白蛋白与间充质标志物α-SMA和FSP-1共定位,肝细胞发生了EMT。目前对肝细胞是否通过EMT参与肝纤维化过程仍存在很大争议[7]。然而,搞清楚肝纤维化进程中肝内上皮细胞是否会发生EMT,是否通过EMT参与肝纤维化对预防和治疗肝纤维化非常重要。因为EMT是一个可逆的过程,在一定条件下会发生间充质-上皮转化(mesenchymal-epithelial transition,MET)。人肝纤维化活检标本不同于小鼠四氯化碳摄入后的肝纤维化标本,毒物摄入的剂量和时间、选取标本的时机、观察指标都是引起目前关于肝细胞是否通过EMT参与肝纤维化争议的原因。为了更好地模拟临床肝纤维化进程,本课题单纯用慢性酒精摄入诱导肝纤维化,通过对肝损伤和纤维化修复指标进行观察,分析肝纤维化进程中肝细胞是否发生了EMT及其对肝纤维化的影响。
材料和方法
1 试剂和主要仪器
无水乙醇购自天津市晨福化学试剂厂(分析纯);可见光法丙二醛(malondialdehyde,MDA)检测试剂盒购自碧云天;超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)检测试剂盒购自南京建成生物工程研究所;SP免疫细胞化学检测试剂盒和DAB显色剂购于福州迈新生物试剂公司;羊抗鼠白蛋白、E-钙黏素、α-SMA 和 TGF-β1单克隆抗体购自NeoMarkers;抗S100A4(FSP-1)抗体购自Abcam;FITC和Texas Red荧光标记Ⅱ抗、兔抗鼠缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)抗体、增强化学发光(enhanced chemiluminescence,ECL)显色试剂盒、辣根过氧化物酶标记的羊抗兔IgG及β-actin抗体购自碧云天。病理形态观察用 BX51荧光显微镜(Olympus),电荷耦合器(charge-coupled device,CCD)拍照,免疫荧光共定位采用激光共聚焦显微镜(FV1000,Olympus),选用×60油镜进行观察和图像采集;蛋白质定量用UV-540紫外-可见分光光度计(UNICAM)。SDS-PAGE和蛋白质转移用DYY-7C型电泳仪(北京市六一仪器厂)完成。用WD-9413B凝胶成像分析仪(北京市六一仪器厂)检测蛋白质印迹条带吸光度。
2 动物饲养与分组实验
5~6周龄健康 C57BL/6雄性小鼠30只(合格证号为SCXK京2006-0009),体重18~22 g,购自北京维通利华实验动物技术有限公司。小鼠各组单笼饲养,室温控制在 20~25℃,相对湿度 60% ~70%,定期更换垫料消毒。采光控制为8 h光照,16 h黑暗(5:00 PM~9:00 AM)。自由进食水,食物为河南省实验动物中心提供的小鼠标准饲料,饮用水选用实验室自制单蒸水。随机分为3组,每组10只:(1)对照组用蒸馏水代替酒精灌胃 (20 mL·kg-1·d-1);(2)低剂量酒精组,每天灌胃酒精量2.0 g·kg-1·d-1;(3)高剂量酒精组每天灌胃酒精量4.0 g·kg-1·d-1。所有动物在第5个月末被处死。计算肝脏指数。肝脏指数(%)=肝脏质量/小鼠体重×100%。取血和肝组织进行生化和病理形态学检测。
3 肝脏病理组织学检查
取每只小鼠肝左叶相同部位的一小块肝组织,用10%甲醛溶液固定,石蜡包埋切片,HE染色光镜下观察一般形态;Masson染色观察胶原纤维。HE染色肝组织炎症活动程度用Scheuer评分,Massion胶原纤维染色纤维化程度用Schmid M评分。
4 肝细胞凋亡检测
采用TUNEL法检测小鼠肝细胞凋亡,方法按试剂盒说明书进行。用已知阳性片作阳性对照,阴性对照用PBS代替TdT酶反应液,其余步骤相同。以平均每100个肝组织细胞核中TUNEL荧光标记呈凋亡特征的细胞核个数作为肝组织细胞凋亡指数。
5 肝生化指标及氧化指标的检测
实验结束时,小鼠麻醉后,摘眼球取血,3 500×g离心10 min,分离血清,用全自动生化分析仪检测血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)的活性。每例均切取肝右叶相同部位一小块新鲜肝组织,以4℃ 生理盐水制成10% 组织匀浆,3 500×g离心10 min,取上清液按试剂盒说明书测定组织CAT、SOD的活性及和MDA的含量。另外留取一部分新鲜肝组织用于Western blotting检测蛋白表达。
6 免疫荧光组织化学检测蛋白表达
所有标本经10%中性甲醛固定,常规石蜡包埋,切片厚度为6 μm。切片脱蜡水化,柠檬酸盐缓冲液抗原修复,加入Ⅰ抗,4℃冷藏2 h,室温放置30 min,PBS缓冲液冲洗后加入荧光标记的Ⅱ抗,室温孵育15 min,PBS缓冲液洗片,DAPI核复染。用已知阳性切片作为阳性对照,用PBS代替Ⅰ抗作阴性对照。E-钙黏素分布于肝细胞膜上、白蛋白位于肝细胞质内,呈绿色荧光;α-SMA和FSP-1蛋白位于细胞质内,呈红色荧光。白蛋白和FSP-1共定位的细胞呈橙色。
7 Western blotting检测蛋白表达
新鲜肝组织低温匀浆后,用RIPA 200 μL充分裂解提取蛋白,考马斯亮蓝G-250法测样品蛋白浓度,均衡每组蛋白浓度后,以12%SDS-PAGE凝胶电泳分离。电转移蛋白至NC膜,5%脱脂奶粉封闭过夜,加入Ⅰ抗(1∶200)于4℃封闭袋中孵育过夜,Ⅱ抗(辣根过氧化物酶标记的羊抗鼠抗体,1∶4 000)孵育1 h。化学发光法显示结果,压片曝光。凝胶图像分析系统拍照,检测蛋白质印迹条带。先计算各蛋白表达吸光度与β-actin吸光度的比值,然后将对照组的蛋白吸光度比值设定为1,得出各处理组与对照组蛋白表达相对吸光度值。
8 统计学处理
数据用均数±标准差(mean±SD)表示,应用SPSS 12.0软件包处理,经正态分布和方差齐性检验后,进行单因素方差分析比较各处理组间差别,以P<0.05为差异有统计学意义。
结 果
1 慢性酒精摄入对小鼠肝脏指数和血清转氨酶的影响
实验结束时,低剂量酒精组小鼠肝脏指数与对照组相比无明显改变;高剂量酒精组肝脏指数与对照组比较明显升高(P<0.05)。各酒精组小鼠血清ALT和AST活性比对照组明显升高(P<0.05),见表1。
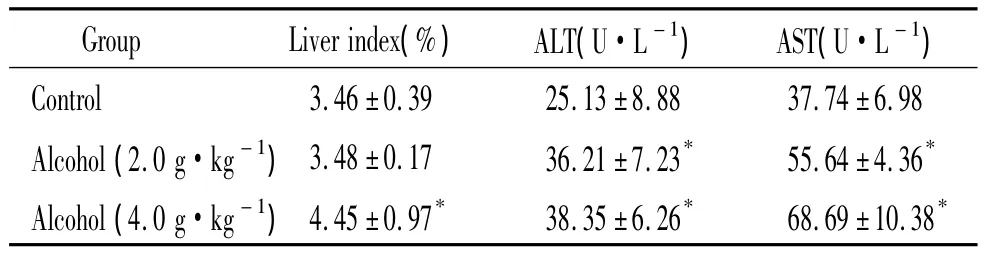
表1 慢性酒精摄入对小鼠肝脏指数、血清ALT和AST活性的影响Table 1.Effects of chronic alcohol intake on liver index,and serum ALT and AST levels in mice(Mean±SD.n=10)
2 慢性酒精摄入对小鼠肝脏病理形态的影响
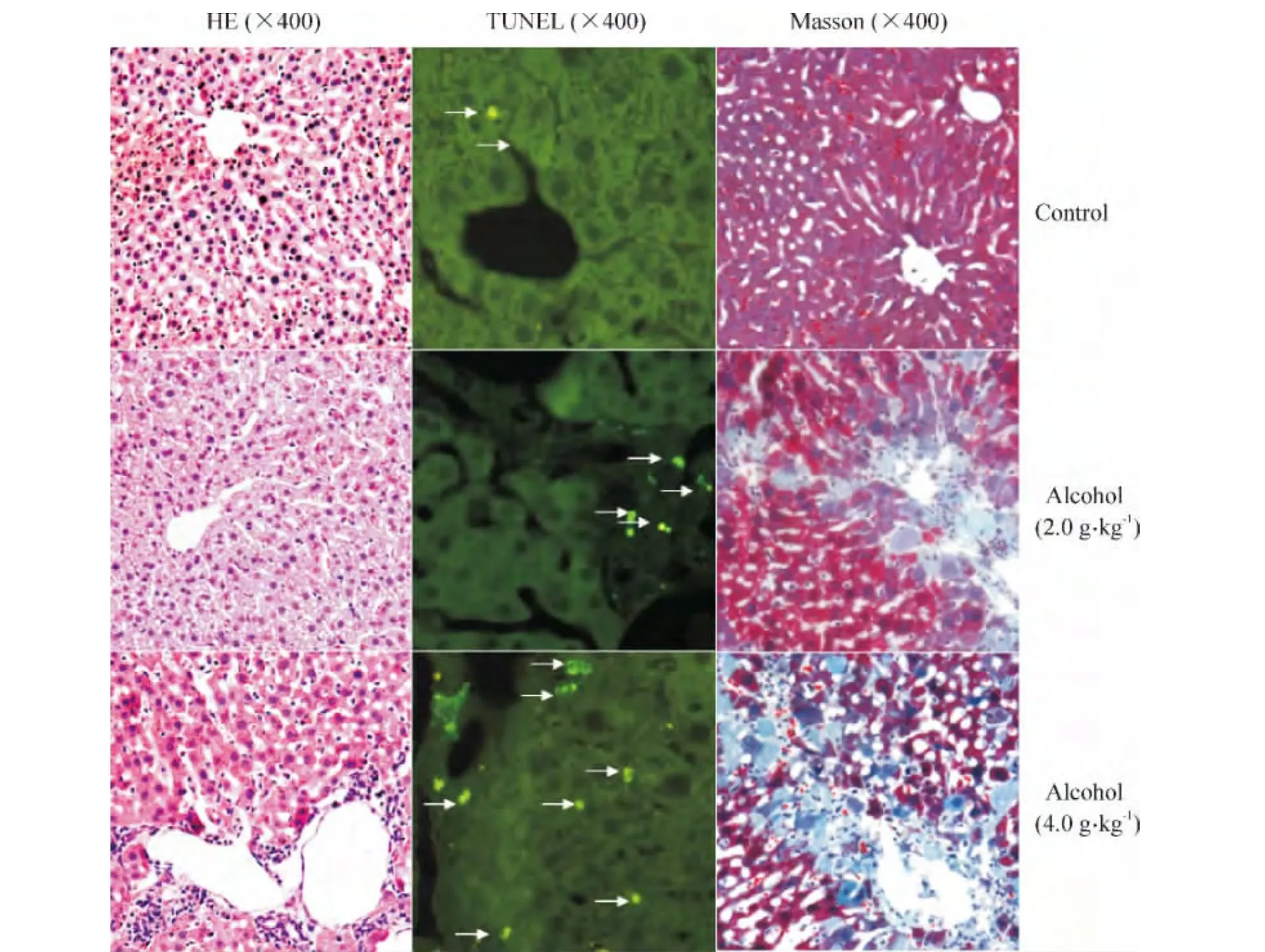
Figure 1.Chronic alcohol intake induced liver injury and fibrosis in C57BL/6J mice.C57BL/6J mice were fed with water or alcohol by gavage for 5 months,and the histological analysis of the liver was performed.The first column,representative images of HE staining,showed that liver fatty degeneration induced by alcohol administration was enhanced in low-dose alcohol-treated mice.The second column,TUNEL assay of liver sections,showed that the high-dose alcohol-treated mice displayed an increase in TUNEL-positive cells(marked by arrows).The third column,hepatic tissue sections with Masson′s trichrome staining,showed periportal fibrosis with short septa extending into lobules in low-dose alcohol-treated mice or porto-portal septa in high-dose alcohol-treated mice,suggesting that hepatic fibrosis was significantly worsened in the high-dose alcohol-treated mice as compared with the low-dose alcohol-treated mice.图1 慢性酒精摄入导致小鼠肝损伤和纤维化
对照组肝脏呈暗红色,肝小叶结构完整,肝组织内个别细胞凋亡,肝纤维化程度Schmid M评分为0。和对照组相比,低剂量酒精组肝体积略大,颜色稍黄,质地稍硬,切面未见明显结节;光镜下HE染色可见肝细胞内密布大小不一的脂肪空泡,尤其是中央静脉周围肝细胞内脂肪空泡最多,炎症活动度Scheuer评分明显高于对照组;TUNEL荧光标记阳性的凋亡细胞也主要分布于中央静脉周围,肝组织细胞凋亡指数明显升高;Masson三染色结果显示,从汇管区至中央静脉有纤维组织条带,条带周围肝细胞内呈蓝色,肝纤维化程度Schmid M评分也升高。高剂量酒精组肝脏体积缩小,质地硬,呈褐色,切面可见弥漫性的小结节;HE染色未见明显的脂肪空泡,汇管区周围大量炎症细胞浸润,可见界板肝细胞碎片坏死,炎症活动度Scheuer评分高于对照组和低剂量酒精组;TUNEL阳性凋亡细胞增多且分布于肝小叶内,肝组织细胞凋亡指数高于对照组和低剂量酒精组;Masson三染色可见纤维组织呈条带状分割肝小叶,形成假小叶,纤维条带内和周围密布星形细胞和炎症细胞,肝纤维化程度Schmid M评分同样高于对照组和低剂量酒精组,见图1、表2。

表2 慢性酒精摄入对小鼠肝脏炎症评分、细胞凋亡和纤维化程度的影响Table 2.Effects of chronic alcohol intake on the inflammation,apoptosis and fibrosis in the liver of mice(Mean±SD.n=10)
3 慢性酒精摄入对小鼠肝脏氧化和抗氧化指标的影响
第5个月末实验结束时,无论低剂量酒精组还是高剂量酒精组小鼠肝脏MDA与对照组相比均明显升高(P<0.05),而高、低剂量组之间则无显著差别;各酒精组小鼠肝组织SOD和CAT活性比对照组明显下降(P<0.05),高、低剂量组之间差异也无统计学意义,见表3。
4 慢性酒精摄入对小鼠肝脏EMT标志蛋白表达的影响

Figure 2.Effect of chronic alcohol intake on hepatocyte epithelial-mesenchymal transition in livers of C57BL/6J mice.The mice were given(ig)alcohol for 5 months.The first and second columns showed the representative images of E-cadherin(green)and α-SMA(red)immunofluorescence examination.The third column showed hepatic tissue sections counterstained with DAPI(blue).The alcohol treatment significantly decreased E-cadherin expression compared with control mice,while α-SMA protein expression was significantly increased in the alcohol-treated mice.图2 慢性酒精摄入对小鼠肝脏细胞上皮-间充质转化的影响
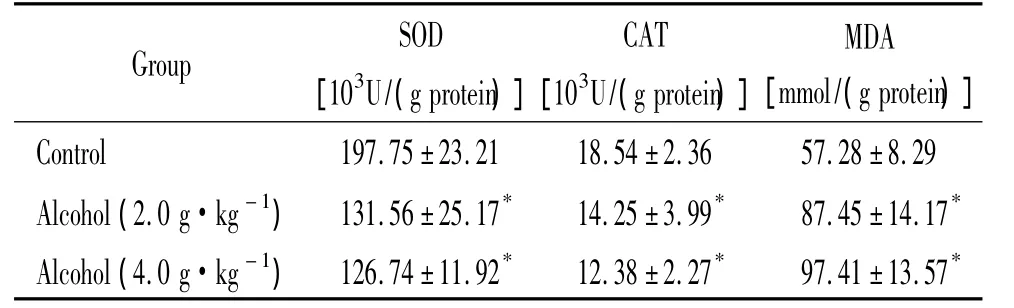
表3 慢性酒精摄入对小鼠肝组织SOD、CAT活性和MDA含量的影响Table 3.Effects of chronic alcohol intake on the activity of SOD and CAT,and the content of MDA in the liver of mice(Mean±SD.n=10)
肝脏上皮标志物E-钙黏素(绿色)和间充质活化的肌成纤维细胞标志物α-SMA(红色)免疫荧光双标记结果显示:对照组E-钙黏素均匀连续分布于肝细胞膜上,呈连续绿色荧光;汇管区周围有少量小细胞表达α-SMA蛋白,并未见肝小叶内肝细胞表达α-SMA。低剂量酒精组中央静脉周围肝细胞膜上连续绿色荧光减弱,提示细胞膜上E-钙黏素表达减少;而位于汇管区周边的肝小叶内α-SMA蛋白阳性细胞增加。高剂量酒精组肝细胞膜上连续绿色荧光减弱更明显,提示肝细胞膜上E-钙黏素表达下降更明显;可见汇管区及肝小叶内α-SMA蛋白阳性细胞增多较低剂量酒精组明显增加,见图2。
5 慢性酒精摄入对小鼠肝脏白蛋白和FSP-1蛋白表达的影响
图3显示的是用白蛋白(绿色荧光)和FSP-1蛋白(红色荧光)双标记的激光共聚焦图片。对照组肝细胞质内白蛋白丰富,未显示红色荧光,肝内个别成纤维细胞呈红色荧光,散落于肝细胞之间,未与肝细胞共定位。在低剂量酒精组可见肝细胞内绿色荧光和红色荧光共定位,这意味着肝细胞内存在FSP-1蛋白,也就是说肝细胞获得了一定的间充质成纤维细胞表型,呈现不完全EMT现象。高剂量酒精组肝细胞内白蛋白明显减少,绿色荧光和红色荧光共定位的现象少见,而完全呈现红色荧光的肝细胞明显比低剂量酒精组增加,说明这些肝细胞发生了完全EMT。
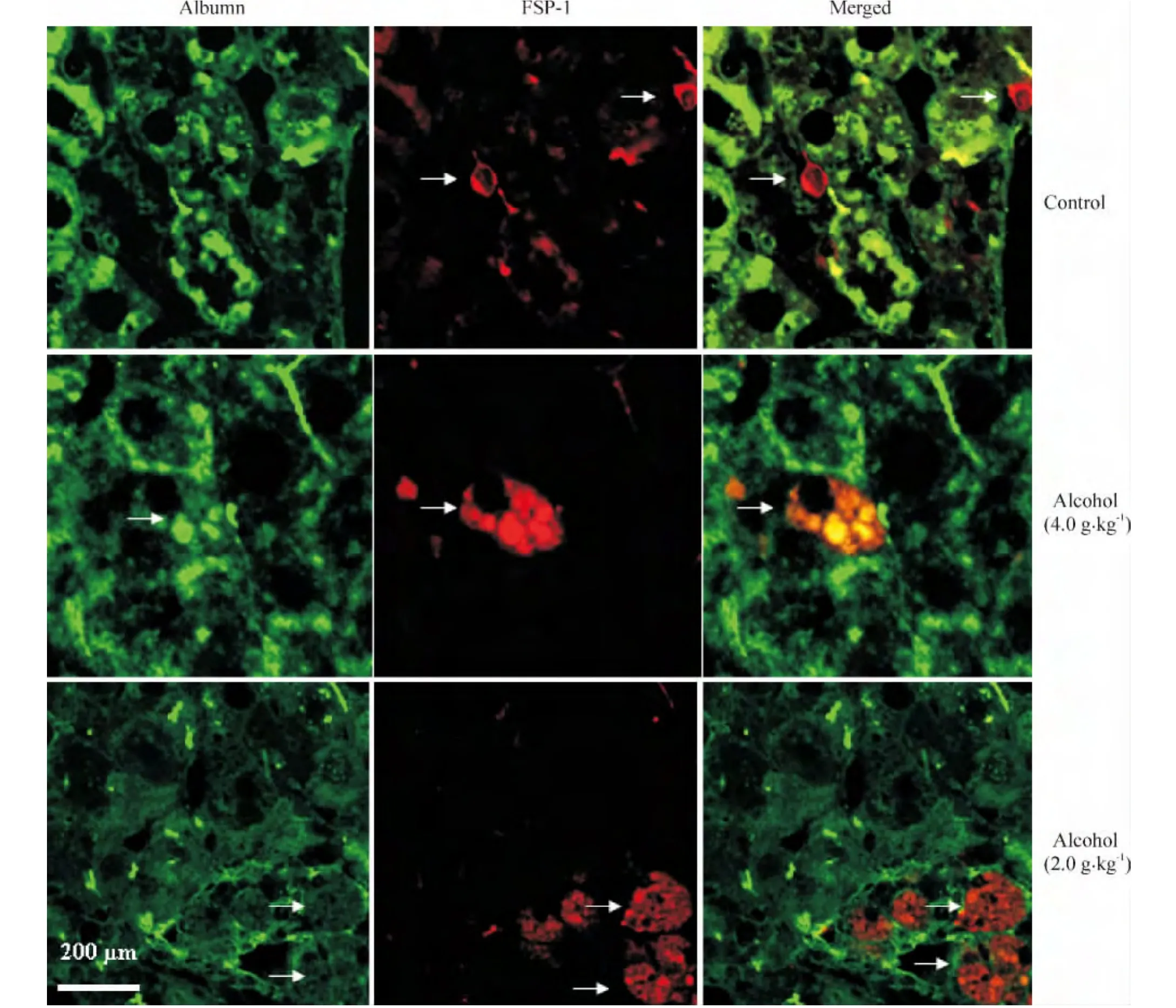
Figure 3.Chronic alcohol intake stimulated hepatocyte epithelial-mesenchymal transition in livers of C57BL/6J mice.The mice were given(ig)alcohol for 5 months,and the expression of albumin and fibroblast-specific protein 1(FSP-1)in liver tissues was analyzed by immunofluorescent confocal microscopy.The first and second columns showed the representative images of albumin(green)and FSP-1(red)immunofluorescence examination in control mice and the mice with low-dose and high-dose alcohol treatment.The third column showed the merged images.Representative cells at the same position were marked by arrows.FSP-1 immunostaining(red)and albumn immunostaining(green)overlapped and seem to be co-localized in the hepatocytes of low-dose alcohol group;only FSP-1 positive hepatocytes with negative staining for albumin were showed in high-dose alcohol group.图3 慢性酒精摄入刺激小鼠肝细胞发生上皮-间充质转化
6 慢性酒精摄入对小鼠肝脏EMT相关蛋白表达的影响
Western blotting结果显示,与对照组相比,各组酒精摄入的小鼠肝组织内E-钙黏素表达减少,α-SMA、FSP-1、TGF-β1和 HIF-1α 蛋白表达均升高;与低剂量酒精组相比,高剂量组E-钙黏素表达更少,α-SMA、FSP-1和 TGF-β1蛋白表达均升高更明显,而HIF-1α蛋白表达无明显差异,见图4。

Figure 4.Effects of chronic alcohol intake on expression of E-cadherin ,α-SMA,FSP-1,TGF-β1and HIF-1α in livers of C57BL/6J mice detected by Western blotting analysis.Mean±SD.n=10.*P<0.05 vs control group;#P<0.05 vs alcohol(2.0 g·kg-1)group.图4 慢性酒精摄入对C57BL/6J小鼠肝E-钙黏素、α-SMA、FSP-1、TGF-β1和HIF-1α表达的影响
讨 论
酒精通过肝细胞内细胞色素P4502E1和酒精脱氢酶系统产生过多的活性氧,酒精代谢产物乙醛也发挥氧化应激作用,从而使肝细胞损伤,转氨酶释放入血,致使血清ALT和AST水平升高[8]。活性氧和炎症细胞释放的细胞因子造成肝细胞持续损伤,肝细胞内一些活性因子也释放到细胞外,激活肝内库夫氏细胞。酒精持续摄入导致这些炎症细胞和受损的肝细胞不断释放TGF-β1、肿瘤坏死因子、白细胞介素等促炎症因子,这些促炎因子连同活性氧、乙醛等有害物质对肝细胞造成持续损害。这样肝脏利用肝细胞再生对受损的肝脏进行完全修复几乎不可能完成,而纤维性修复就成了慢性酒精性肝病进行修复的主要形式,导致的后果是肝纤维化进展和肝硬化形成。参与肝纤维化进展的主要是激活的肌成纤维细胞合成分泌的胶原蛋白。肌成纤维细胞的主要来源是肝内增殖与活化的星形细胞。正常情况下,肝内只有少量的星形细胞,体积较小,位于内皮细胞和肝细胞之间的间隙内,当肝脏持续严重受损时,大量细胞致炎因子被释放,激活星形细胞使之增殖并转化为活化的肌成纤维细胞[9]。肌成纤维细胞分泌胶原组成的胶原纤维杂乱无章,与汇管区增生的纤维相互交织,分割肝小叶,形成假小叶,最终演变为肝硬化。本实验发现,持续的低剂量酒精摄入,肝组织氧化指标MDA增加,抗氧化指标SOD和CAT活性下降,肝细胞处于氧化应激状态,造成肝细胞损伤和脂肪变性,少量肝细胞凋亡和轻度肝纤维化;高剂量酒精摄入,肝组织氧化指标MDA增加,抗氧化指标SOD和CAT活性下降更加明显,严重的过氧化应激直接导致肝细胞坏死和凋亡增加,从而引起大量胶原纤维增生和假小叶形成。这些结果表明,肝纤维化的程度取决于肝氧化损伤的程度,也可以说取决于酒精摄入的剂量。
E-钙黏素分布于肝细胞膜上,是肝细胞间相互连接的主要物质,肝细胞受损时,细胞膜上E-钙黏素减少,相邻肝细胞间隙扩大,这样就有可能导致细胞凋亡增加[10]。肝细胞为了适应氧化应激和有害细胞因子增多的环境,往往会通过EMT的方式发生表型转化,只有转化为间充质细胞表型,才能更好地耐受细胞凋亡[11]。EMT是指上皮细胞失去彼此黏附,获得运动和侵袭能力,呈现出间质细胞表型。通常将EMT分为3型:1型是指胚胎发育时发生的EMT,2型指组织损伤修复时发生的EMT,3型是癌侵袭转移时发生的EMT。这3种EMT之中只有2型EMT可产生胶原纤维,参与器官纤维化形成[12]。肾小管上皮细胞通过EMT产生胶原参与肾纤维化已经得到证实[13],但是肝细胞通过EMT是否参与纤维化目前还存在争议。
本实验发现,酒精摄入导致肝细胞E-钙黏素表达下降,间充质标志物α-SMA和FSP-1表达增多,提示肝细胞发生了EMT。因为α-SMA是激活的肌成纤维细胞的标志物,正常情况下存在于肝小叶汇管区血管周围内皮细胞和平滑肌细胞内。如果肝细胞内出现α-SMA阳性颗粒,意味着肝细胞有可能转化为肌成纤维细胞的表型。为了进一步验证酒精摄入是否真的导致了肝细胞发生EMT,本实验选用成纤维细胞特异性标志物FSP-1蛋白和肝细胞特异性标志物白蛋白进行免疫荧光共定位,结果发现,低剂量酒精组肝细胞出现了FSP-1和白蛋白共定位,而高剂量酒精组,FSP-1只出现在几乎无白蛋白表达的肝细胞内。因为FSP-1是来自于EMT演变的成熟肌成纤维细胞标志物,正常的肝星形细胞和产生1型胶原的肌成纤维细胞(α-SMA阳性)都不表达 FSP-1[14]。所以这些结果表明,低剂量酒精组肝细胞发生了不完全EMT,高剂量酒精组肝细胞发生完全EMT,参与肝纤维化进程。
慢性酒精性肝损伤时肝细胞发生EMT的原因可能与下列因素有关:(1)TGF-β1大量升高,而TGF-β1既可诱导肝细胞凋亡,也可诱导肝细胞EMT[15];(2)酒精摄入造成肝内活性氧大量增加,而活性氧可诱导肝细胞EMT[16];(3)肝细胞脂肪变和水样变性,纤维组织增生,导致肝血窦变窄,肝脏淤血,肝细胞缺氧,由此导致肝细胞内HIF-1α累积,而HIF-1α可直接导致肝细胞 EMT[17]。
尽管肝细胞通过EMT参与肝纤维化的程度和机制都不很清楚,但是通过设计药物,阻断引起EMT的信号通路,从而拮抗肝纤维化,将成为预防和治疗肝硬化的又一措施。
[1] Li P,Zhang HJ,Zheng LT.The theory of homogeny of liver and kidney in the treatment of kidney and liver fibrosis[J].Chin J Integr Med,2012,18(4):250-252.
[2] 韩 冰,谢汝佳,洪 琴,等.肝纤维化病理过程中ZEB1和ZEB2的动态表达变化及意义[J].中国病理生理杂志,2012,28(9):1639-1643.
[3] Bi WR,Yang CQ,Shi Q.Transforming growth factor-β1induced epithelial-mesenchymal transition in hepatic fibrosis[J].Hepatogastroenterology,2012,59(118):1960-1963.
[4] Parola M,Pinzani M.Hepatic wound repair[J].Fibrogenesis Tissue Repair,2009,2:4.
[5] Taura K,Miura K,Iwaisako K,et al.Hepatocytes do not undergo epithelial-mesenchymal transition in liver fibrosis in mice[J].Hepatology,2010,51(3):1027-1036.
[6] Zeisberg M,Yang C,Martino M,et al.Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition[J].J Biol Chem,2007,282(32):23337-23347.
[7] Xu XF,Dai HP.Type 2 epithelial mesenchymal transition in vivo:truth or pitfalls?[J].Chin Med J(Engl),2012,125(18):3312-3317.
[8] Wu D,Cederbaum AI.Oxidative stress and alcoholic liver disease[J].Semin Liver Dis,2009,29(2):141-154.
[9] 阎 明,刘慧敏,张喜红,等.DDR2与MMP2在酒精性肝病肝窦毛细血管化中的协同表达[J].中国病理生理杂志,2010,26(8):1515-1520.
[10] Peyre L,Zucchini-Pascal N,de Sousa G,et al.Effects of endosulfan on hepatoma cell adhesion:epithelial-mesenchymal transition and anoikis resistance[J].Toxicology,2012,300(1-2):19-30.
[11] Pinzani M.Epithelial-mesenchymal transition in chronic liver disease:fibrogenesis or escape from death?[J].J Hepatol,2011,55(2):459-465.
[12] Choi SS,Diehl AM.Epithelial-to-mesenchymal transitions in the liver[J].Hepatology,2009,50(6):2007-2013.
[13] Insel PA,Murray F,Yokoyama U,et al.cAMP and Epac in the regulation of tissue fibrosis[J].Br J Pharmacol,2012,166(2):447-456.
[14] Österreicher CH,Penz-Österreicher M,Grivennikov SI,et al.Fibroblast-specific protein 1 identifies an inflammatory subpopulation of macrophages in the liver[J].Proc Natl Acad Sci U S A,2011,108(1):308-313.
[15]Yang Y,Pan X,Lei W,et al.Regulation of transforming growth factor-β1-induced apoptosis and epithelial-to-mesenchymal transition by protein kinase A and signal transducers and activators of transcription3[J].Cancer Res,2006,66(17):8617-8624.
[16]徐红瑞,林 波,王思谦,等.亚硝酸钠对H22荷瘤小鼠移植瘤上皮-间质转化的促进作用[J].药学学报,2012,47(11):1470-1476.
[17] Copple BL.Hypoxia stimulates hepatocyte epithelial to mesenchymal transition by hypoxia-inducible factor and transforming growth factor-β-dependent mechanisms[J].Liver Int,2010,30(5):669-682.

