反复正加速度暴露致兔缺血心肌动作电位变化的研究
王兰,端木鲁健,焦琳,柳百梅,孙红娇,李玉茜,于心亚,黄丛春,罗慧兰,王俊华,王建昌
航空航天飞行器尤其是战斗机会对人体心脏器官产生不利影响,其中以正加速度(+Gz)最为突出[1-2]。多年的航空经验显示,飞行人员长期飞行之后,心律失常的发生率偏高。另外,患有冠心病的飞行人员不仅影响心脏泵血功能导致血流动力学障碍,还可引起心脏的电不稳定而导致心律失常,甚至恶性心律失常。既往研究表明,加速度会诱发或加重心律失常[3],但目前对于发生机制缺乏相关的深入研究。本课题主要通过研究正常和缺血心肌在模拟飞行环境的+Gz暴露条件下的单相动作电位(monophasic action potential,MAP)变化情况,推断主要心肌细胞离子通道的功能变化。
1 材料与方法
1.1 实验对象及分组 健康、雄性、成年新西兰大白兔60只,体重2.5~3.5kg,由解放军总医院附属第一医院实验动物科提供并饲养。将实验动物随机分为4组:对照组(A组)、+Gz组(B组)、缺血组(C组)、缺血+加速度组(D组),每组15只。
1.2 材料及主要仪器 动物离心机(空军航空医学研究所)、小动物呼吸机(上海奥尔科特仪器有限公司)、电生理刺激仪DF-5A型(苏州东方电子仪器厂)、Medlab4c-501生物信号采集系统MD3000(淮北正华生物仪器设备有限公司)、自制复合电极,手术器械及医用缝线等。
1.3 方法
1.3.1 心肌缺血模型的制备 C、D组制备心肌缺血模型。兔术前禁食1d,仰卧固定于兔固定架上,3%戊巴比妥30mg/kg耳缘静脉麻醉后,静脉推注肝素1000U抗凝。四肢皮肤刺入9号金属针头,与生物信号采集处理系统心电图导线连接,观察并记录标准肢体导联Ⅱ心电图。严格按无菌操作手术,逐层切开颈部皮肤行气管插管,连接动物呼吸机,频率22~25次/min,潮气量10ml/kg。沿胸骨左缘第3、4肋处剪断肋骨,将左侧胸壁向外翻起,剪开心包,充分暴露左心室前壁。于左心耳下2mm处穿“6-0”号丝线,打一活结逐渐拉紧丝线,造成冠状动脉前降支心肌缺血。方法是拉线的同时观察心电图Ⅱ导联的变化,以出现S-T段压低、抬高或T波倒置等S-T段和(或)T波的变化证明形成了冠脉狭窄、心肌缺血;调整线结的松紧度以达到既形成缺血而又不将血管完全阻断的目的;然后将丝线打死结形成血管固定性狭窄。缝合关闭胸腔送动物房饲养。D组术后肌内注射青霉素80万U、2次/d,共3d。
1.3.2 +Gz暴露的实验方法 B组和D组进行+Gz暴露。使用动物离心机进行+Gz暴露:+Gz组兔置于兔笼中(内径30cm×20cm×15cm),头朝向离心机轴心,兔笼固定于离心机上。离心机半径为2m,由计算机进行加速度程序控制。+Gz组暴露条件:G值增长率约为+0.5Gz/s,逐渐达到目标值+8Gz,于+8Gz每次持续暴露时间为1min,间隔3min,3次/d,共7d。
1.3.3 单向动作电位的记录 动物的固定、备皮、开胸暴露心脏方法同制备心肌缺血时的实验方法。自制接触电极固定于装有弹簧装置的固定架上,一端接触电极光滑球面与左心室表面接触,垂直轻放,略施压力,以弹簧拉伸长度限定电极对心脏组织的统一压力,电极以不因心脏搏动而移位、心电图平稳为准,另一端与生物信号采集处理系统连接,参考电极夹在胸口皮下组织。生物信号采集处理系统将所测得的信号放大后输入电脑并观察记录。诱发心律失常方案:将心外膜起搏电极放置于左心室表面,参考电极与皮肤相连进行程序刺激,S1S1刺激频率从150次/min开始,逐次递增10次,直至300次/min结束。
1.4 观察记录指标 ①MAP记录指标(图1):复极达50%振幅的单相动作电位时程(MAPD50);复极达90%振幅的单相动作电位时程(MAPD90);单相动作电位的振幅(MAPA);0相最大上升速率(Vmax)。②S1S1刺激时心律失常诱发率。
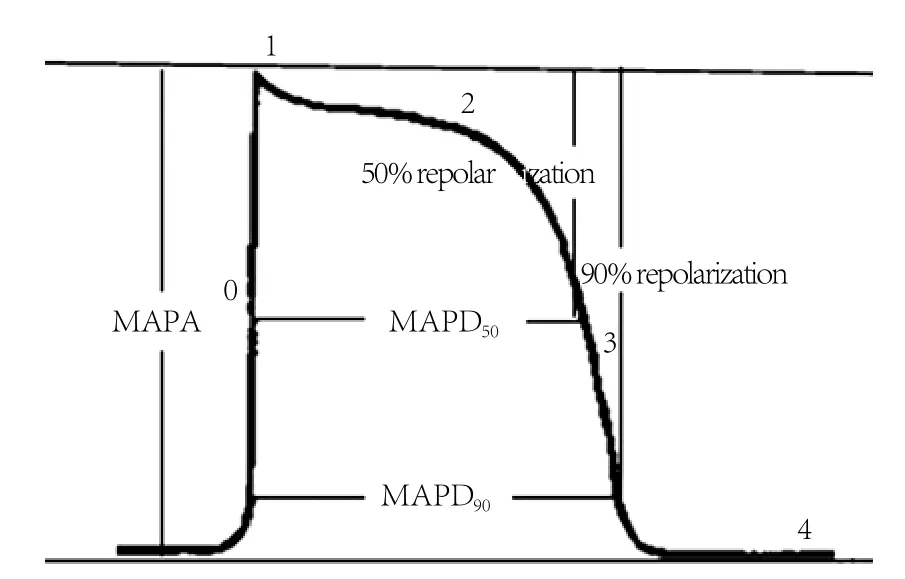
图1 MAP的测量示意图Fig. 1 Chart of monophasic action potential (MAP)measurement
1.5 统计学处理 采用SPSS 15.0进行分析,所有数据均以表示,组间比较采用完全随机设计的单因素方差分析,进一步行多个样本均数间的SNK-q检验,心律失常发生率比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 术后兔存活情况 4组中A组无动物死亡,B组中有1只死亡,可能因为加速度暴露引发心脏疾病;C组有1只在实验过程中因程序刺激出现室颤而死亡;而D组有2只动物在饲养期间不明原因死亡。
2.2 心肌细胞MAP参数的变化 结果显示,各组间MAPA和Vmax差异均无统计学意义(P>0.05);与A组比较,B、C、D组MAPD50和MAPD90均明显缩短(P<0.05),且缩短程度呈递减趋势(P<0.05,表1);心肌缺血后的动作电位时程与缺血前比较明显缩短(图2)。
2.3 心律失常诱发率的比较 结果显示,各组心律失常的诱发情况如下:A组1例;B组6例;C组7例,其中1例因出现室颤而死亡;D组12例,包括室性早搏(图3A)、室性心动过速(图3B)等,部分为未行刺激而自发室性早搏的情况。除C组与B组相比心律失常诱发率差异无统计学意义外,B、C、D组均较A组容易诱发,D组又分别较B、C组容易诱发(P<0.05),呈现加速度和缺血双重因素的叠加效应(表2)。
表1 各组MAP的变化情况±s,n=15)Tab.1 Changes of monophasic action potential in each group ( s, n=15)

表1 各组MAP的变化情况±s,n=15)Tab.1 Changes of monophasic action potential in each group ( s, n=15)
A. Control group; B. Acceleration group; C. Ischemia group; D . Ischemia undergoing positive acceleration group. MAPA. Monoph asic action potential amplitude; MAPD 50. Monophasic action potential duration at repolarization of 50% amplitude; MAPD 90. Monophasic action potential duration at repolarization of 90% amplitude; V max. Maximum rising rate of phase 0. (1) P<0.05 compared with group A; (2) P<0.05 compared with group B; (3)P<0.05 compared with group C
Group MAPA (mV) Vmax (mV/s) MAPD50 (ms) MAPD90 (ms)A 32.51±1.49 226.73±4.31 130.44±4.56 139.94±4.30 B 32.30±1.02 225.82±3.80 124.01±3.22 (1) 133.38±3.06 (1)31.72±1.16 224.15±6.77 114.92±3.59 (1)(2) 124.42±3.62 (1)(2)D 31.02±1.35 221.50±6.23 107.96±5.70 (1)(2)(3) 117.33±5.63 (1)(2)(3)C
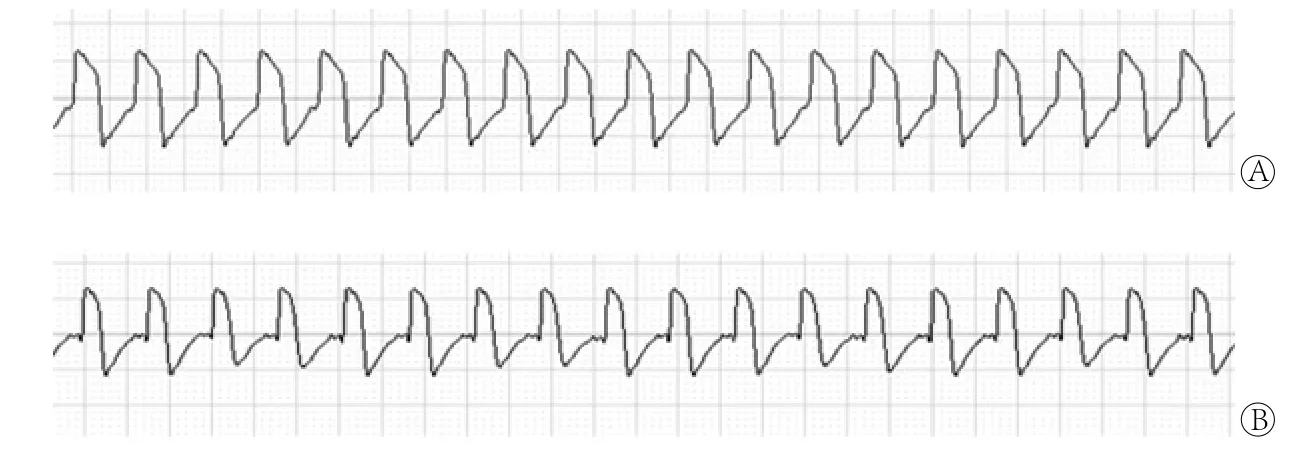
图2 心肌缺血后动作电位时程缩短Fig.2 Monophasic action potential shortened after myocardial is chemia

图3 心律失常的类型Fig.3 Type of arrhythmia
3 讨 论
本研究结果显示,+Gz暴露可引起快速性心律失常,同时还可增加缺血心肌发生快速性心律失常的概率。国外报道指出,符合航空医学鉴定标准且无相关症状的身体健康、未曾受过离心机训练的志愿者,在接受+Gz作用的当时和作用后都会发生心律失常,发生概率随+Gz负荷的增加而升高[4-6]。
从体循环角度分析其原因,一方面,可能由于在高强度的+Gz作用下,心脏会受到离心力的强烈拉伸、挤压等形态变化,诱发心律失常;另一方面,身体内血液会在加速度作用下重新分布,向下半身聚集,造成回心血量大量减少,进而心脏搏出量明显减少,随着心输出量的减少,冠状动脉的灌注会受到影响,从而造成心肌供血不足诱发缺血性心律失常;如果同时合并有冠心病,则更容易引发缺血性心律失常。

表2 心律失常诱发率Tab.2 Evocation rate of arrhythmia
由于方法学等因素的限制,在公开的文献库中很难查到有关+Gz引起快速性心律失常,以及加重缺血性心律失常的细胞电生理机制方面的报道。经典的研究细胞电生理机制、探讨离子通道功能的细胞膜片钳技术为离体实验,需要从组织消化、分离心肌细胞,其中影响因素环节多,各种药物、试剂对细胞结构和功能,包括离子通道的影响较大,因此用来研究缺血和加速度对心肌细胞的作用有一定难度和不确定性。鉴于此,笔者通过复习文献和预实验摸索,决定采用接触电极直接记录心肌细胞群的MAP技术。该技术与单个心肌细胞跨膜动作电位(transmembrane action-potential,TAP)具有相同的时限[7],可实施于完整搏动的心脏上,对组织无损伤,可比较准确地反映缺血心肌细胞的电生理特点,在一定程度上能真实反映心肌细胞的电生理特性。结果证明我们采用该技术取得了预期效果。
本研究结果显示,重复、长时间+Gz暴露和缺血均可使心肌MAPD50(50%动作电位时程)和MAPD90(90%动作电位时程)缩短,但缺血比+Gz暴露时动作电位的变化程度大,而+Gz暴露和缺血双重因素叠加作用比单纯+Gz暴露或缺血时动作电位的变化程度大。既往研究也得到过与本研究一致的结果[8]:实验动物犬冠脉结扎前后缺血区心室动作电位时程缩短。
本研究提示,复极过程中相关离子通道功能异常是加速度引起缺血心肌心律失常的重要机制。以往主要基于缺血心肌的研究提示MAPD90缩短的离子流基础包括3个方面:①动作电位I期瞬时外向钾电流(transient outward potassium current,Ito)增加。一般情况下,兔的外膜心肌Ito电流密度明显大于心内膜,缺血时Ito通道进一步开放,加速了复极过程。②复极Ⅱ期L型钙内流减少。心肌缺血时,细胞Na+/Ca2+交换能力下降、内质网从胞质摄取的Ca2+减少以及细胞膜Ca2+内流增加等因素,导致心肌细胞质内Ca2+浓度升高,进而诱导Ca2+电流的灭活。③ATP敏感性钾通道(ATP sensitive potassium channel,KATP)开放。发生心肌缺血时,细胞内ATP/ADP的比值下降,导致正常条件下关闭的钾通道开放,造成Ⅲ期复极阶段外向钾电流增加,动作电位时程缩短[9-10]。
本实验结果显示,作为损伤因素,+Gz暴露与缺血均使得MAPD90缩短,因此,推测+Gz暴露导致了与上述缺血效应相似的离子通道功能变化。
缺血、+Gz或两者叠加导致的部分区域心肌细胞MAPD50和MAPD90缩短,造成这部分心肌与正常心肌之间电生理特性的不均一性,引起复极离散程度增加,进而可能造成折返性心律失常,形成心律失常的电生理基础。
本课题研究结果显示,与对照组比较,加速度组和缺血+加速度组的MAPA和Vmax变化差异无统计学意义(P>0.05)。MAPA和Vmax反映的是快钠通道开放的程度以及Na+内流的速度。其他学者研究显示心肌缺血时MAPA、Vmax降低[11]。本研究显示缺血动物该两项指标变化不大,可能是我们在实验动物造模时使其缺血的程度不如其他研究严重,未形成心肌梗死。这与本课题的实验设计有关,本课题的出发点是模拟并探讨患有冠心病、冠脉狭窄但并非急性心肌梗死时期的飞行人员在进行飞行作业接受加速度暴露时会发生的问题。而且,动物需要继续饲养和接受加速度暴露,如果造成心肌梗死,动物死亡率会较高,无法完成后续的实验。也就是说,本研究中导致心律失常的主要原因不是心肌细胞快钠内流异常。
总之,本研究结果可为进一步研究飞行人员缺血性心律失常的防治提供理论指导。
[1]Zhang L, Luo HL, Liu XD. Effect of exposure to positive acceleration (+Gz) on the expression of TNF-α and ICAM-1 in swine with coronary artery stenosis[J]. Med J Chin PLA, 2014,39(6): 498-502. [张泠, 罗惠兰, 刘兴德. 正加速度暴露对冠状动脉狭窄小型猪模型TNF-α和ICAM-1表达的影响[J].解放军医学杂志, 2014, 39(6): 498-502.]
[2]Luo HL, Chen YS, Xie F, et al. Effect of repeated and prolonged+Gz exposure on endocrine function of vessel in a rabbit model of atherosclerosis[J]. Med J Chin PLA, 2012, 37(9): 901-904.[罗惠兰, 陈勇胜, 谢放, 等. 重复、长时间正加速度对动脉粥样硬化家兔模型血管内分泌功能的影响[J]. 解放军医学杂志, 2012, 37(9): 901-904.]
[3]Zawadzka-Bartczak EK, Kopka LH. Centrifuge braking effects on cardiac arrhythmias occurring at high +Gz acceleration[J].Aviat Space Environ Med, 2004, 5(75): 458-460.
[4]Hanada R, Hisada T, Tsujimoto T, et al. Arrhythmias observed during high-G training: proposed training safety criterion[J].Aviat Space Environ Med, 2004, 75(8): 688-691.
[5]Scott JP, Jungius J, Connolly D, et al. Subjective and objective measures of relaxed +Gz tolerance following repeated +Gz exposure[J]. Aviat Space Environ Med, 2013, 84(7): 684-691.
[6]Blue RS, Riccitello JM, Tizard J, et al. Commercial spaceflight participant G-force tolerance during centrifuge-simulated suborbital flight[J]. Aviat Space Environ Med, 2012, 83(10):929-934.
[7]Franz MR, Burkhoff D, Spurgeon H, et al. In vitro validation of a new cardiac catheter technique for recording monophasic action potentials[J]. Eur Heart J, 1986, 7(1): 34-41.
[8]Maniotis C, Tsalikakis DG, Tzallas AT, et al. Chronic skeletal muscle ischemia in rats decreases the inducibility of ventricul ar tachyarrhythmias after myocardial infarction[J]. In vivo, 2011,25(5): 781-786.
[9]Wilde AA, Janse MJ. Electrophysiological effects of ATP sensitive potassium channel modulation: implications for arrhythmogenesis[J]. Cardiovasc Res, 1994, 28(1): 16-24.
[10]Tinker A, Aziz Q, Thomas A. The role of ATP-sensitive potassium channels in cellular function and protection in the cardiovascular system[J]. Br J Pharmacol, 2014, 171(1): 12-23.
[11]Zhang J, Li X, Shen ZL, et al. Effects of tetramethylpyrazine on epicardial monophasic action potential in ventricular arrhythmi a in rabbits[J]. Med J West China, 2011, 23(3): 408-410. [张洁,李想, 沈字玲, 等. 川芎嗪对兔室性心律失常心外膜单相动作电位的影响[J]. 西部医学, 2011, 23(3): 408-410.]

