费氏丙酸菌维生素B1营养缺陷型菌株的诱变选育
揣玉多, 马志刚, 王德培
1.天津现代职业技术学院,天津 300350;
2.天津科技大学生物工程学院,天津 300457
近十年来,丙酸的需求量猛增,在饲料加工、谷物防霉、食品防腐和农药、医药等方面市场潜力巨大,因此丙酸行业将有广阔的开发前景[1]。目前,丙酸的工业化生产主要采用化学合成法,但是随着全球环境保护意识和能源节约意识的增强,以及一些欧盟国家担忧化学合成法生产的丙酸可能存在食品安全问题,近年来,围绕微生物发酵法生产丙酸开展了大量的研究工作[2~5]。
丙酸发酵主要通过丙酸杆菌以葡萄糖等作为碳源产丙酸的过程,同时还伴随有乙酸、琥珀酸、CO2等副产物生成。丙酸杆菌一般由底物经EMP途径,再经过Wood-Werkman循环途径、乙酸和CO2合成途径、琥珀酸合成途径、三羧酸循环途径等途径生成丙酸及副产物,其中乙酸为主要的副产物。乙酸生成的过程中,需要维生素B1作为丙酮酸脱氢酶的辅酶[6],因此筛选维生素B1营养缺陷型菌株,可使菌株自身合成维生素B1产生乙酸的代谢途径被阻断,从而降低菌株生产乙酸的能力,使代谢更多转向丙酸的合成,从而得到高产丙酸的菌株。
1 材料与方法
1.1 菌种
丙酸杆菌(Propionibacteria freudenreichii)IFFI.10019,由本实验室保存。
1.2 培养基
基础培养基:蛋白胨10 g/L,葡萄糖20 g/L,酵母膏 10 g/L,磷酸铵 5 g/L,pH 7.2 ~7.4,121℃,灭菌20 min。
发酵培养基:蛋白胨10 g/L,葡萄糖20 g/L,酵母膏 10 g/L,磷酸铵 5 g/L,碳酸钙 5 g/L,pH 7.2 ~7.4,121℃,灭菌20min。
细菌完全培养基:牛肉膏 3 g/L,酵母膏3 g/L,蛋白胨3 g/L,葡萄糖5 g/L,MgSO4·7H2O 2 g/L,琼脂20 g/L,pH 7.2,113℃,灭菌15 min。
细菌基本培养基:(NH4)2SO42 g/L,葡萄糖5 g/L,柠檬酸钠 1 g/L,MgSO4·7H2O 0.2 g/L,K2HPO44 g/L,KH2PO46 g/L,琼脂粉 20 g/L,113℃,灭菌15 min。
无氮基本培养基:葡萄糖 5 g/L,柠檬酸钠 1 g/L,MgSO4·7H2O 0.2 g/L,K2HPO44 g/L,KH2PO46 g/L,113℃,灭菌 15 min。
2倍氮源基本培养基:(NH4)2SO44 g/L,葡萄糖5 g/L,柠檬酸钠1 g/L,MgSO4·7H2O 0.2 g/L,K2HPO44 g/L,KH2PO46 g/L,113℃,灭菌15 min。
限制培养基:向配制好的液体基本培养基(不含琼脂)中加入1~5 g/L的完全培养基,加入20 g/L 琼脂,113℃,灭菌15 min。
1.3 主要仪器
Mettler Toledo Delata 320型pH计,梅特勒·托利多仪器(上海)有限公司;WFJ2000型分光光度计,尤尼柯(上海)仪器有限公司;GC-7890Ⅱ气相色谱仪,郑州长城科工贸有限公司。
1.4 分析方法[7]
1.4.1 生物量测定 比浊法测定发酵液吸光度A600,取1 mL发酵液用0.1 mol/L的 HCl稀释20倍,用WFJ2000型分光光度计在波长600 nm处,光程1 cm比色皿比浊。所测的吸光度代表生物量。
1.4.2 pH测定 测定发酵液pH,反映发酵液总含酸量。
1.4.3 丙酸、乙酸含量的测定 采用气相色谱法测定发酵液中丙酸和乙酸的含量。色谱条件:不锈钢色谱柱,GDX-401固定相,色谱柱温度为200℃,进样器温度为 220℃,检测器温度为220℃,进样量1 μL,外标法测定。样品处理:取1mL发酵液于 EP管中,加入 0.02 mL 50%H2SO4酸化,10 000 r/min离心3 min,取上清液测定发酵液中的丙酸含量Xpr(g/L)、乙酸含量XAc(g/L)。
1.5 诱变育种
1.5.1 丙酸杆菌生长曲线的绘制 丙酸菌活化12 h,按1%接种量接种于250 mL三角瓶中(装液量50 mL),30℃、120 r/min摇床培养,以基础培养基作为空白对照,0.5~1 h为间隔,测定生物量,绘制丙酸杆菌生长曲线。
1.5.2 菌悬液制备 取培养 20 h的发酵液,5 000 r/min离心5 min,弃去上清液,用生理盐水离心洗涤菌体两次,用无菌水制成108/mL的菌悬液。
1.5.3 紫外线诱变与中间培养 吸取5 mL菌悬液,置于培养皿(无上盖),磁力搅拌,30 cm高处紫外灯(15 W)照射15 s、30 s、45 s、60 s、75 s、90 s和120 s,分别吸取1 mL诱变处理菌悬液,置于装有20 mL细菌完全培养基的250 mL三角瓶中,30℃振荡过夜培养。
1.5.4 淘汰野生型(青霉素法) 吸取10 mL中间培养液,4 000 r/min离心10 min,弃去上清液,用生理盐水离心洗涤菌体两次,转入10 mL无氮基本培养基中,30℃振荡培养6~8 h。将菌液转入10 mL 2倍氮源基本培养基中,30℃振荡培养1~2 h,加入青霉素(终浓度为100 U/mL),30℃培养5~6 h。吸取10 mL菌液,用生理盐水离心洗涤菌体一次,将菌体充分悬浮于10 mL生理盐水中。
1.5.5 营养缺陷型的检出 吸取0.1 mL 1.5.4中制得的菌悬液,涂布于限制培养基平板上,30℃培养48 h。分别在细菌完全培养基和细菌基本培养基平皿的背面划32个方格。用牙签从限制培养基平皿上逐个挑取小菌落(野生型形成大菌落,缺陷型为小菌落),对应点接到细菌基本培养基平皿和细菌完全培养基平皿的方格内,30℃培养48 h。将在细菌完全培养基平皿上生长,而在细菌基本培养基平皿上相对应位置上不生长的菌落,接种到完全培养基斜面,30℃培养24 h,作为营养缺陷型鉴定用菌株。
1.5.6 营养缺陷型菌株的鉴定 取鉴定用菌株斜面1环,用生理盐水离心洗涤菌体,将菌体充分悬浮于5 mL生理盐水中,吸取1 mL,于细菌基本培养基内倾注培养,作为待测平板。将待测平板底背面划分为4个区域,在培养基表面4个区域分别贴上蘸有硫胺素(维生素B1)溶液、吡哆醇(维生素B6)溶液、生物素(维生素H)溶液与泛酸(维生素B5)溶液的滤纸片,30℃培养24 h,观察滤纸片周围菌落生长情况(只在蘸有维生素B1溶液滤纸片周围生长的菌株,即为维生素B1缺陷型菌株)。
1.5.7 营养缺陷型菌株产酸性能测定 分别取出发菌株和营养缺陷性菌株,液体发酵培养,24 h后测定发酵液的pH以及乙酸、丙酸含量。
2 结果与分析
2.1 丙酸杆菌生长曲线的绘制
按照1.5.1的方法培养丙酸杆菌,并测定生长曲线,结果见图1。由图1可以看出,0~2 h处于延滞期,2~24 h处于对数生长期,生物量骤增,菌体繁殖迅速,24 h后丙酸菌进入平稳期,因此选用培养至对数生长中后期,即20 h的丙酸菌进行紫外诱变育种。
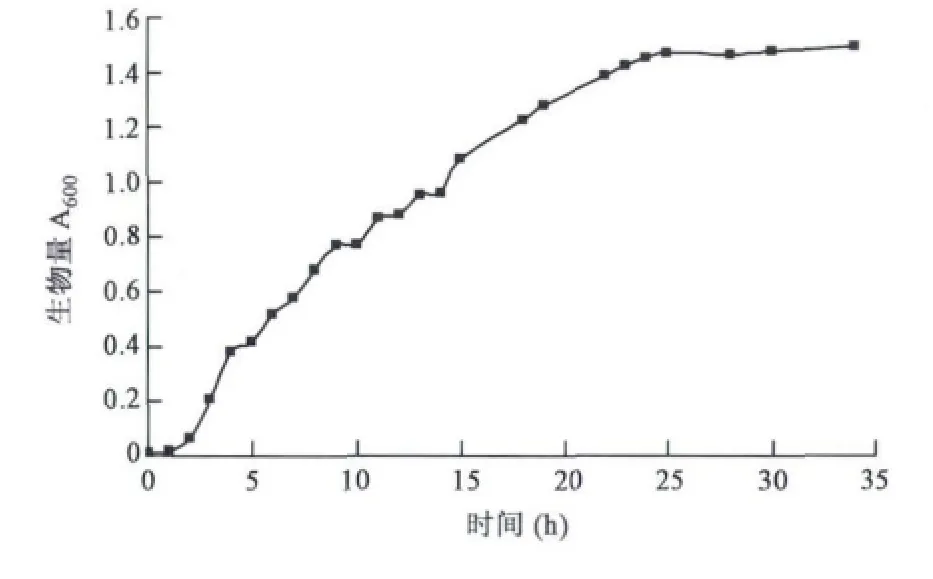
图1 丙酸菌生长曲线 Fig.1 Growth curve of Propionibacteria freudenreichii.
2.2 紫外诱变致死曲线的绘制
取出发菌株摇瓶培养20 h的发酵液,紫外诱变15~120 s,取不同时间诱变处理菌悬液,避光培养,用倾注法测定存活菌体浓度,绘制丙酸菌紫外诱变致死曲线(图2)。
由图2可以看出,紫外照射60 s时,致死率为79%,照射90 s时,致死率已达95%,故在诱变育种时取65 s、70 s、75 s和80 s四个时间进行照射。
2.3 营养缺陷型的检出与鉴定
经紫外线照射65 s、70 s、75 s和80 s后的菌悬液进行中间培养,进一步淘汰野生型,共检出营养缺陷型菌株16株,编号分别为:Pf001、Pf002、Pf007、Pf010、Pf020、Pf030、Pf033、Pf038、Pf051、Pf083、Pf088、Pf119、Pf134、Pf145、Pf146 和 Pf151。上述16个菌株在30℃培养24 h后,观察菌株的生长情况,最终鉴定出2株维生素B1的缺陷型菌株,编号为Pf007和Pf088。
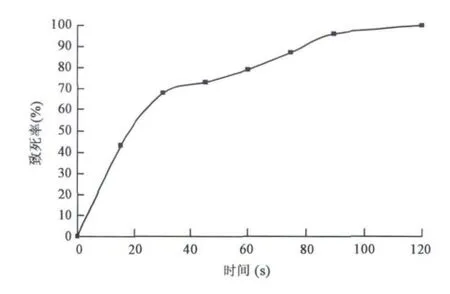
图2 紫外诱变致死曲线 Fig.2 Lethal curve of Propionibacteria freudenreichii by UV.
2.4 维生素B1营养缺陷型菌株产酸性能测定
分别接种发菌株和营养缺陷性菌株到液体发酵培养基中,24 h后测定发酵液的pH以及乙酸、丙酸含量。结果见表1。
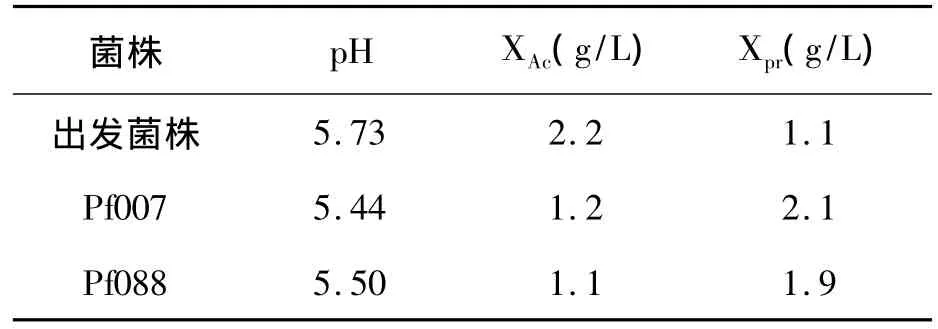
表1 维生素B1营养缺陷型菌株产酸性能 Table 1 Acid production performance of vitamin B1 auxotrophy of Propionibacteria freudenreichii.
紫外诱变筛选出的2株维生素B1营养缺陷型菌株发酵液pH较出发菌株有所下降,说明产酸量较出发菌株有所提高。测定发酵液的pH只能反映发酵液中H+浓度的高低,而丙酸菌发酵不仅产生丙酸,还有乙酸、乳酸等有机酸,因此发酵液的pH变化只能间接说明总产酸量的变化。2株营养缺陷型菌株发酵液中丙酸含量较出发菌均有很大提高,而乙酸产量明显下降。其中,Pf007菌株丙酸产量达2.1 g/L,较出发菌株提高91%,可见通过筛选费氏丙酸菌维生素B1营养缺陷型菌株可以有效改变菌株中的代谢方向,其产丙酸的水平有了明显的提高,达到了预期的效果。
3 讨论
丙酸菌是一类生长缓慢的微生物,丙酸发酵是一条较难进行的代谢途径,属于典型的间歇厌氧发酵,通常需7~14 d,发酵周期长,以葡萄糖为碳源发酵生产丙酸,丙酸产量低,副产物乙酸浓度高。为了提高丙酸的产率,国内外研究者积极采用物理化学诱变、基因操作等多种技术选育理想的丙酸高产菌株[8,9],并对发酵方式进行研究,包括固定化细胞[4]、分批补料[10]和连续发酵[11]等多种方式,都取得了良好的效果。但对于控制副产物乙酸对丙酸菌发酵生产丙酸的影响研究甚少。
本实验以费氏丙酸菌IFFI.10019为出发菌,采用紫外诱变育种技术,选育出2株维生素B1营养缺陷型菌株。维生素B1营养缺陷型丙酸菌降低了菌株内源合成维生素B1的能力,进而抑制了乙酸产生途径,能够较为显著地降低乙酸的生成;同时还能够减少乙酸对菌体生长的抑制[8],提高发酵效率。选育获得的Pf007号菌株发酵24 h产丙酸水平比出发菌株有大幅度提高,提高率达到91%,而产乙酸水平比出发菌也有明显降低。为进一步提高丙酸产量,下一步将对该菌株进行固定化方法的研究,隔绝菌体与丙酸的直接接触,解除抑制作用,缩短菌体生长时间,提高细胞重复使用效率;也可以对该菌株的培养条件进行优化。费氏丙酸菌IFFI.10019具备发酵周期短,培养条件兼性厌氧等利于工业化生产的特点,本研究为其工业化应用奠定了基础,紫外诱变筛选代谢缺陷突变株的方法为丙酸发酵生产中副产物乙酸的抑制提供一种新思路。
[1]Stowers C C,Cox B M,Rodriguez B A.Development of an industrializable fermentation process for propionic acid production[J].J.Ind.Microbiol.Biotechnol.,2014,3:1-16.
[2]Coral J,Karp S G,Porto de Souza Vandenberghe L,et al..Batch fermentation model of propionic acid production by Propionibacterium acidipropionici in different carbon sources[J].Appl.Biochem.Biotechnol.,2008,151(2 -3):333-341.
[3]Wang Z,Yang S T.Propionic acid production in glycerol/glucose co-fermentation by Propionibacterium freudenreichii subsp.shermanii[J].Bioresour.Technol.,2013,137:116-123.
[4]陈飞,冯小海,吴 波,等.丙酸杆菌的两种固定化细胞反应器发酵生产丙酸及其代谢通量分析[J].化工学报,2011,62(4):1034-1041.
[5]Martinez-Campos R,de la Torre M.Production of propionate by fed-batch fermentation of Propionibacterium acidipropionici using mixed feed of lactate and glucose[J].Biotechnol.Lett.,2002,24:427-431.
[6]Moo-young M.Comprehensive Biotechnology[M].New York:Pergamon Press,1985,731-759.
[7]揣玉多,王德培,王艳萍,等.丙酸高产菌株的复合诱变选育[J].食品与发酵工业,2007,33(6):45-49.
[8]Suwannakham S,Huang Y,Yang S T.Construction and characterizationof ack knock-out mutants of Propionibacterium acidipropionici for enhanced propionic acid fermentation[J].Biotechnol.Bioeng.,2006,94(2):383-395.
[9]Hsiu Y Y,Shang T Y.Metabolic Engineering of Priopionibacterium acidipropionici for Enhangced Propionic Acid Fermentation[J].Appl.Environ.Microbiol.,2003,11(8):2004-2010.
[10] Zhuge X,Liu L,Shin H D,et al..Improved propionic acid production from glycerol with metabolically engineered Propionibacterium jensenii by integrating fed-batch culture with a pH-shift control strategy[J].Bioresour.Technol.,2014,152:519-525.
[11] Goswam V,Srivastava A K.Propionic acid production in an in situ cell retention bioreactor[J].Appl.Microbiol.Biotechnol,2001,(56):676-680.

