眼用葛根素柔性脂质体温敏凝胶剂的制备及其性质考察
吴艳丽,张朵朵,危红华,宋艳丽,李莎莎,郝保华
(西北大学生命科学学院,陕西西安 710069)
葛根素 (Puerarin)为异黄酮类化合物,在甲醇中溶解,在水中微溶,在三氯甲烷或乙醚中不溶[1]。临床及实验证明具有β受体阻滞作用,能降低眼内压,对青光眼、糖尿病引起的视网膜病变和局部缺血的视网膜病均有治疗作用[2]。目前,滴眼液占眼用制剂的90%,虽给药方便、计量准确,但给药后遭受角膜前的急速流失,眨眼将有90%的药量损失,生物利用度低[3]。为了克服这些不足,许多研究者试图开发滞留型给药系统,有研究者制备了葛根素脂质体滴眼液[4],虽然可以提高药物在眼部的生物利用度,促进药物穿透角膜的吸收,但包封效果不理想,且滴入眼部在角膜前容易流失;也有研究者制备成原位凝胶[5],虽提高了滞留时间,但在初期相变过程中往往有大量药物释放,容易造成“突释”现象[6]。为了改善这一不足,本实验以葛根素为研究对象将两种剂型有效结合,先将其制备成具有缓释作用的柔性脂质体,再进一步制备成温敏凝胶,不仅达到提高滞留时间、延长药物疗效、提高生物利用度,而且可以改善制剂中出现的药物突释现象,为葛根素眼用创新剂型的开发研究奠定基础。
1 仪器与材料
岛津 LC—20AT高效液相色谱仪;YP—5001电子精密天平 (上海良平仪器仪表有限公司);1TGL—16B离心机 (上海安亭科学仪器有限公司);HH—S恒温水浴锅 (江苏省金坛市恒丰仪器厂);GEM—1400透射电子显微镜 (GEOL);激光动态散射仪 ZEN3600(英国 Malvern公司);RE-52AA型旋转蒸发器 (上海亚荣生化仪器厂);SHZ-D(Ⅲ)型循环水式真空泵 (巩义市予华仪器有限责任公司);SB3200水浴式超声仪 (上海必能信超声有限公司)。
葛根素 (西安小草植物科技有限责任公司,质量分数>98.0%);葛根素对照品 (中国食品药品检定研究院,纯度 99.9%,批号 110752-200912);葛根素滴眼液 (杭州易舒特药业有限公司,国药准字H20093867);大豆卵磷脂、胆固醇(生物试剂,天津市博迪化工有限公司);泊洛沙姆407、泊洛沙姆188(P407、P188,西安悦来生物科技有限公司);甲醇 (Sigma公司,色谱纯);1,2-丙二醇 (天津市致远化学试剂有限公司,纯度>99.0%);微孔滤膜 (0.22 μm,0.45 μm 上海新亚药业有限公司)。
家兔 (普通),雌雄不限 (由西安交通大学实验动物中心提供,合格证号为医动字第08-018号)。
2 方法与结果
2.1 柔性脂质体的制备 根据文献[7]方法及预实验,采用薄膜分散法制备,称取大豆卵磷脂0.6 g,胆固醇 0.3 g,溶于 20 mL乙醇中,与10 mL甲醇溶解的0.06 g葛根素溶液一起置于茄型瓶中,40℃恒温水浴中减压 (-0.05 MPa)旋转蒸发除去有机溶剂,至瓶壁上形成均匀透明的薄膜,另取15 mL丙二醇溶于45 mL蒸馏水中,加入上述附有薄膜的茄型瓶内,旋转60 min使脂类膜材脱落进行水合,之后将其转入具塞三角瓶中,冰水浴超声混合10 min,过0.45 μm微孔滤膜,制备成含药1 mg/mL的葛根素柔性脂质体。在上述甲醇溶液中不加葛根素同法制得空白柔性脂质体。4℃冷藏,备用。
2.2 粒径和Zeta电位测定 取上述葛根素柔性脂质体适量,以水为分散介质稀释30倍,用激光动态散射仪测得其平均粒径为170.6 nm,多分散指数为0.160,其粒径分布图如图1所示;Zeta电位为-53.7 mV,其Zeta电位图如图2所示。
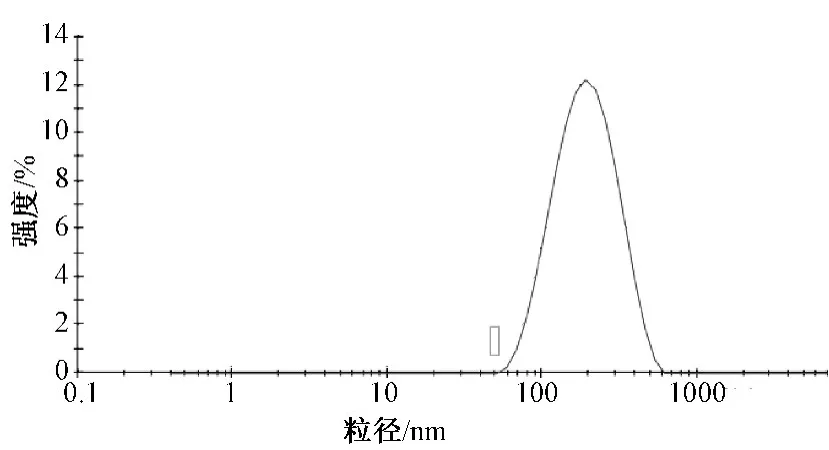
图1 葛根素柔性脂质体的粒径分布图Fig.1 Particle size distribution of puerarin flexible liposomes

图2 葛根素柔性脂质体Zeta电位图Fig.2 Particle surface potential of puerarin flexible liposomes
2.3 葛根素柔性脂质体的形态观察 取葛根素柔性脂质体适量,以水为分散介质进行稀释,滴于铜网上用2%磷钨酸负染,置于透射电镜下观察粒子形态,葛根素柔性脂质体呈类圆形微球体,见图3。

图3 葛根素柔性脂质体的透射电镜图Fig.3 Puerarin flexible liposomes under TEM
2.4 包封率的测定 准确吸取0.2 mL葛根素柔性脂质体于10 mL量瓶中,加甲醇破膜定容至刻度,为A液。另取0.2 mL载药柔性脂质体经葡聚糖凝胶G-50柱分离葛根素柔性脂质体与游离的葛根素,将分离出的游离药合并为B液并定容至10 mL,将A液和B液分别过0.22 μm滤膜,采用“2.6.1”项下方法测定葛根素量,A和B分别对应总药量和游离药量。按照《中国药典》2010年版脂质体包封计算公式计算包封率 (E):
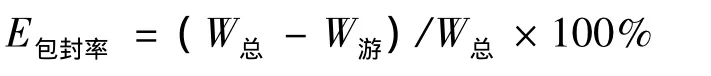
其中,W总为总药量,W游为游离药物量。计算结果显示,制备的葛根素柔性脂质体的平均包封率为 (63.52±2.34)%。
2.5 柔性脂质体温敏凝胶的制备 采用冷溶法[8]制备柔性脂质体温敏凝胶。称取处方量的P407和P188,缓慢加入一定量的柔性脂质体溶液中,搅拌后置于4℃冰箱中冷藏48 h,使其完全溶解。分别得含药量为0.9 mg/mL(m/V)的葛根素柔性脂质体温敏凝胶和空白柔性脂质体温敏凝胶。
2.6 葛根素测定方法的建立
2.6.1 色谱条件 wondonsail C18-WR色谱柱(150 mm ×4.6 mm,5 μm),流动相为甲醇-水(30∶70),体积流量 0.5 mL/min,检测波长为250 nm,柱温30℃,进样量20 μL。
2.6.2 对照品溶液的配制及线性关系考察 精密称取60℃下减压干燥至恒定质量的葛根素对照品20 mg,置20 mL量瓶中,甲醇定容至刻度,制得1 mg/mL的对照品溶液。然后精密量取一定量葛根素对照品溶液,用甲醇配制成质量浓度分别1、5、10、20、50、100、200、300 μg/mL的葛根素对照品溶液,高效液相色谱仪测定。以峰面积积分值为纵坐标,葛根素质量浓度为横坐标作图,得回归方程为A=1.9×105C+1.2×106,r2=0.9998,表明葛根素在1~300 μg/mL范围内线性关系良好。
2.6.3 供试品溶液的制备 精密吸取葛根素柔性脂质体温敏凝胶1.0 mL,置100 mL量瓶中,加甲醇超声溶解并定容至刻度,即得供试品溶液。
2.6.4 空白对照溶液的制备 精密吸取空白葛根素柔性脂质体温敏凝胶1.0 mL,置100 mL量瓶中,加甲醇超声溶解并定容至刻度,即得空白对照溶液。
2.6.5 专属性试验 精密吸取对照品溶液、供试品溶液和空白对照溶液各20 μL,注入高效液相色谱仪进行测定。结果显示,在该色谱条件下葛根素峰形稳定,柔性脂质体和温敏凝胶的辅料对葛根素的测定无干扰,其色谱图见图4。
2.6.6 精密度试验 分别配制低、中、高 (5、100、300 μg/mL)3个质量浓度的对照品溶液,按“2.6.1”项下的色谱条件测定,分别于一天内重复进样3次,得到日内RSD值分别为1.05%、0.86%、1.04%。连续3 d测定,得到日间RSD值分别为1.58%、0.96%、1.24%。
2.6.7 回收率试验 制备空白柔性脂质体温敏凝胶,分别加入不同量的葛根素对照品溶液于量瓶中,用甲醇破乳并制成质量浓度分别为5、100、300 μg/mL的样品溶液各3份。按“2.6.1”项下色谱条件测定,结果各质量浓度 (5、100、300 μg/mL)的平均回收率分别为99.12%、99.18%、99.50%。表明使用该法测定葛根素柔性脂质体温敏凝胶中药物的量准确可靠。

图4 葛根素对照品 (A)、葛根素柔性脂质体温敏凝胶(B)、空白柔性脂质体温敏凝胶 (C)的HPLC图Fig.4 HPLC chromatograms of puerarin reference substance(A),puerarin flexible temperature sensitive liposomegel(B),and blank flexible temperature sensitive liposomegel(C)
2.7 胶凝温度的测定 采用试管倒置法[9]进行胶凝温度的测定。测定时所用试管及加入凝胶体积相同,均采用20 mL试管中加入凝胶溶液2 mL,置于恒温水浴锅中,试管内液面低于水面,测试温度为25.0~34.5℃,升温速率为0.2℃/min,倒置后溶液不再流动时的最低温度为胶凝温度。
2.8 模拟泪液的配制 精密称取氯化钠6.8 g,碳酸氢钠2.0 g,氯化钾1.4 g和二水氯化钙0.08 g至烧杯中,去离子水溶解后转移至1000 mL量瓶中,加去离子水稀释至刻度,即得模拟泪液 (simulated tear fluid,STF)[10]。
2.9 葛根素柔性脂质体温敏凝胶的处方优化
2.9.1 星点效应面法优选处方基质 P407与P188的浓度和比例是影响温度敏感型凝胶性质最主要的因素,许多研究证明,P407浓度增加,其胶凝温度降低,随着P188加入量的增加,胶凝温度呈现先上升后下降的趋势[11-12]。据报道,结膜囊内泪液的体积约为7 μL,而每滴滴眼剂的平均体积为40 μL,这就意味着当滴眼剂滴入结膜囊内后,有可能全部被泪液稀释。因此,本实验选择P407的浓度范围为20%~25%,P188的浓度范围为1%~5%,将凝胶与模拟泪液以40∶7的比例进行混合稀释,采用Design-Expert 8.0.6软件进行实验安排,以泪液稀释前和泪液稀释后胶凝温度为考察指标进行2因素5水平星点设计。按照星点设计原理安排13次试验,各试验结果见表1。
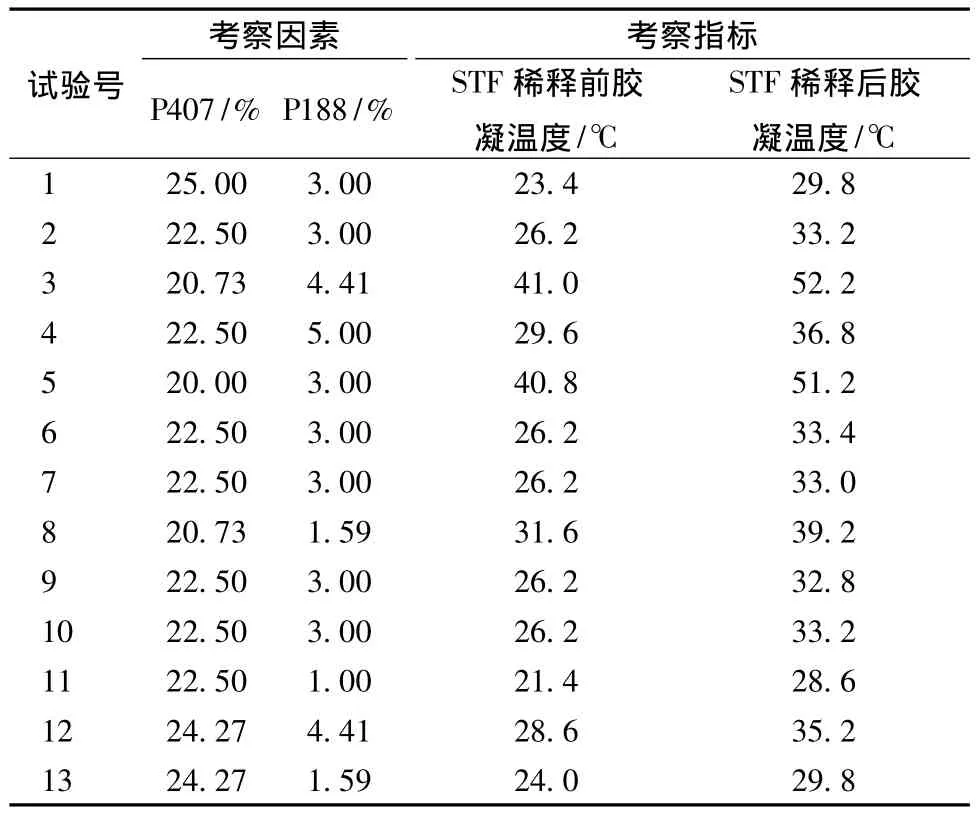
表1 不同浓度组合P407、P188的胶凝温度Tab.1 Gelation temperature of different P407 and P188 concentration combinations
为了更直观地看出 P407和P188浓度对胶凝温度影响的变化规律,根据试验结果,采用Design-Expert 8.0.6软件绘制P407浓度、P188浓度和胶凝温度之间的三维立体图,见图5、6。以泪液稀释前胶凝温度高于25℃,泪液稀释后胶凝温度接近34.5℃为依据,进行处方的筛选优化,在图中找出最佳胶凝温度时的P407和P188的浓度分别为22.5%和3.0%,胶凝温度为 (33.20±0.20)℃(n=3)。
2.9.2 药物及辅料对胶凝温度的影响 将处方量组成的凝胶基质分别分散在水、空白柔性脂质体和葛根素柔性脂质体中,分别测定泪液稀释前后的胶凝温度。结果见表2。可见,葛根素和空白柔性脂质体辅料对处方量泊洛沙姆溶液的胶凝温度影响均较小。
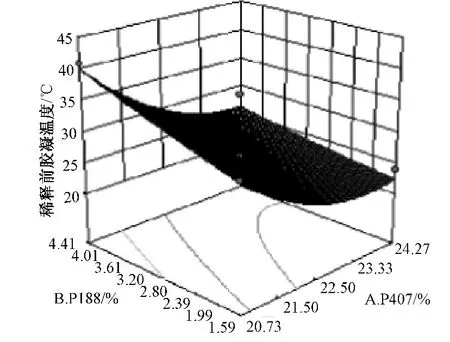
图5 STF稀释前胶凝温度Fig.5 Gelation temperature before STF dilution

图6 STF稀释后胶凝温度Fig.6 Gelation temperature after STF dilution
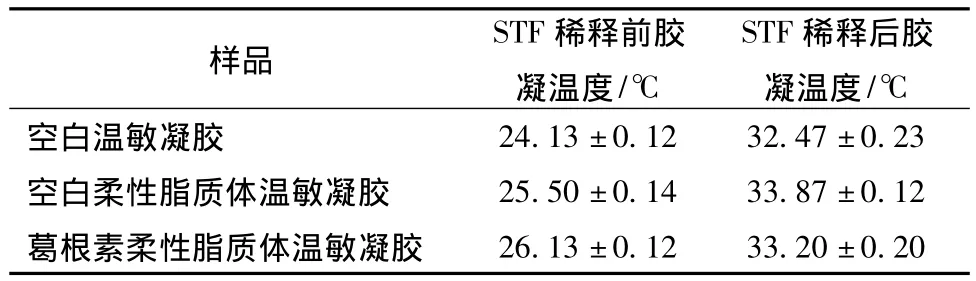
表2 葛根素和柔性脂质体辅料对胶凝温度的影响Tab.2 Effects of puerarin and flexible liposomes excipients on gelling temperature
2.10 凝胶溶蚀与体外药物释放考察 采用无膜溶出法[13]考察凝胶溶蚀特征。以模拟泪液为释放介质,取葛根素柔性脂质体温敏凝胶2.3 g置于10 mL具塞刻度试管中,精密称定质量,在34.5℃恒温水浴振荡器中放置15 min,待样品形成凝胶后加入2.4 mL释放介质,恒温振荡。每30 min取出全部释放介质后擦干试管外表面,迅速称定质量,再将试管放入恒温水浴振荡器中,平衡15 min,补充同温同体积新鲜释放介质,重复操作,相邻时间点的质量差为凝胶溶蚀量。考察凝胶溶蚀行为的同时测定药物的释放量,将溶蚀试验每次取出的全部溶液置于5 mL量瓶中稀释至刻度,摇匀后过滤膜,测定葛根素含量。以凝胶累积溶蚀量对时间作图,得到凝胶经时溶蚀曲线,以药物累积释放量对时间作图,得到药物释放曲线。结果见图7。可知,在刚开始的6 h内,其溶蚀速率和释放速率均较快,平均累积量分别为65.74%、48.64%,此后,其溶蚀速率和释放速率相对缓慢,13h累积溶蚀量为94.00%,13h累积释放量为75.27%。
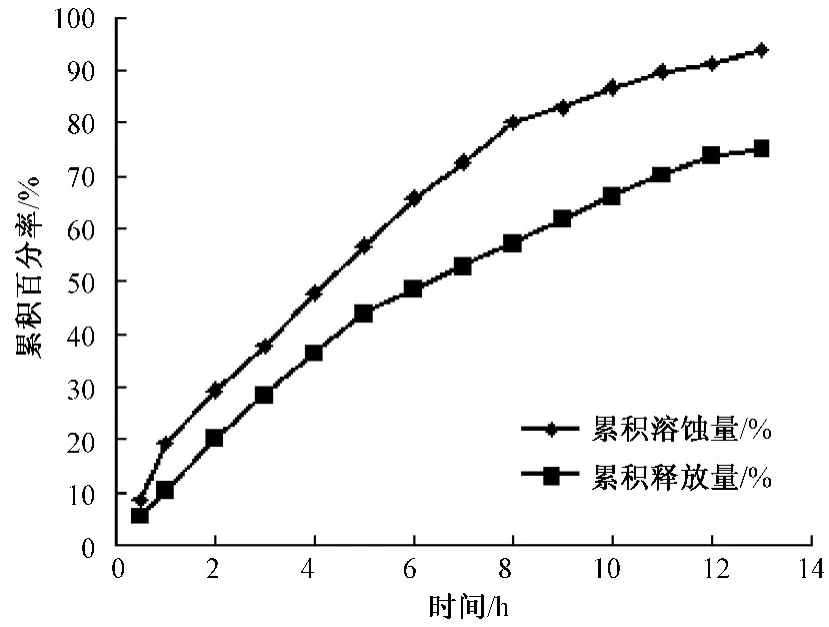
图7 葛根素柔性脂质体温敏凝胶溶蚀和释放曲线Fig.7 Dissolution and release curves of temperature sensitive puerarin flexible liposome gel
2.11 眼部滞留时间试验 取葛根素滴眼液、葛根素柔性脂质体滴眼液、葛根素温敏凝胶滴眼液和葛根素柔性脂质体温敏凝胶滴眼液,分别加入2%的荧光素纳,混合均匀。选择眼部无疾病的健康家兔12只,随机分为4组,每组3只。第1组家兔眼中滴入1滴葛根素滴眼液,第2组家兔眼中滴入1滴葛根素柔性脂质体滴眼液,第3组家兔眼中滴入1滴葛根素温敏凝胶滴眼液,第4组家兔眼中滴入1滴葛根素柔性脂质体温敏凝胶滴眼液。滴入后使家兔眼睛被动闭合10 s左右,每隔10 min用紫外灯在365 nm波长处观察眼角膜表面的连续荧光层强弱,角膜表面的连续荧光层消失的时间为眼部滞留时间。观察结果发现,葛根素滴眼液给药后荧光主要集中在结膜区,但大部分从眼角溢出,平均30 min后眼部已无黄色荧光;葛根素柔性脂质体滴眼液在眼角膜停留时间较长,70 min后荧光层消失;葛根素温敏凝胶滴眼液在眼部立即形成块状凝胶,130 min时荧光层消失,而葛根素柔性脂质体温敏凝胶滴眼液在滴入结膜囊内后也立即形成块状凝胶,随后由于泪液的稀释和眼脸的剪切作用在眼表明逐渐溶蚀并形成一层凝胶膜,150 min时结膜囊内还残留少量荧光,160 min时荧光消失。与滴眼液和柔性脂质体滴眼液相比,柔性脂质体温敏凝胶的眼部滞留时间延长,是滴眼液的5.3倍,平均滞留时间也较葛根素温敏凝胶长。
2.12 初步稳定性试验 将最优处方下的葛根素柔性脂质体温敏凝胶分别置于4、25、30、40℃环境下,于1个月取样观察,以葛根素柔性脂质体温敏凝胶的外观性状和胶凝温度为指标,观察其稳定性。结果见表3,说明其性质初步稳定。

表3 不同温度下葛根素柔性脂质体温敏凝胶的外观性状和胶凝温度 (n=3)Tab.3 Appearance characters and gelling temperature under different temperatures(n=3)
2.13 眼部刺激性试验 采用同体自身对照法[14]。选择健康无疾病的家兔3只,以生理盐水为空白对照,在每只家兔左眼中滴入生理盐水,右眼中滴入葛根素柔性脂质体温敏凝胶滴眼液,给药后眼睛被动闭合10 s左右,依照《中华人民共和国卫生部新药研究指导原则汇编》中的眼部刺激性试验标准进行评分,以角膜是否有浑浊现象及浑浊程度、虹膜是否正常及异常程度、结膜中睑结膜、球结膜部位血管是否正常及充血明显程度为评分标准,将每只家兔角膜、虹膜和结膜反应的分值相加的总和除以动物数,就是受试动物对眼部刺激的最后分值。单次给药后,采用手持裂隙灯在不同时间点(1、2、4、24、48、72 h)对眼部进行检查,每只兔眼均无异常现象,综合评分均为0分,眼部刺激性反应积分与对照组无差异,表明葛根素柔性脂质体温敏凝胶滴眼液单次给药对兔眼无刺激性。多次给药试验中,每只每次给药1滴,约40 μL,每天3次,共7 d,观察并记录每只家兔的眼睛局部反应,发现有一只在给药第6天右眼出现少量异常分泌物,记为1分,停药2 d后分泌物消失。观察点眼部刺激性反应均未超过3分,眼部刺激性反应与对照组比较无明显差异,表明葛根素柔性脂质体温敏凝胶滴眼液连续给药后对兔眼无刺激性。
3 讨论
单一的凝胶制剂仅能在一定程度上增加药物在给药部位的滞留时间,但由于药物在溶胶中扩散速率远大于在凝胶中的扩散速率,因而在初期相变过程中往往有大量药物释放,易造成“突释”现象[6];单一的柔性脂质体在普通脂质体的基础上加入了柔顺剂,具有高强度的变形性和可塑性,能够促进药物穿透角膜,但存在一定的缺点,如给药后在角膜前易流失,不能有效提高药物在眼部的滞留时间。因此,制备一种柔性脂质体-温敏凝胶的复合制剂,既通过柔性脂质体作用增加药物在制剂中的缓释性,而且其高强度的变形性在通过角膜时可以防止脂质体囊泡破裂,改善温敏凝胶的突释现象;同时制剂也具有温敏凝胶的温度敏感性,在眼部给药后黏度增大,延长了药物在眼部的滞留时间,弥补了单一制剂的不足。试验结果也表明,葛根素柔性脂质体温敏凝胶平均以每小时9%的速度均匀释放,胶凝初期并没有出现突释现象。并考察了葛根素及柔性脂质体辅料对胶凝温度的影响,发现它们对处方量凝胶基质的影响均较小,这可能归因于葛根素或组成葛根素柔性脂质体辅料的分子结构以及用料较少的原因。
有研究表明,柔性脂质体对药物的包封率高于普通脂质体,其稳定性也远远大于普通脂质体与非离子型囊泡[15]。因此,本实验决定将葛根素制备成柔性脂质体,实验过程中选用了丙二醇、胆酸钠和脱氧胆酸钠分别作为柔软剂制备不同的葛根素柔性脂质体并测定其包封率,其中以丙二醇为柔软剂的柔性脂质体包封率最高,稳定性好,因此,本实验选择以丙二醇为柔软剂制备葛根素柔性脂质体。对于眼部给药,由于结囊内充斥着不断更新的泪液,因此,本实验采用无膜溶出模型,模拟体内环境研究眼用葛根素柔性脂质体温敏凝胶的溶蚀与释药行为。
本实验曾试图将含药量较高的葛根素柔性脂质体稀释后分散在凝胶介质中,但发现含药量高的葛根素柔性脂质体易出现分层现象,因此试验过程中直接将P407和P188分散在葛根素柔性脂质体中。在眼部刺激性反应初次试验中,将滴眼液从冰箱中取出后直接用于实验,结果3只家兔的结膜处均出现轻微的充血现象,考虑到可能是低温刺激的结果后,将葛根素柔性脂质体温敏凝胶滴眼液在室温下放置20 min后进行试验。本实验制备的葛根素柔性脂质体温敏凝胶具有均匀的缓释作用,能明显延长药物在眼部的滞留时间,在眼部无刺激性且性质稳定,具有良好的临床应用前景,但其在眼内的药效学和药代动力学有待进一步研究。
[1]国家药典委员会.中华人民共和国药典:2010年版二部[S].北京:中国医药科技出版社,2010:925.
[2]Greaves J L,Wilson C G.Treatment of diseases of the eye with mucoadhesive delivery systems[J]. Adv Drug Deliv Rev,1993,11(3):349-383.
[3]凌沛学,管华诗,荣小花,等.眼科药物传递系统的研究进展[J].中国药学杂志,2006,41(1):7-9.
[4]邓 赟,徐金库,李新松.葛根素脂质体滴眼液的制备及其药动学研究[J].中国中药杂志,2010,35(3):301-304.
[5]王志钢,王艳姣,李 慧,等.丹葛明目即型凝胶的制备研究[J].中国中药杂志,2012,37(1):46-51.
[6]王于杰,蒋国强,孙佳丽,等.温敏凝胶原位植入给药系统的研究进展[J].精细化工,2013,30(1):1-6.
[7]韩文霞,李伟泽,汪兴军,等.盐酸青藤碱纳米柔性脂质体的制备及其性质研究[J].中草药,2011,42(4):671-675.
[8]Tirnaksiz F,Tirnaksiz F,Robinson J R.Rheological,mucoadhesive and release properties of Pluronic F-127 gel and Pluronic F-127/polycarbophil mixed gel systems[J].Pharmazie,2005,60(7):518-523.
[9]高 斐,王东凯,罗 立,等.左氧氟沙星热敏型眼用凝胶的研制及体外释放研究[J].中国药房,2005,16(14):1057-1059.
[10]Nanjawade B K,Manvi F V,Manjappa A S.In situ-forming hydrogels for sustained ophthalmic drug delivery[J].J Controlled Release,2007,122(2):119-134.
[11]孔志峰,郝吉福,郭丰广,等.氯霉素温敏型眼用原位凝胶的研制[J].中国生化药物杂志,2010,31(3):185-189.
[12]朱铁梁,胡 霞,张 莉,等.黄芩苷温敏凝胶的处方筛选及体外释放研究[J].中草药,2012,43(11):2164-2167.
[13]高 裴,王东凯,罗 立,等.左氧氟沙星热敏型眼用凝胶的研制及体外释放研究[J].中国药房,2005,16(14):1057-1059.
[14]郝吉福,李学桐,张翠玲,等.氯霉素眼用温敏原位凝胶的制备及其兔眼刺激性研究[J].中国药房,2011,22(21):1979-1981.
[15]López-Pinto J M ,González-Rodríguez M L ,Rabasco A M.Effect of cholesterol and ethanol on dermal delivery from DPPC liposomes[J].Int J Pharm,2005,298(1):1-12.

