大承气汤传统煎煮工艺的优化
谢瑞芳,石志娜,2,李毅民,周 昕*
(1.上海中医药大学附属龙华医院药剂科,上海 200032;2.河北省邢台市第三医院药剂科,河北 刑台 054000)
大承气汤出自张仲景的《伤寒论》,是治疗阳明腑实证的主要方剂,处方由大黄、厚朴、枳实、芒硝组成。主治潮热澹语,手足戳然汗出,腹满硬痛,大便不通,脉沉迟有力;或发则不识人,循衣摸床,微喘直视;或目中不了了,睛不和;或阳明病,发热汗多;或发汗不解,腹满痛等[1]。其主要功用是通过通便达到泻热的目的,尤其适用于因发热耗伤津液所造成的大便燥结性肠梗阻或不完全性肠梗阻[2]。
作为传统经方,相关研究报道十分多[3-4],其临床疗效优良、副作用少且价格相对低廉,得到了医生和患者的一致认可。由于传统汤剂中有效成分的量受到煎煮过程中药材浸泡时间、煎煮时间、加水量、煎煮次数等因素的影响,一般病人服药均按经验煎煮,各因素没有固定的参数控制,使有效成分含有量参差不齐,难以达到最佳疗效[5-6]。
本实验应用HPLC法测定大承气汤中各有效成分的量并以各有效成分量的综合评分值为考察指标,采用Box-Behnken设计响应面分析统计方法,筛选出显著影响因素并确定最佳水平组合,优化了大承气汤的人工煎煮工艺,阐明了煎煮过程中影响因素对大承气汤中有效成分的影响。
1 实验仪器、试剂
1.1 仪器 Agilent 1100型高效液相色谱仪 (德国Agilent公司);XW-80A旋涡混合器 (上海医科大学仪器厂);SB2200超声仪 (上海必能超声仪器公司);Sartorius BS110S精密电子天平。
1.2 试剂 橙皮苷 (批号110721-200613)、大黄素 (批号110756-200110)、大黄酚 (批号110796-201017)、大黄素甲醚 (批号110758-200912)等对照品购自中国食品药品检定研究院 (纯度 >99%)。HPLC级甲醇购自Merk公司 (德国),水为纯化水,由Milli-Q水处理系统处理 (Millipore,Bedford,MA,USA),其他试剂为分析纯,购自上海吴泾化工厂。生大黄 (批号LY2010040340,产地甘肃)、厚朴 (批号110124,产地四川)、枳实(批号100901,产地四川)均购自上海万仕诚国药制品有限公司。
2 实验方法与结果
2.1 色谱条件及样品溶液的制备
2.1.1 色谱条件 C18518905-902色谱柱 (4.6 mm×250 mm,5 μm);以甲醇为流动相A,0.1%磷酸水为流动相B,进行梯度洗脱,洗脱条件如表1所示;体积流量为1 mL/min;柱温25℃;检测波长294 nm;进样量10 μL;检测时间75 min。

表1 大承气汤色谱条件Tab.1 Chromatographic conditions for Dachengqi Decoction
2.1.2 对照品溶液的制备 精密称取橙皮苷2.80 mg、芦荟大黄素0.50 mg、大黄酸0.70 mg、大黄素0.40 mg、厚朴酚2.00 mg及和厚朴酚1.30 mg于10 mL量瓶中,用甲醇定容,然后稀释至不同质量浓度,0.22 μm微孔滤膜滤过,作为对照品溶液。
2.1.3 供试品溶液的制备 量取大承气汤合煎液2 mL于10 mL量瓶中,加甲醇约至刻度线,超声提取20 min,冷却至室温,补充溶剂至刻度,摇匀,静置过夜后,取上清液,10000 r/min,离心10 min,经0.22 μm微孔滤膜滤过,作为供试品溶液。
2.2 方法学研究
2.2.1 标准曲线的建立 精密吸取橙皮苷、芦荟大黄素、大黄酸、大黄素、厚朴酚及和厚朴酚不同质量浓度的对照品溶液注入色谱仪,进样量为5 μL,按“2.1.1”项下色谱条件测定峰面积,制定标准曲线。结果表明 (表2),相关系数均大于0.9995,线性关系良好。

表2 标准曲线的制定Tab.2 Establishment of calibration curves
2.2.2 精密度及加样回收率试验 取同一份大承气汤,按高、中、低剂量分别加入橙皮苷、芦荟大黄素、和厚朴酚、厚朴酚、大黄素和番泻叶苷A对照品溶液,按“2.1.3”项下的处理得供试品溶液,连续3 d各测定3次,每次进样量为10 μL,记录峰面积,计算回收率、日间及日内精密度。在信噪比 (S/N)为3和10时,分别测定各对照品的最低检测限 (LOD)及最低定量限 (LOQ)。
结果表明,各指标成分的日内及日间RSD均小于3.50%,表明该方法精密度良好。最低检测限和定量限均能满足样品测定的要求。橙皮苷回收率为89.98% ~100.52%,芦荟大黄素回收率为99.52%~109.96%,和厚朴酚回收率为93.36%~107.47%,厚朴酚回收率为105.44% ~107.47%,大黄素回收率为93.73%~117.90%,番泻叶苷A回收率为95.1%~113.9%,表明回收率良好,见表3。
2.2.3 稳定性试验 取同一份大承气汤煎液的供试品溶液,在0、2、4、24、48 h分别进样10 μL,记录峰面积,计算RSD,考察色谱条件的稳定性。
结果表明,供试品主要指标成分保留时间的RSD在0.01%~0.18%之间,相对峰面积的RSD在1.41%~9.26%之间,表明该试验方法在48 h内基本稳定。
2.2.4 重复性试验 选取大承气汤合煎液 (批号Box1)2 mL,按“2.2.1”项下药液处理方法平行处理3份样品,按照“2.1.1”项下色谱条件,进样10 μL,考察方法重复性。
结果表明,主要指标成分相对保留时间的RSD在0.05%~0.68%之间,相对峰面积的RSD在1.79%~15.80%之间,表明该方法重复性尚可,见表4。
表3 指标成分精密度,加样回收率,最低检测限和定量限 ()Tab.3 Precison,recovery,LOD and LQD of chemical structures()

表3 指标成分精密度,加样回收率,最低检测限和定量限 ()Tab.3 Precison,recovery,LOD and LQD of chemical structures()
化学成分 对照品平均加入量/μg回收率/%.98橙皮苷 7.924 15.334±0.072 0.47 15.672±0.298 1.90 95.21 5 99.509 17.356±0.126 0.72 17.679±0.318 1.80 100.521.100 3.713±0.078 2.10 3.784±0.076 2.01 109.83芦荟大黄素 1.250 3.769±0.040 1.05 3.806±0.073 1.92 109.96 16 301.600 4.287±0.147 3.42 4.320±0.112 2.59 99.525.500 3.553±0.016 0.44 3.630±0.070 1.93 105.44和厚朴酚 7.160 3.948±0.015 0.39 3.998±0.050 1.25 107.47 4 1112.200 4.667±0.060 1.30 4.751±0.080 1.68 93.365.500 3.553±0.016 0.44 3.630±0.070 1.93 105.44厚朴酚 5.500 3.553±0.016 0.44 3.630±0.070 1.93 105.44 7 207.160 3.948±0.015 0.39 3.998±0.050 1.25 107.472.554 5.547±0.066 1.20 5.611±0.060 0.01 93.73大黄素 3.192 6.540±0.101 1.54 6.528±0.081 1.24 104.66 2 53.830 7.721±0.120 1.55 7.699±0.083 1.07 117.903.530 7.832±0.061 0.78 7.725±0.097 1.26 95.1番泻叶苷 A 4.412 9.035±0.093 1.03 9.041±0.069 0.77 104.9 30 555.294 10.354±0.159 1.53 10.504±0.166 1.58 113.9/ng 6.339 13.517±0.020 0.15 13.815±0.300 2.17 89日内精密度(n=3)测量值 /μg RSD/%日间精密度(n=3)测量值/μg RSD/%(n=9) LOD/ng LOQ
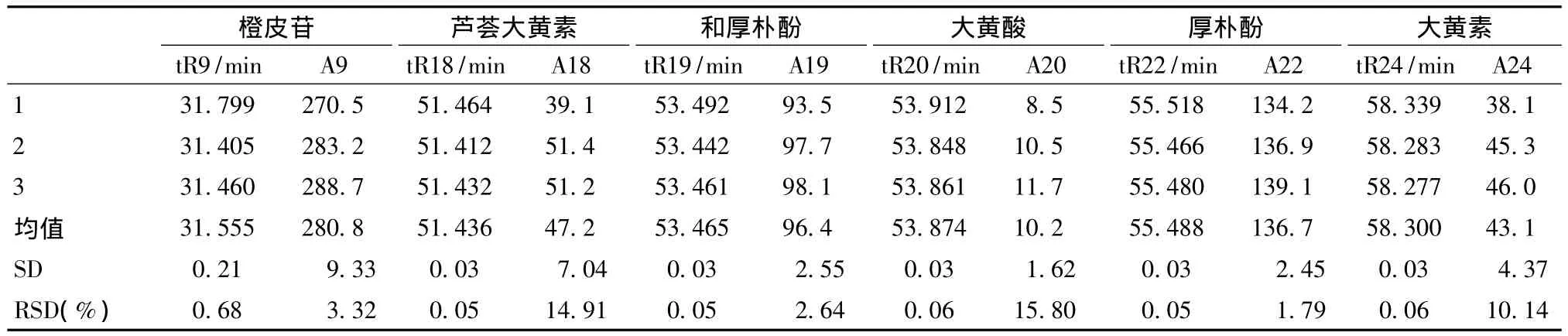
表4 大承气汤煎液重复性Tab.4 Reproducibility of Dachengqi Decoction
2.3 综合评分及各成分权重系数的确定 AHP法根据大承气汤中有效成分HPLC检测信息及色泽、相对密度、干浸膏得率信息,将其25个色谱峰、最大吸光度值、相对密度和干浸膏得率作为权重的指标,分为五层次:其中 A18(芦荟大黄素)、A20(大黄酸)、A24(大黄素)、A25(番泻叶苷A)为君药大黄定量测定成分,且起到主要泻下作用,为第一层次;A9(橙皮苷)、A19(和厚朴酚)、A22(厚朴酚)为厚朴和枳实药材主要成分,辅助泻下,为第二层次;A8、A10为最大的未知峰作为第三层次;A1、A5、A6、A7、A13、A14、A15为较大的未知峰和最大吸光度值、相对密度、干浸膏得率作为第四层次;其他未知峰A2、A3、A4、A11、A12、A16、A17、A21、A23、A26 峰面积均较小作为第五层次。因此这几项指标依次评分为7、5、3、2、1。参照文献 [7]构成成对比较的判断优先矩阵,并获得各项指标的权重系数。CRITIC法根据实测峰面积值间的相似度计算各色谱峰的权重系数。
参照文献 [8]采用综合评分法,按照公式⑤将AHP法计算的权重系数与CRITIC法计算的权重系数加权得到综合权重。

ωAHP表示AHP法计算的权重系数,ωCRITIC表示CRITIC法计算的权重系数,i表示第i个因素,j表示第j个样本。
经研究,大黄中泻下的主要有效成分为番泻叶苷以及大黄素甲醚葡萄糖苷、大黄酚葡萄糖苷、大黄素葡萄糖苷等结合型蒽醌苷类,它们可通过消化道达到大肠,再经酶或细菌分解为苷元,刺激大肠,增强肠蠕动,减少水分吸收而具有泻下作用;而大黄酸、大黄素、芦荟大黄素、大黄酸和大黄素甲醚等游离型蒽醌由于经消化道氧化,作用减弱,泻下作用很小[9]。加热时间越长,温度越高,结合型蒽醌就越易水解转化为游离型蒽醌,泻下作用就越弱;而大黄中鞣质由于较稳定,加热和高温反而增加了一些吸收功能,增加了止泻和止血功能。
指纹图谱中测定到大黄的指标成分多为大黄酸、大黄素、芦荟大黄素、大黄素甲醚等游离型蒽醌具有抗菌作用,但不具有泻下作用,且含有量越高,说明结合型蒽醌成分破坏多,因此在进行综合评分时,定为负值。
2.4 Box-Behnken响应面试验 此方法既能考察各个影响因素对大承气汤有效成分综合评分值的影响,也能进行各个因素的最优化,建立数学模型并作出相应的三维应变量曲面图,对因素与指标的关系进行直观的量化分析[10-11]。
2.4.1 Box-Behnken设计因子的水平范围的规定预初实验的结果初步确定煎煮次数为3次,在本次实验设计中选用浸泡时间 (X1)、煎煮时间 (X2)、加水量 (X3)为因素 (设计因素水平见表5),以综合评分为效应进行Box-Behnken设计-效应面优化实验,并采用Design Expert 7.0软件对实验数据进行拟合分析。

表5 Box-Behnken设计因素水平及编码Tab.5 Parameters and levels for Box-Bhehnken
按照Box-Behnken试验设计的统计学要求,实验模型通过最小二乘法拟合二次多项式方程可以表述,Xi、Xj(i=1、2、3;i≠j)为自变量真实值。多项式模型方程拟合的性质由确定系数R2表达,其统计学上的显著性由F值检验;采用Design Expert 7.0软件分析。
2.4.2 Box-Behnken试验设计及结果 3个因素17个试验,按照Box-Behnken设计表进行试验,每个试验号做3次重复,综合评分测定结果取3次的平均值。Box-Behnken试验设计及响应值 (综合评分)见表6(第13~17次实验为5次重复的中心点实验,用于考察模型的误差)。
其F值检验显示总模型方程显著 (P=0.012),R2=0.8925,失拟性检验不显著 (P=0.7634),表明该回归模型的拟合情况良好,回归方程的代表性较好,能准确的预测实际情况。其校正决定系数=0.7543,表明75.43%的试验数据的变异性可用此回归模型来解释,实验过程中存在一定的误差,大约有25%不能由此模型进行解释,回归方程为(Y为综合评分,X1为浸泡时间,X2为煎煮时间,X3为加水量)。
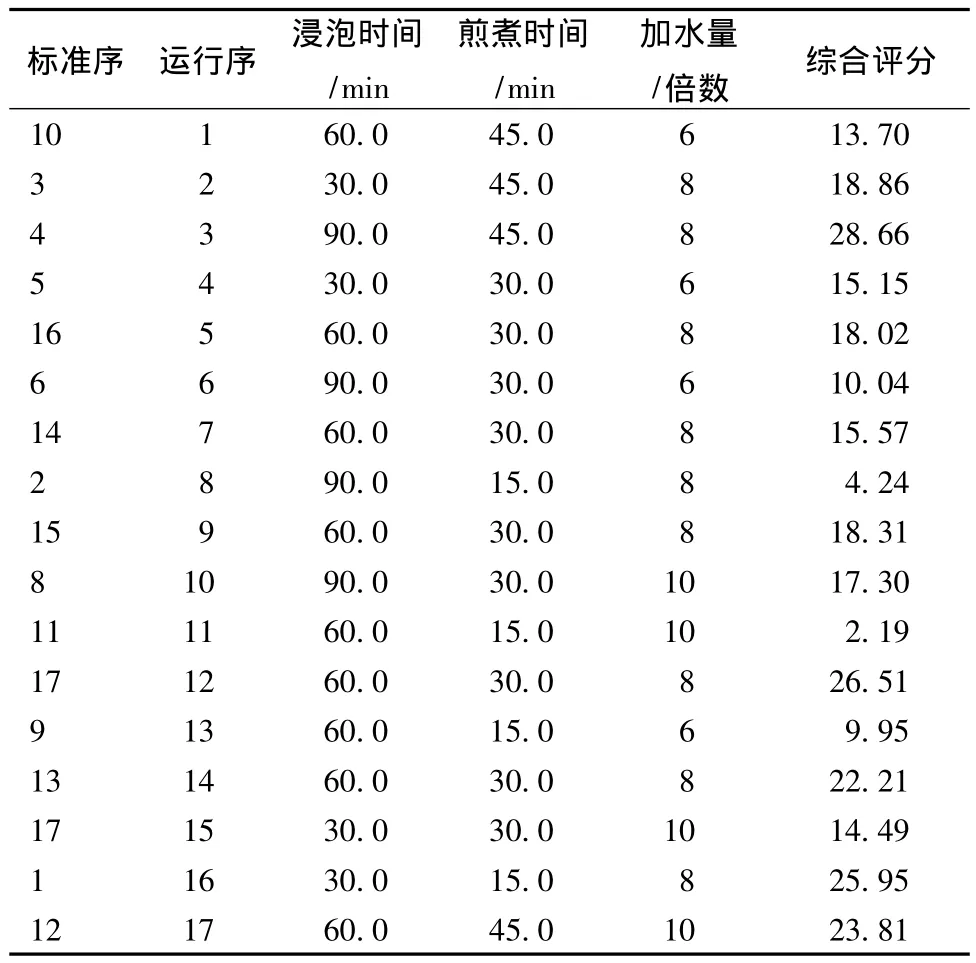
表6 Box-Behnken设计及综合评分Tab.6 Results of Box-Bhehnken design
根据回归分析结果,作出响应曲面图,见图1~3。加水量较浸泡时间和煎煮时间对综合评分的影响更大,煎煮时间和加水量有一定的交互作用。从图可以看出,随着浸泡时间和煎煮时间的延长,综合评分值逐渐下降,但趋势不明显;随着加水量的增加,综合评分值先增大后减小,当加水量为7~9倍时,综合评分值相对最高。综上所述,当浸泡时间在30~40 min,煎煮时间在35~45 min,加水量为7~9倍变动时,综合评分值相对较高。
2.4.3 验证试验 为了确定建立模型与试验结果是否相符,需要进一步试验对模型的可靠性进行验证。在验证试验中,各因素取值在浸泡时间30~40 min,煎煮时间35~45 min,加水量7~9倍(取整数进行组合,其中时间间隔为5 min)进行组合,共有27种组合,按照综合评分的方程计算综合评分的预测值,评分最高的前9组进行验证试验,具体安排见表7。所得的药液,滤过,合并煎液,每次试验重复3次。按照第一部分“2.1.3”项下处理样品,得供试品溶液,注入高效液相色谱仪。根据标准曲线,测定各指标成分含量。按照各指标成分的回归方程 (表2),计算预测值,并与实测值相比较。
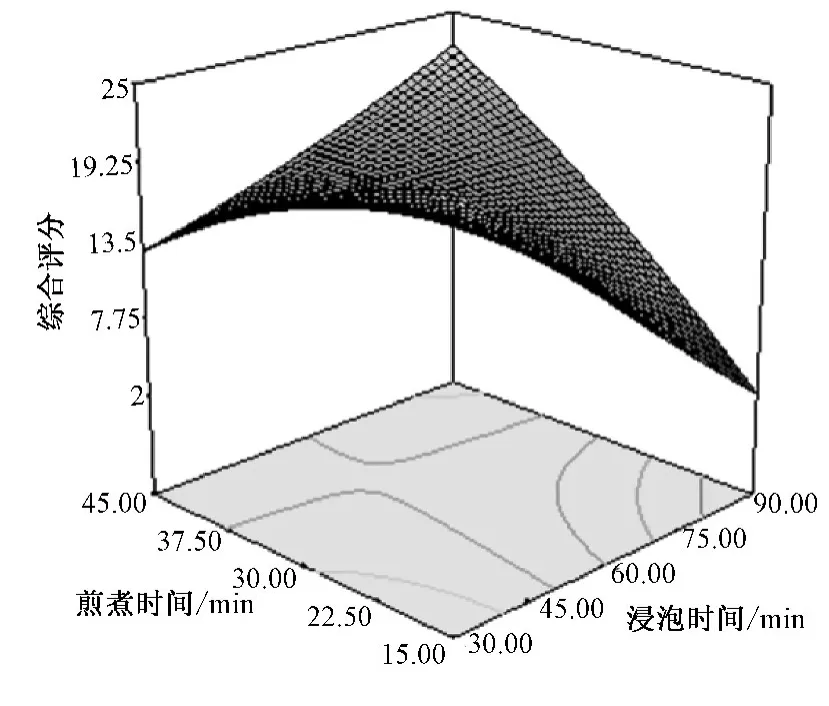
图1 煎煮时间和浸泡时间对综合评分影响的响应面图Fig.1 Parameter-effect figure of synthetic values for decocting and soaking time
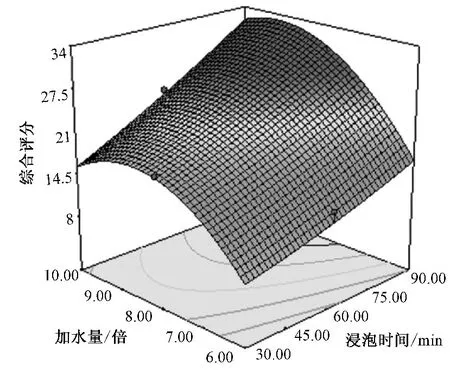
图2 加水量和浸泡时间对综合评分影响的响应面图Fig.2 Parameter-effect figure of synthetic values for water volume and soaking time
结果表明 (表8):在9次验证试验中,第6次试验的厚朴酚、大黄素实测值与预测值的差异差异最小,其他指标成分的量差异也不大。故在较优组合中相对最优的工艺条件为第6次试验条件,即浸泡时间40 min,煎煮时间40 min,加水量9倍。
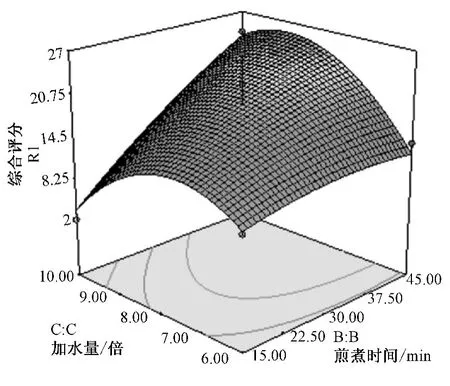
图3 加水量和煎煮时间对综合评分影响的响应面图Fig.3 Parameter-effect figure of synthetic values for water volume and decocting time
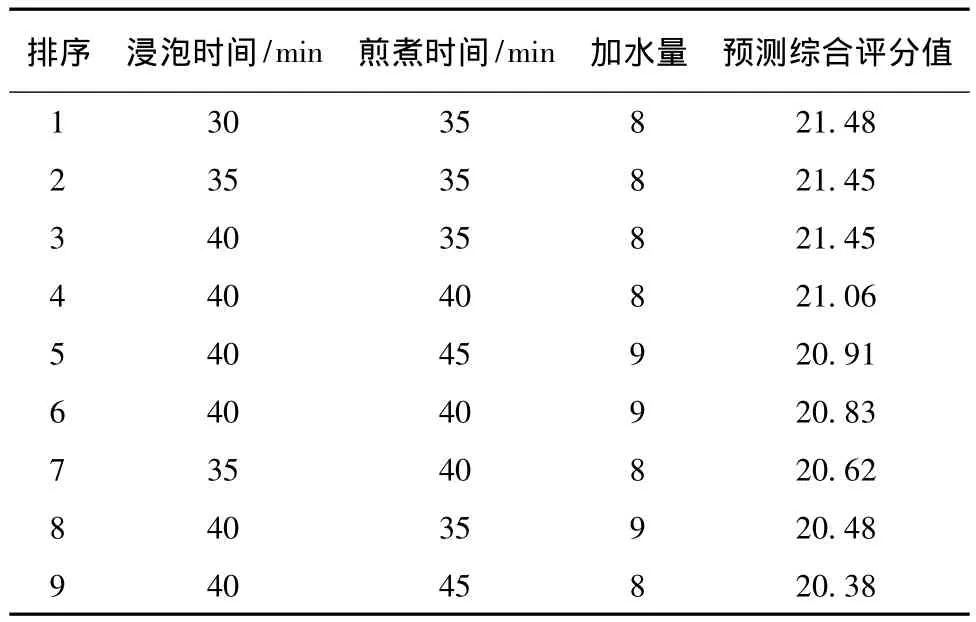
表7 验证试验安排Tab.7 Verifying test schedule
3 结论
由上可知,大承气汤传统煎煮最佳工艺如下:药材饮片加9倍量水浸泡40 min后,厚朴和枳实煎煮35 min,再加入浸泡过的大黄继续煎煮5 min,煎煮液过滤备用,药渣再加7倍量水煎煮2次,每次40 min,合并3次煎液,浓缩,加入芒硝溶化。
4 讨论
国内文献报道工艺研究一般采用均匀设计和正交设计的方法选择较佳工艺,由于试验次数少,数据处理和操作都比较方便,其应用已经达到了普及,然而这两种方法的应用存在着一定的误区,它们是基于线性模型设计的方法,而事实上影响因素与效应值之间又是可能不是线性关系,若忽略这种情况简单进行线性模型设计,就会在很大程度上与真实值发生偏差,而效应面法应用效应面曲面模型进行分析,基于非线性模式进行设计和研究,比较合理[12-13]。
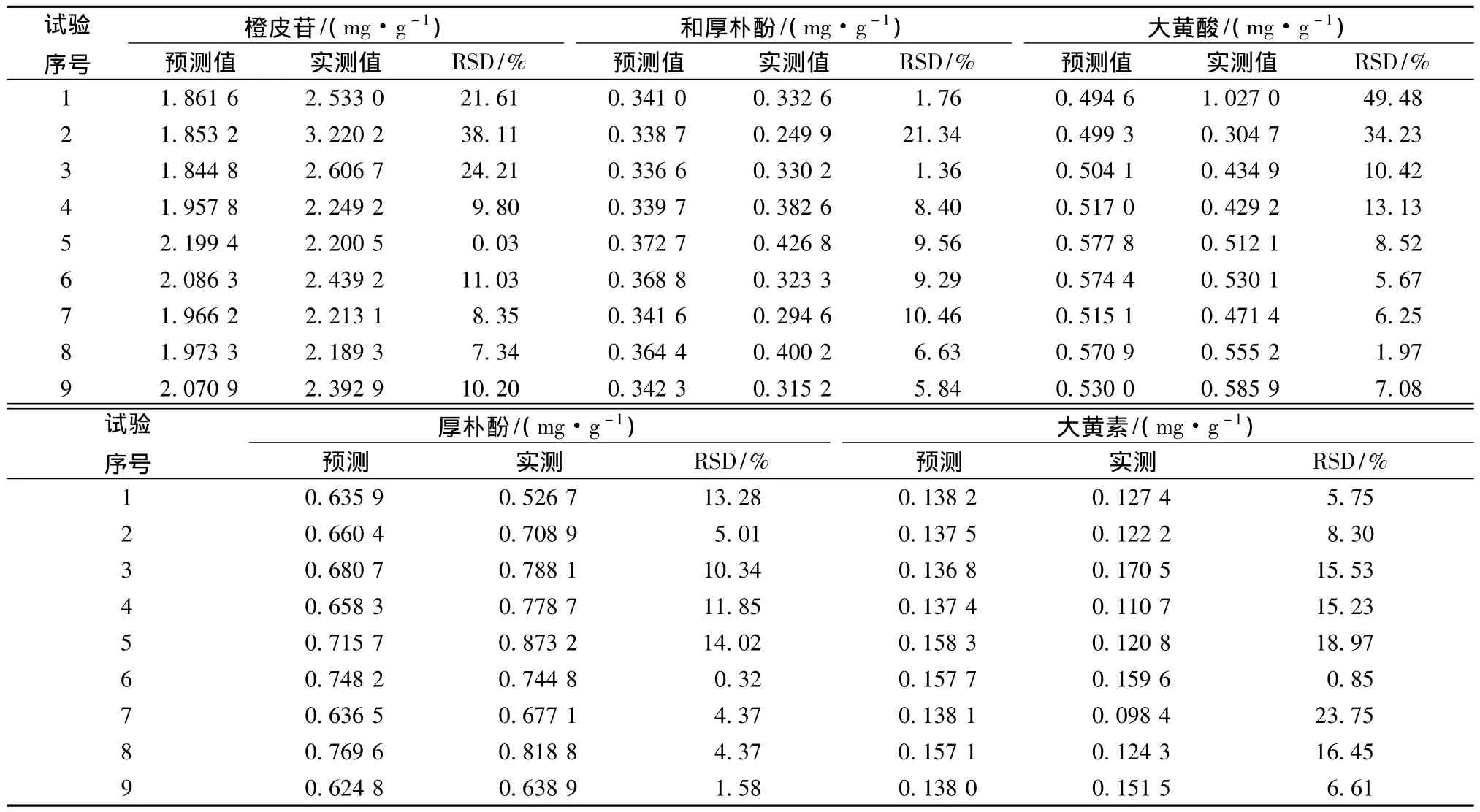
表8 验证试验测定结果Tab.8 Contents results of verifying test
本实验采用Box-Behnken设计,充分考虑到各影响因素间交互作用,设计方法简单,试验次数少,在中心点进行重复试验以提高试验精度,同时采用非线性拟合可信度好,预测值与真实值更接近,结果比均匀设计、正交设计更直观,便于分析。
大承气汤传统煎煮过程中,药材浸泡时间、煎煮时间、加水量等因素没有固定的参数控制,导致所煎出的汤剂有效成分的量参差不齐,药效相差甚远。本实验以大承气汤有效成分综合评分值为评价指标,对其人工煎煮工艺进行研究,量化了各个影响因素的参数,确定了最佳煎煮工艺路线,为使大承气汤成为煎煮工艺稳定、质量可控、疗效确切的中药汤剂奠定了基础。
[1]王继弟,李 浜,张素君.大承气汤研究进展[J].山东中医杂志,2004,23(9):571-573.
[2]卢秀鸾,吴明志,贾锡莲.论大承气汤[J].天津中医药大学学报,2009,28(1):4-5.
[3]Xu F,Liu Y,Zhang Z,et al.Quasi-MSn identification of flavanone 7-glycoside isomers in DCQT by high performance liquid chromatography-tandem mass spectrometry[J].Chin Med,2009,24(4):15.
[4]Qi Q H,Wang J,Hui J F,et al.Effects of Da Chengqi Tang and acupuncture on human gastrointestinal motility disorder[J].World Chin J Digestol,2004,12(1):129-132.
[5]于忠兴,唐风雷,范正达.自动煎药与传统煎煮法对白芍汤剂质量的影响[J].抗感染药学,2006,3(2):81-82.
[6]杨春欣,董 颖,马爱妞,等.高效液相色谱法考察机器与直火煎煮法制备丹参汤剂的质量[J].中国药房,2003,14(5):313-314.
[7]杨 铭,周 昕,谢瑞芳,等.用层次分析法结合CRITIC法研究复方自身清颗粒提取 工艺的多指标权重[J].药学服务与研究,2009,9(1):36-39.
[8]Zhao Q H,Zhou X,Xie R F,et al.Comparison of three weighing methods for evaluation of the HPLC fingerprints of Cortex Fraxini[J].J Liq Chromatogra Relat Technol,2011,34(17):2008-2019.
[9]肖崇厚.中药化学[M].上海:上海科学技术出版社,1987:161-164.
[10]Hao J F,Fang X S,Zhou Y F,et al.Development and optimization of solid lipid nanoparticle formulation for ophthalmic delivery of chloramphenicol using a Box-Behnken.Design[J].Int J Nanomed,2011,6:683-692.
[11]Elbary A A,Aboelwafa A A,Ibrahim M,et al.Once daily,high-dose mesalazine controlled-release tablet for colonic delivery:optimization of formulation variables using Box-Behnken design[J].Pharm Sci Tech,2011,12(4):1454-1463.
[12]Ferreira S L C,Bruns R E,Ferreira H S,et al.Box-Behnken design:An alternative for the optimization of analytical methods[J].Anal Chim Acta,2007,597(2):179-186.
[13]Khajeh M.Application of factorial design and Box-Behnken matrix in the optimization of a magnetic nanoparticles procedure for copper determination in water and biological samples[J].Biol Trace Elem Res,2010,135(1-3):355-363.

