不同工艺感冒灵流膏治疗流感体内药效学试验研究△
张跃飞,高英杰,郭姗姗,时宇静,代志,崔晓兰
(1.华润三九医药股份有限公司 研发中心,深圳 518110;2.中国中医科学院 中药研究所,北京 100700)
重大新药创制专项基金项目(2012ZX09201201-001)
*
张跃飞,博士,研究方向:中药药理毒理;E-mail:zyf04@999.com.cn
不同工艺感冒灵流膏治疗流感体内药效学试验研究△
张跃飞1*,高英杰2,郭姗姗2,时宇静2,代志1,崔晓兰2
(1.华润三九医药股份有限公司 研发中心,深圳 518110;2.中国中医科学院 中药研究所,北京 100700)
目的采用甲型H1N1流感病毒感染小鼠肺炎模型评价不同工艺感冒灵流膏对流感的治疗作用,为临床治疗流感的应用提供试验依据。方法采用甲型H1N1流感病毒FM1和PR8株分别感染正常动物造成肺炎模型,新工艺大、中、小剂量分别为1.8,0.9,0.45 g生药·kg-1·d-1(分别相当于人临床用药量的2倍、等倍和1/2倍),原工艺小鼠剂量为1.34 g生药·kg-1·d-1(相当于人临床用药量的2倍),醇沉沉淀小鼠用量为0.48 g生药·kg-1·d-1(相当于人临床用药量的2倍),感染当天给药4 d,观察不同工艺感冒灵流膏对肺指数、死亡率、死亡保护率、平均存活天数和生命延长率的影响,并测定血清中免疫球蛋白M(IgM)含量以及肺组织中病毒载量和γ干扰素(IFN-γ)含量,进行机理的探索性研究。结果FM1和PR8株感染正常小鼠造成肺炎模型,感染当天给予感冒灵浸膏治疗4 d后,FM1株新工艺大、中剂量组和原工艺组肺指数均有明显降低(P<0.05、P<0.01);PR8株新工艺大剂量组和原工艺组肺指数明显降低(P<0.05);FM1株新工艺大、中剂量组和原工艺组均可显著降低小鼠肺组织中病毒载量,与模型对照组比较差异有统计学意义(P<0.01);各工艺药物对FM1模型小鼠血清IFN-γ含量和IgM含量无明显影响(P>0.05)。对PR8株模型新工艺大、中、小、原工艺和醇沉部分各给药组均可提高肺组织IFN-γ含量(P<0.05,P<0.01)。新工艺大、中、小3个剂量和原工艺组可明显减少FM1和PR8株感染动物的死亡数,并可明显延长动物存活天数(P<0.05、P<0.01);醇沉沉淀对PR8株模型有一定程度延长动物存活天数的作用(P<0.05)。结论新工艺及原工艺制剂对FM1和PR8株感染小鼠肺炎均有明显治疗作用;醇沉部分也有一定的治疗作用。
感冒灵流膏;工艺;流感;体内药效学
感冒灵为已上市的中西药复方制剂,功能主治为解热镇痛,用于感冒引起的头痛,发热,鼻塞,流涕,咽痛等。现行工艺中野菊花、金盏银盘、三叉苦、岗梅4味中药采取水提醇沉工艺,该品种二次开发过程中,拟进行工艺变更,新工艺取消醇沉过程。为评价感冒灵新工艺流膏对流感的治疗作用,我们设计了相应的药效学试验,为增加功能主治的应用提供试验依据。
1 材料
1.1 受试药品
将三叉苦等4味中药按处方配比,加水煎煮2次,得感冒灵提取液(批号:20100115)。
感冒灵原工艺流膏(取感冒灵提取液,批号20100115,浓缩,醇沉,取上清液,浓缩成流膏,按处方比例加入3味化学药,混合均匀,即得),批号:20100115Y,含量:9.95 g生药·g-1,性状:深棕色浸膏。感冒灵新工艺流膏(取感冒灵提取液,批号20100115,浓缩成流膏,按处方比例加入3味化学药,混合均匀,即得),批号:20100115X,含量:7.29 g生药·g-1,性状:深棕色流膏。感冒灵醇沉沉淀(取感冒灵原工艺醇沉后产生的沉淀),批号:20100115C,含量37.49 g生药·g-1,性状:深棕色膏状物。储存条件:4 ℃冰箱。
1.2 阳性对照药
磷酸奥司他韦胶囊(商品名:达菲,瑞士巴塞尔豪夫迈·罗氏有限公司生产,上海罗氏制药有限公司分装,批号:B1212,分装批号:SH0034);连花清瘟胶囊(石家庄以岭药业股份有限公司,批号:091182)。
1.3 剂量设计
1.3.1 原工艺流膏 原工艺制备的中药流膏,按照处方比例,与对乙酰氨基酚、咖啡因、马来酸氯苯那敏混合,原工艺小鼠剂量为1.34 g生药·kg-1·d-1,相当于人临床等效量的2倍。
1.3.2 新工艺流膏 新工艺制备中药流膏,按照处方比例,与对乙酰氨基酚、咖啡因、马来酸氯苯那敏混合,换算成小鼠临床等倍量,实验时采用以上药物混合后2倍、等倍、1/2倍剂量,分别作为新工艺大、中、小剂量。新工艺大、中、小剂量分别为1.8 g生药·kg-1·d-1、0.9 g生药·kg-1·d-1、0.45 g生药·kg-1·d-1(分别相当于人临床用药量的2倍、等倍和1/2倍)。
1.3.3 醇沉沉淀 醇沉沉淀的小鼠用量为0.48 g生药·kg-1·d-1,相当于人临床等效量的2倍。
1.3.4 阳性药 达菲、连花清瘟胶囊换算成小鼠等效剂量。试验时以上各药物按0.2 mL·(10 g)-1灌胃给药。
1.4 动物
ICR小鼠(SPF/VAF级),体重(14±1)g,雌雄不限。由北京维通利华试验动物技术有限公司提供,动物许可证:SCXK(京)2006-0009。
1.5 病毒株
甲型H1N1流感病毒鼠肺适应株(FM/1/47株和PR/8/34株),购自中国疾病预防控制中心病毒病预防控制研究所,由中国中医科学院中药研究所ABSL-2试验室传代,-80 ℃保存备用。
1.6 试剂
乙醚(北京试剂公司,批号:20090707);小鼠γ干扰素酶(IFN-γ)酶联反应试剂盒(美国R&D公司,生产批号:08/2010);小鼠IgM酶联反应试剂盒(美国R&D公司,生产批号:09/2010);PCR检测试剂:一步法荧光染料RT-PCR试剂盒(TaKaRa公司,货号:DRR086A);Trizol提取总RNA试剂(Invitrogen公司);逆转录-聚合酶链反应试剂盒、TaqDNA聚合酶、dNTP、DNA marker(Takara公司);GAPDH、H1N1上下游引物均为美国invitrogen(上海)英骏生物技术有限公司合成;三氯甲烷、异丙醇、99%乙醇均为分析纯。
1.7 仪器
Applied Biosystems 7500型定量PCR仪(美国应用生物系统公司);HC-3018R高速冷冻离心机(中科中佳公司);RT-6000酶标仪(深圳雷杜生命科学股份有限公司);MSC1.8 A2型生物安全柜(德国Thermo公司);YP/0001动物体重电子天平(上海越平科学仪器有限公司);AR1140动物脏器电子天平(美国Chaus)。IVC小鼠饲养笼(苏州教学笼具厂)。
1.8 试验场所
中国中医科学院中药研究所ABSL-2生物安全实验室。
2 方法
2.1 治疗给药对流感病毒感染正常小鼠肺炎模型的作用(肺指数)
取小鼠按体重等级随机分为9组,分别为正常对照组,模型对照组,达菲对照组,连花清瘟胶囊对照组,新工艺大、中、小3个剂量组,原工艺组,醇沉沉淀组,每组10只。除正常对照组外,将小鼠用乙醚轻度麻醉,以15个LD50流感病毒液(FM1和PR8株)滴鼻感染,每只35 μL。感染当天开始每次按0.2 mL·(10g)-1体重灌胃给药,每天1次,连续4 d,正常对照组和模型对照组在同等条件下蒸馏水灌胃。第5天称重后摘眼球取血待测血清中细胞因子含量(IgM),然后解剖称肺重,计算肺指数及肺指数抑制率,肺组织留存待测病毒载量和细胞因子含量(IFN-γ)。结果采用单因素方差进行统计学处理。肺指数及肺指数抑制率计算公式如下:
肺指数=肺湿重(g)/体重(g)
肺指数抑制率=(模型对照组肺重-实验组肺重)/(模型对照组肺重-正常对照组肺重)×100%
2.2 治疗给药对流感病毒感染正常小鼠肺炎模型的死亡保护作用
取小鼠按体重等级随机分为8组,分别为模型对照组,达菲对照组,连花清瘟胶囊对照组,新工艺大、中、小3个剂量组,原工艺组,醇沉沉淀组,每组20只。各组小鼠用乙醚轻度麻醉,以15个LD50流感病毒液(FM1和PR8株)滴鼻感染,每只35 μL。感染当天开始给药,每次按0.2 mL·(10 g)-1体重灌胃,每天1次,连续4 d,模型对照组在同等条件下蒸馏水灌胃。观察感染后16 d动物的死亡情况,计算死亡率、死亡保护率、平均存活天数和生命延长率。死亡保护率的比较采用卡方检验,平均存活天数的组间比较采用单因素方差进行统计学处理。死亡率、死亡保护率、生命延长率计算公式如下:
死亡率=死亡数/动物总数×100%
死亡保护率=(模型对照组死亡率-实验组死亡率)/模型对照组死亡率×100%
生命延长率=(实验组存活天数-模型对照组存活天数)/模型对照组存活天数×100%
2.3 肺组织中病毒载量的测定
2.3.1 引物设计与合成 针对流感病毒(H1N1)基因序列的上下游引物分别是:5′-GACCAATCCTGTCAC CTCTGAC-3′和5′-GGGCATTTGGACAAACGTCTACG-3′;针对内参基因GAPDH(监控总RNA的使用量,以消除不同样本间加样导致的误差)基因序列的引物分别是:5′-GGTGAAGGTCGGTGTGAACG-3′和5′-CT CGCTCCTGGAAGATGGTG-3′。
2.3.2 Real-time RT-PCR扩增 使用TRIzol试剂提取肺组织中的RNA后,分别用上述H1N1和GAPDH引物进行一步法实时荧光PCR反应,反应体积为20 μL,反应体系含样本RNA 2μL,2×One Ste PSYBR RT-PCR Buffer 10 μL,PrimeScript 1 Ste PEnzyme Mix 2 0.8 μL,10 μmol·L-1引物各0.8 μL。反应条件为:42 ℃灭活5 min,95 ℃变性10 sec,95 ℃退火5 sec,60 ℃延伸34 sec,共40个循环。反应结束后进行熔解曲线分析,以鉴定PCR产物的特异性。使用Sequence Detection System软件分析PCR过程各检测样本的Ct(Threshold of cycle)值。
2.3.3 结果计算方法及统计方法 本实验使用相对定量的方法,以GAPDH作为内对照,选择一个样品(Con)作为Calibrator,计算方法如下:
Con△Ct=Con Ct-Con GAPDH Ct
样本△Ct=样本Ct-样本GAPDH Ct
样本△△Ct=样本△Ct-Con△Ct
相对含量的变化=2-△△Ct×100%(2-△△Ct是各处理组基因表达相对Calibrator的倍数改变)
病毒载量抑制率=(模型对照组病毒载量-实验组病毒载量)/模型对照组病毒载量×100%
结果采用组间t检验进行统计学处理。
2.4 IgM和IFN-γ含量测定方法
各组小鼠血清按照两步双抗夹心酶联免疫吸附法(Elisa)测定IgM的含量;各组肺组织用PBS进行匀浆,离心后取上清液,然后按照Elisa试剂盒说明书检测IFN-γ的含量。结果采用组间t检验进行统计学处理。
3 结果
3.1 治疗给药对流感病毒感染小鼠肺指数的影响
采用甲型H1N1流感病毒FM1和PR8两株病毒感染正常小鼠后,小鼠肺指数明显增高,与正常对照组比较差异有统计学意义(P<0.01);感染当天开始给予感冒灵治疗4 d后,FM1株新工艺大、中剂量组和原工艺组肺指数均有明显降低,与模型对照组比较差异有统计学意义(P<0.05,P<0.01);PR8株新工艺大剂量组和原工艺组肺指数明显降低,与模型对照组比较差异有统计学意义(P<0.05)。结果见表1。
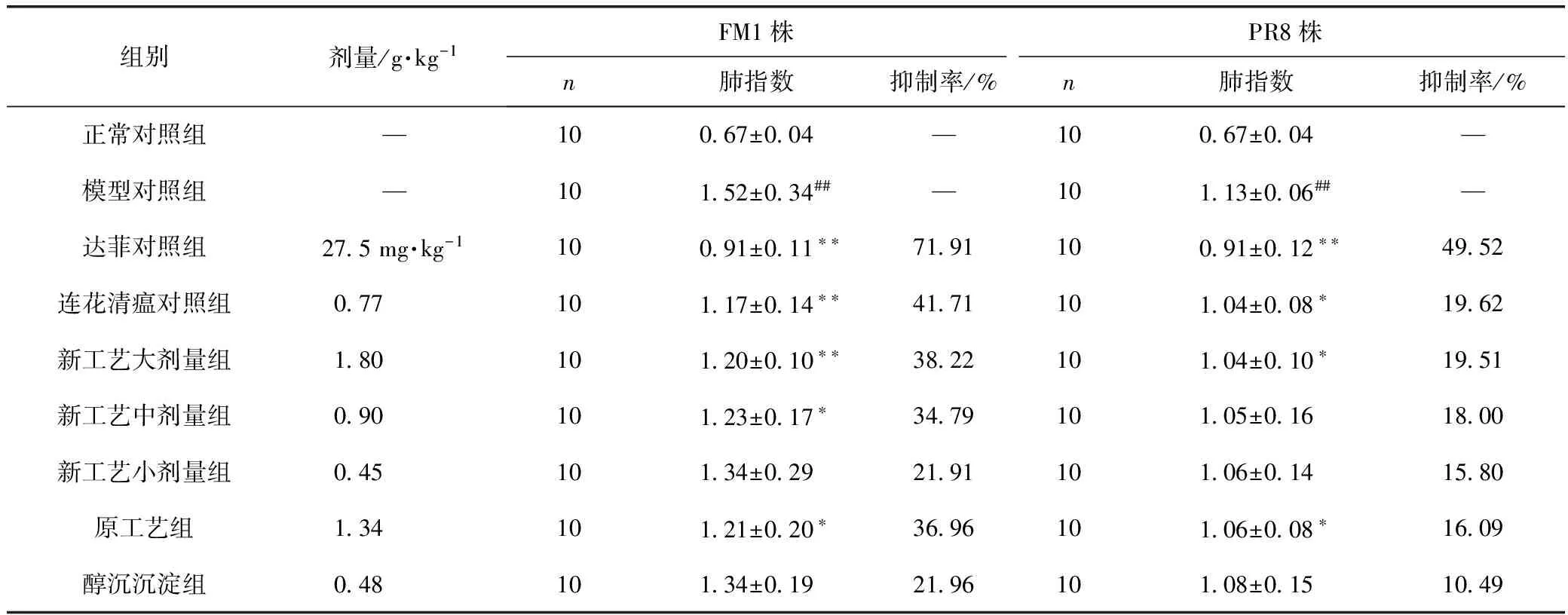
表1 治疗给药对流感病毒感染正常小鼠肺炎模型的作用(肺指数)
注:与正常对照组比较,##P<0.01;与模型对照组比较,*P<0.05,**P<0.01;下同
3.2 治疗给药对流感病毒感染致小鼠死亡的保护作用
采用甲型H1N1流感病毒FM1株病毒感染正常小鼠2周内,模型组动物死亡率为100%,平均存活天数为9.00 d;感染当天治疗性给予感冒灵,连续4 d,新工艺大、中、小3个剂量组动物的死亡数明显减少,死亡率分别为55.00%、65.00%和60.00%,死亡保护率分别为45.00%、35.00%和40.00%,3个剂量组与模型组比较差异有统计学意义(P<0.01,P<0.05);原工艺组动物的死亡数明显减少,死亡率为50.00%,死亡保护率为50.00%,与模型组比较差异有统计学意义(P<0.01)。新工艺3个剂量组和原工艺组均可延长动物平均存活天数,分别为11.75,11.80,11.45,11.80 d,且与模型组比较差异均有统计学意义(P<0.01)。结果见表2。
采用甲型H1N1流感病毒PR8株病毒感染正常小鼠2周内,模型组动物死亡率为95%,平均存活天数为8.15 d;感染当天治疗性给予感冒灵连续4 d,新工艺大、中、小剂量组和原工艺组动物的死亡数明显降低,死亡率分别为55.00%、65.00%、60.00%和50.00%,死亡保护率分别为42.11%、31.58%、36.84%和47.37%,与模型对照组比较差异均有统计学意义(P<0.01,P<0.05);新工艺3个剂量组、原工艺组和醇沉沉淀组动物平均存活天数分别为11.50,11.30,11.45,12.05,10.35 d,与模型对照组比较差异均有统计学意义(P<0.01、P<0.05)。结果见表3。
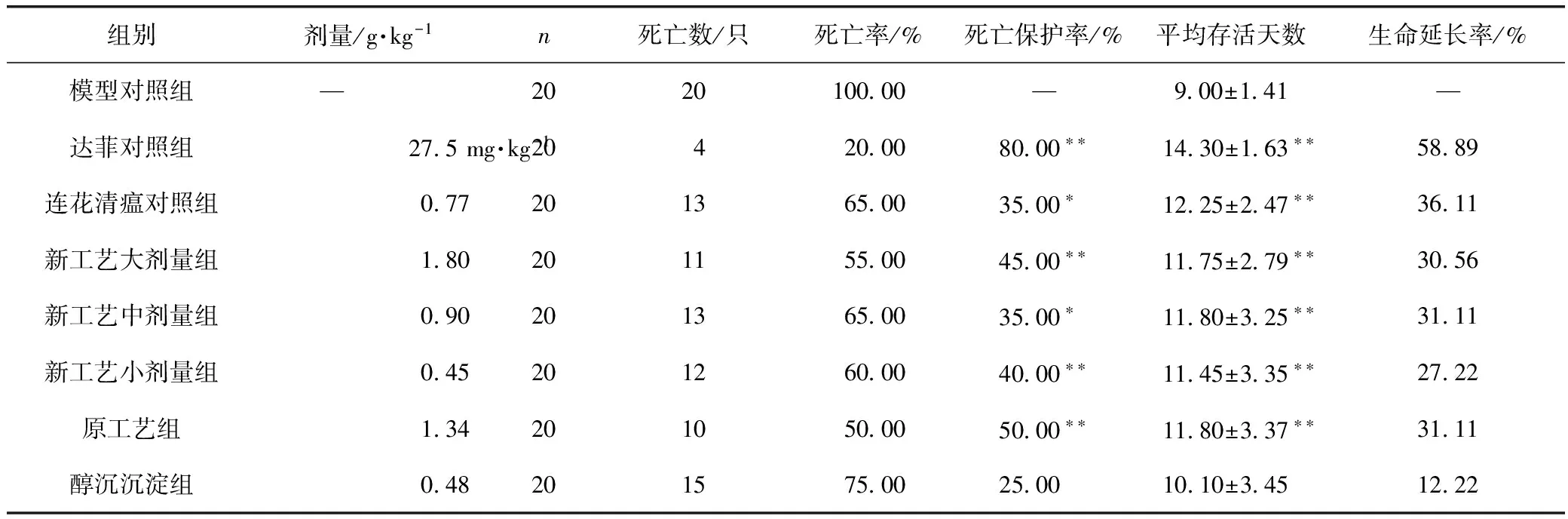
表2 治疗给药对流感病毒FM1株感染正常小鼠肺炎模型的死亡保护作用
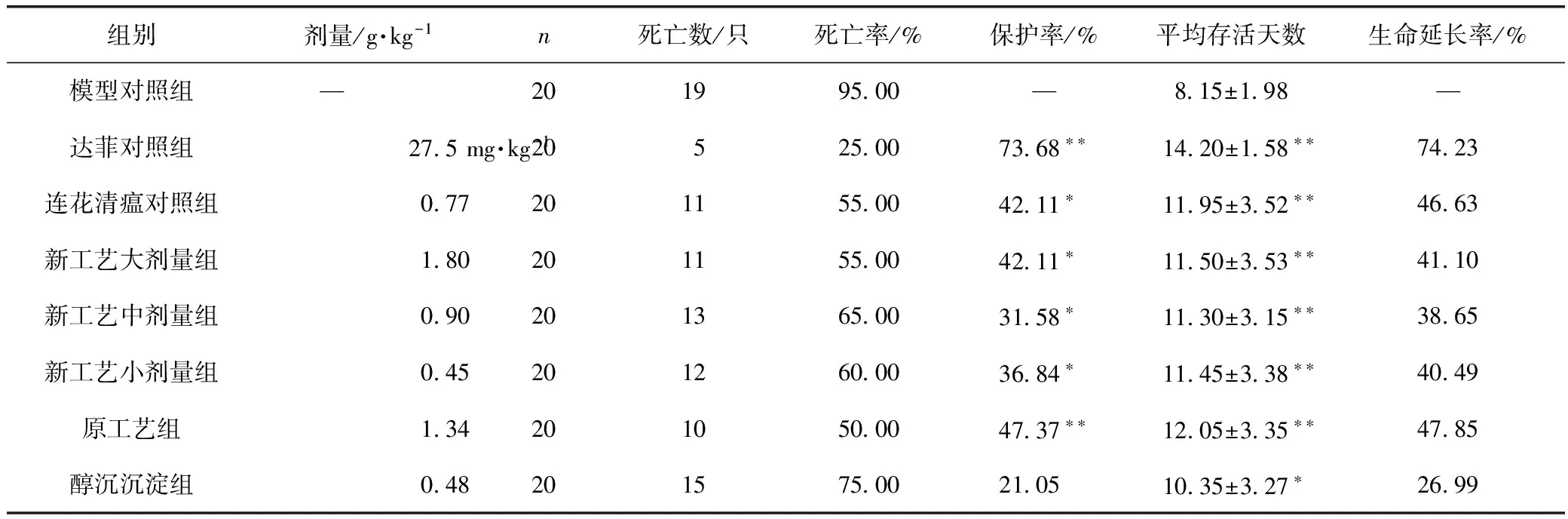
表3 治疗给药对流感病毒PR8株感染正常小鼠模型的死亡保护作用
3.3 治疗给药对流感病毒FM1株感染正常小鼠肺组织中病毒载量的影响
采用甲型H1N1流感病毒FM1株病毒感染小鼠后,肺组织中病毒基因出现高表达;新工艺大、中剂量组和原工艺组治疗4 d后均有降低病毒载量的作用,抑制率分别为99.79%、99.60%和99.70%,与模型对照组比较差异有统计学意义(P<0.01)。结果见表4。
3.4 治疗给药对流感病毒感染正常小鼠肺组织中IFN-γ和血清中IgM的影响
采用甲型H1N1流感病毒FM1株病毒感染正常小鼠造成肺炎模型,当天给予感冒灵新工艺、原工艺和醇沉沉淀治疗4 d,各工艺药物对小鼠肺组织IFN-γ含量和血清IgM含量无明显影响。结果见表5。
采用甲型H1N1流感病毒PR8株病毒感染正常小鼠造成肺炎模型,模型对照组肺组织IFN-γ和血清IgM含量与正常对照组比较差异无统计学意义(P>0.05);当天给予感冒灵新工艺、原工艺和醇沉沉淀治疗4 d,新工艺大、中、小剂量组,原工艺和醇沉沉淀组均可提高肺组织IFN-γ含量,与模型对照组比较差异有统计学意义(P<0.05,P<0.01);各工艺组对小鼠血清IgM含量无明显影响(P>0.05)。结果见表6。
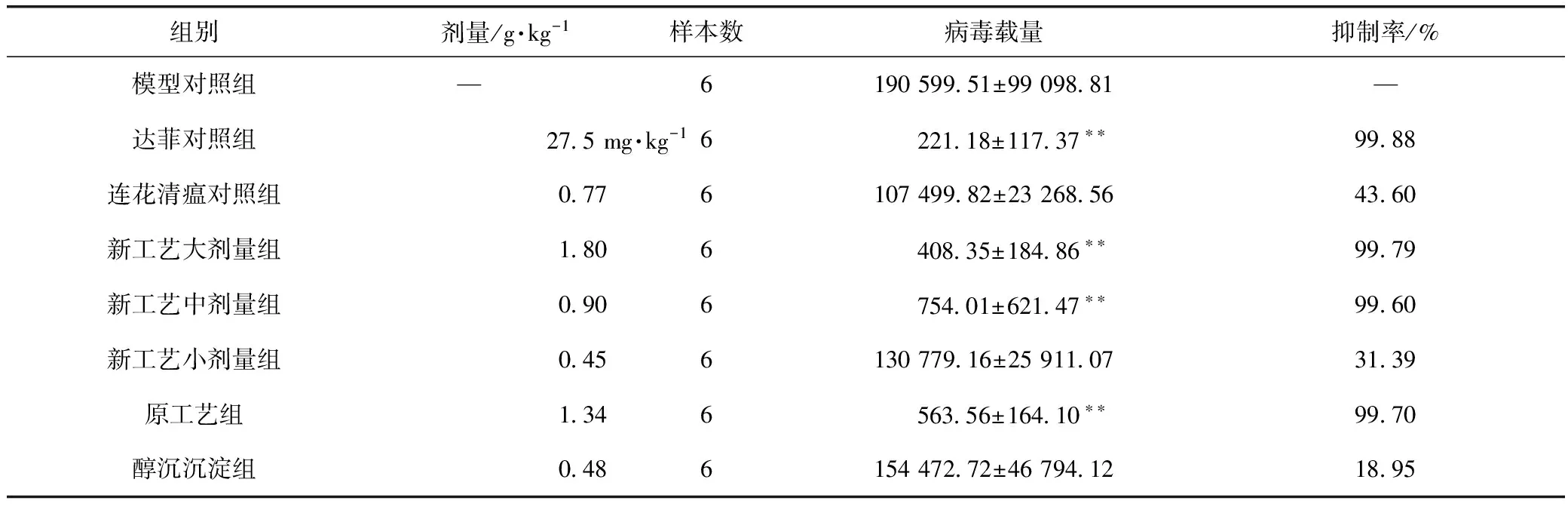
表4 治疗给药对流感病毒FM1株感染小鼠肺组织中病毒载量的影响
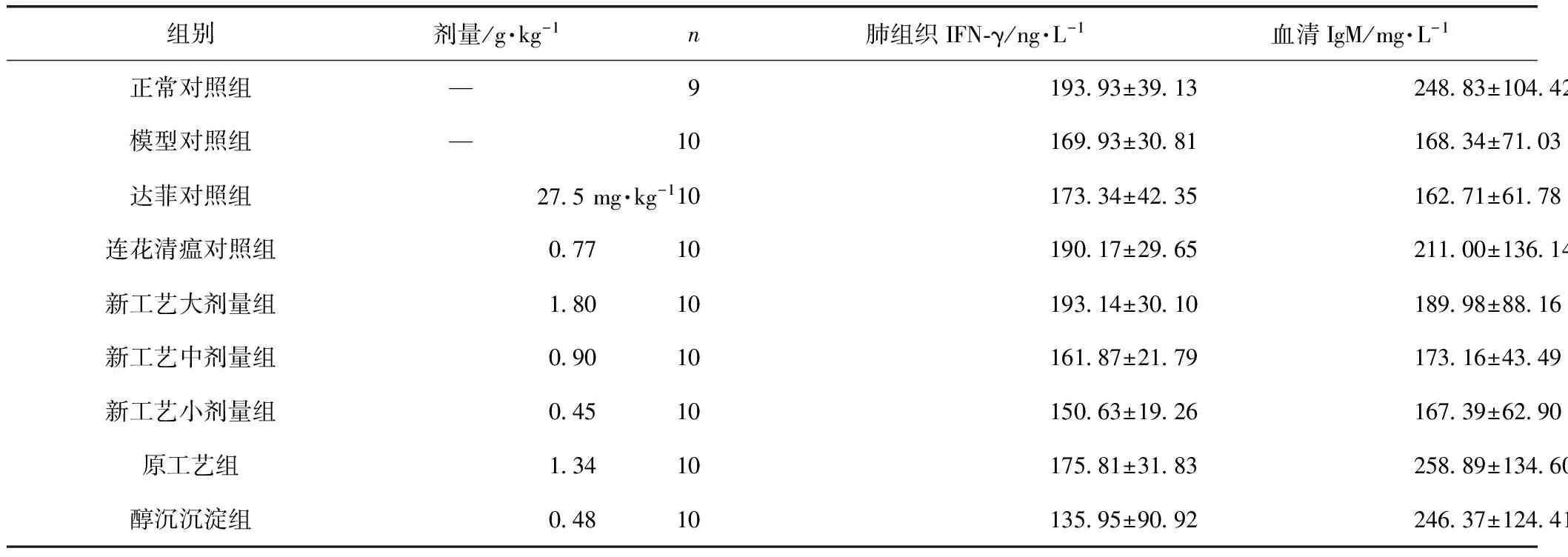
表5 治疗给药对流感病毒FM1株感染正常小鼠细胞因子含量的影响

表6 治疗给药对流感病毒PR8株感染正常小鼠细胞因子含量的影响
4 讨论
感冒灵为中西药复方制剂,其中有野菊花、金盏银盘、三叉苦、岗梅4味中药,中药水提取物中常含有一定量的高分子物质,这些物质多为淀粉、蛋白质及多糖类成分,传统中药制剂工艺中常将其视为无效成分,采用乙醇沉淀的方法将其去除。感冒灵颗粒现行生产工艺即采用加乙醇至含醇量60%~65%的醇沉工序。
近年来,随着人们对多糖类物质化学结构及生物功能认识的加深,证实了这类植物细胞壁骨架成分具有多种生理活性,如:抗氧化、抗病毒、免疫调节、抗肿瘤、降血糖等。感冒灵颗粒中药水提取物醇沉淀丢弃物中所包含的多糖类物质可能具有提高感冒患者免疫力的作用,能够辅助制剂中的小分子化学成分发挥最佳疗效。因此,我们对感冒灵原工艺、新工艺(取消醇沉)及醇沉沉淀的体内抗流感病毒作用进行了研究,结果表明原工艺与新工艺流膏对FM1和PR8株感染小鼠肺炎均有明显治疗作用,二者作用强度相当;用醇沉部分治疗也可一定程度上降低模型动物的死亡数及延长动物的存活天数。机理研究中,给予感冒灵各工艺浸膏治疗4 d,新工艺及原工艺可降低FM1株流感病毒感染正常小鼠肺组织中病毒载量;新工艺、原工艺及醇沉部分均可提高PR8株流感病毒感染正常小鼠肺组织IFN-γ含量;对FM1株流感病毒感染正常小鼠肺组织IFN-γ和血清IgM无明显影响。该试验为感冒灵工艺改进及增加抗流感病毒适应症提供了依据。
[1] Robert B Belshe.Human Virology[M].New York:PSG Publishing Company Inc,1984:267-298.
[2] 陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:251-256.
[3] 富杭育,卢长安,贺玉琢,等.清肺饮抗小鼠流感病毒性肺炎的实验研究[J].中华实验和临床病毒学杂志,1996,10(4):381.
[4] 中华医学会呼吸病学分会.流行性感胃临床诊断和治疗指南(2004年修订稿)[J].中华结核和呼吸杂志,2005,28(1):5-7.
[5] 蔡映云,杨振华.流行性感冒疫苗与药物的预防作用[J].中华结核和呼吸杂志,2002,25(11):647-648.
[6] 李龙芸,蔡柏蔷,朱元钰,等.磷酸奥司他韦治疗流行性感冒的多中心临床研究[J].中华内科杂志,2001,40(12):838-842.
[7] Lackenby A,Hungnes O,Dudman SG,et al.Emergence of resistance to oseltamivir among influenza A(H1N1)viruses in Europe[J].Euro Surveill,2008,13(5):8026.
[8] Nicoll A,Ciancio B,Kramarz P.Observed oseltamivir resistance in seasonal influenza viruses in Europe interpretation and potential implications[J].Euro Surveill,2008,13(5):8025.
[9] Influenza Project Team.Oseltamivir resistance in human seasonal influenza viruses(A/H1N1)in EU and EFTA countries:an update[J].Euro Surveill,2008,13(6):8032.
[10] 范鸣.抗病毒药达菲致神经精神类不良反应[J].药学进展,2006,30(3):139-140.
PharmacodynamicExperimentinvivoofGanmaolingExtractumwithDifferentProcessonTreatmentofInfluenza
ZHANGYuefei1*,GAOYingjie2,GUOShanshan2,SHIYujing2,DAIZhi1,CUIXiaolan2
(1.R&DDepartment,ChinaResourcesSanjiuMedical&PharmaceuticalCo.,Ltd.,Shenzhen518110,China;2.InstituteofChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China)
Objective:Pneumonia model infected with influenza virus H1N1 was adopted to evaluate the efficacy of in vivo protection of Ganmaoling extractum with different process.Experimental basis for the treatment of influenza for clinical application was provided.MethodsPneumonia model was set up by infection of normal mice with influenza virus FM1 and PR8 of H1N1 separately.Large,moderate,and small doses of the extractum with new process were 1.8 g crude drug/kg/day,0.9 g crude drug/kg/day,and 0.45 g crude drug/kg/day respectively,which amounted to twice,once,and half dosage in clinic.Dosage of the extractum with old process was 1.34 g crude drug/kg/day,which amounted to twice of the dosage in clinic.Dosage of the extractum with alcohol sedimentation technique was 0.48 g crude drug/kg/day equivalent to twice dosage in clinic.Different extractum were administered for 4 days after the administration of virus,and the lung index,death rate,protection rate of death,and life extension rate were observed.Immune globulin M(IgM)level in blood serum,viral load and γ interferon(IFN-γ)level in lung tissue were determined to explore the mechanism.ResultsIn the experimental research in pneumonia models of normal mice,after 4 days of treatment administration with Ganmaoling extractum,the lung index of animal of FM1 in large and moderate dosage with new process group and in old process group were decreased apparently(P<0.05,P<0.01).The lung index of animal in large dosage with new process group and old process group of PR8 were decreased apparently(P<0.05).Virus load in lung tissue of animal in large and moderate dosage with new process group and old process group of FM1 had significant differences compared with the model group(P<0.01).IFN-γ level and IgM level in blood serum of animal in all groups of FM1 had no obvious effect(P>0.05).IFN-γ level in lung tissue of animal in all groups of PR8 was increased(P<0.05,P<0.01).Deaths of animal in large and moderate dosage group with new process and old process group of FM1 and PR8 were decreased apparently,furthermore,survival days were prolonged(P<0.05,P<0.01).Survival days of animal in alcohol sedimentation technique group of PR8 were prolonged in some extent(P<0.05).ConclusionGanmaoling extractum with new process and old process had therapeutical effect to pneumonia mice infected with influenza virus FM1 and PR8.Alcohol precipitation part had certain therapeutical effect.
Ganmaoling Extractum;Process;Influenza;Pharmacodynamic Experiment in vivo
10.13313/j.issn.1673-4890.2014.06.008
2013-09-24)

