不同苹果品种抗寒性的研究
李淑玲,冯景玲,冯建荣,李亚兰,赵宝龙,樊新民
(石河子大学农学院,石河子 832003)
苹果属于蔷薇科苹果属为多年生落叶果树,世界上苹果属植物约有35种。主要分布在北温带包括亚洲欧洲和北美洲中国原产有24个[1]。苹果成为重要的经济类果树[2]。近年来,新疆苹果种植面积稳中有升,产量持续增长,出口量逐年扩大。但由于受独特地域性气候影响,生产上一直存在苹果品种耐寒能力差的问题[3],同时由于病虫害频繁发生、管理水平粗放、科技支撑能力不足等严重影响着新疆苹果产业的进一步发展。具有较强抗寒力的苹果品种也是一个亟需研究的方面[3-4]。针对新疆苹果产业的发展,引入优质抗寒苹果品种则显得十分的重要。低温一直是限制新疆地区苹果产业发展的决定性因素之一。陈学森等[5]调查结果表明,不同品种冻害程度差异很大,说明选育并推广抗寒性强的品种是避免和减轻冻害最有效的途径之一。引入品种能否适应本区冬季低温,是决定该品种能否在本区进行种植及大面积推广的决定性因素。为此,评定引入品种的抗寒性能显得十分重要。
研究[6-8]表明,低温胁迫后萌芽率调查对品种资源的抗寒性进行比较、分类,选出抗寒性较强的品种和类型。电导率值作为苹果抗寒性的生理生化指标,对于预测品种、砧木的抗寒性方面有相当的实用价值[9-10]。朱根海等[11]认为,可以用Logistic方程中拐点温度来估计植物组织的低温半致死温度(LT50),万清林[12]研究草莓抗寒生理特性指出,低温不但使膜透性、胞间物质浓度发生改变,并进一步指出可溶性糖、脯氨酸浓度发生改变,岳英等[13]对梨的研究发现,抗寒性强的品种冬季脯氨酸积累保持较高水平,而抗寒性较弱的品种则处于较低水平,高志红等[14]对果梅的研究表明,低温下其枝条内可溶性蛋白和可溶性糖含量等与抗寒性呈显著相关,可作为抗寒种质筛选的指标,汤照云等[15]认为可溶性蛋白质对植株抗逆具有重要作用。学者们[16-17]认为通过测定丙二醛含量的变化来反应植物细胞发生膜脂过氧化的剧烈程度和植物对逆境条件反应的强弱。新疆北部属于寒地苹果产区,仅适宜一些抗寒力强的苹果类栽培[18],选择抗寒性较强的品种对扩大苹果经济栽培产区具有重要意义。
目前,关于苹果的砧木抗寒[9]、苹果品种生物学特性[19]研究很多,但对新疆引进苹果品种抗寒适应性方面的研究报道却不多。张军等[20]对2个居群下的7个新疆野苹果群体当年生枝条进行了抗寒性的电阻抗图谱分析,陈云华等[21]对伊犁河谷的苹果进行了冻害调查分析。本试验通过模拟低温环境条件对8个苹果品种的生理指标进行综合的检测与分析。
本试验通过人工模拟低温环境的方法,对8个苹果品种的1年生休眠枝条进行自然越冬后及低温处理后枝条萌芽率、相对电导率、脯氨酸、可溶性蛋白、丙二醛含量等指标进行测定,旨在为抗寒苹果品种鉴定筛选和应用提供参考。
1 材料与方法
1.1 材料
供试的8个苹果品种栽植于石河子大学试验站,于2012年10月底采集枝条,每品种选取5棵树,取中部枝条,每树采集5~6根生长健壮、粗细均匀一致的1年生休眠枝条。8个品种及其亲本、来源见表1。

表1 供试品种及其亲本、起源Tab.1 Experiment varieties and their parent,origin
1.2 方法
1.2.1样品的低温处理
将采集供试品种1年生枝条从基部第4芽开始选取保留有10个饱满芽眼15 cm长的枝段,除去枝条表面污垢并且用塑料膜包好。每品种分5份,每份包括枝条15根,用干净纱布包好放入塑料袋中,置于超低温冰箱中人工冷冻处理。共设置-15、-20、-25、-30和-35 ℃等5个低温梯度,以 4℃为对照。以4℃/h的速率降温,到达设定温度后保持6 h,取出置于4℃下保持12 h,待用于指标测定,测定时每品种均重复3次。
1.2.2低温枝条的恢复生长试验
苹果需冷量<7.2℃低温1200 h左右,本试验8个品种枝条在-4℃存储2个月,均达到一般品种低温需冷量[6],根据枝条的萌芽力测定,每个品种选取3根枝条,浸泡于水桶中,在恒温温室内(20℃左右)观测发芽情况,1个月后统计萌芽率,判定恢复生长情况。
1.2.3电导率以及临界半致死温度的测定
将处理后的枝条(不含芽部位)剪成0.5 cm长的小段,称2 g放入三角瓶中,加20 mL去离子水,在室温下浸泡12 h后待测。电解质渗出率采用DDS-ⅡA型电导率仪进行测定,用去离子水归零。测定待测液的初电导率C1,再用水浴锅将水烧开后把待测枝条放入蒸30 min后杀死全部组织,冷却2 h后测终电导率C2。
根据初电导率(C1)和终电导率(C2),求出电解质渗出率 y(y(%)=C1/C2×100%)并对其进行回归分析,将温度 (t)和电解质渗出率 (y)间的关系用Logistic方程 y=k/(1+ae-bx)进行拟合,回归模型为:
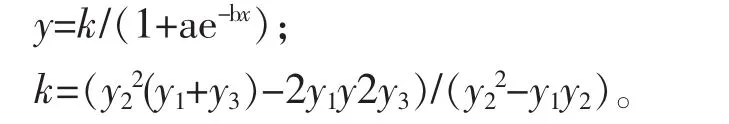
上式中,x代表的温度梯度,若拟合度(r)显著,再计算L临界半致死温度 (以电解质渗出率40%相对应的温度为苹果枝条组织的半致死温度)[11],以上测定每处理重复3次。
1.2.4生理指标的测定
采用U3900型分光光度计对游离脯氨酸、可溶性蛋白含量及丙二醛活性等指标进行测定。每个指标取3根枝条,用去离子水冲洗干净,避开芽眼,剪成3~5 mm的薄片,混合均匀,称取0.5 g,对其充分研磨。
游离脯氨酸量的测定采用茚三酮法,丙二醛含量的测定采用硫代巴比妥酸(TBA)法方法,可溶性蛋白使用考马斯亮蓝G-250染色法。每个品种的测定重复3次。
1.2.5分析方法
运用SPSS17.0软件进行相同温度下不同指标差异显著性分析,不同生理指标之间的相关性分析,依据相对电导率变化用SPSS17.0软件计算半致死温度。
2 结果与分析
2.1 不同低温处理后苹果枝条萌芽率的变化
如表2所示,在4℃条件下8个苹果品种的萌芽率为67.5%~92.5%,国光、贝当、甜格力萌芽率显著最高为92.5%。
不同低温处理后苹果品种萌芽率较4℃显著降低;在-15℃条件下8个苹果品种的萌芽率为55%~87.5%,寒富萌芽率显著最高为87.5%;在-20℃条件下8个苹果品种的萌芽率为50.5%~67.5%,寒富萌芽率显著最高为67.5%;在-25℃条件下8个苹果品种的萌芽率为42.5%~65%;在-30℃低温处理后苹果枝条的萌芽率差异不显著;在-35℃低温处理后8个苹果枝条萌芽率显著较低,国光萌芽率相对较高为45.5%。
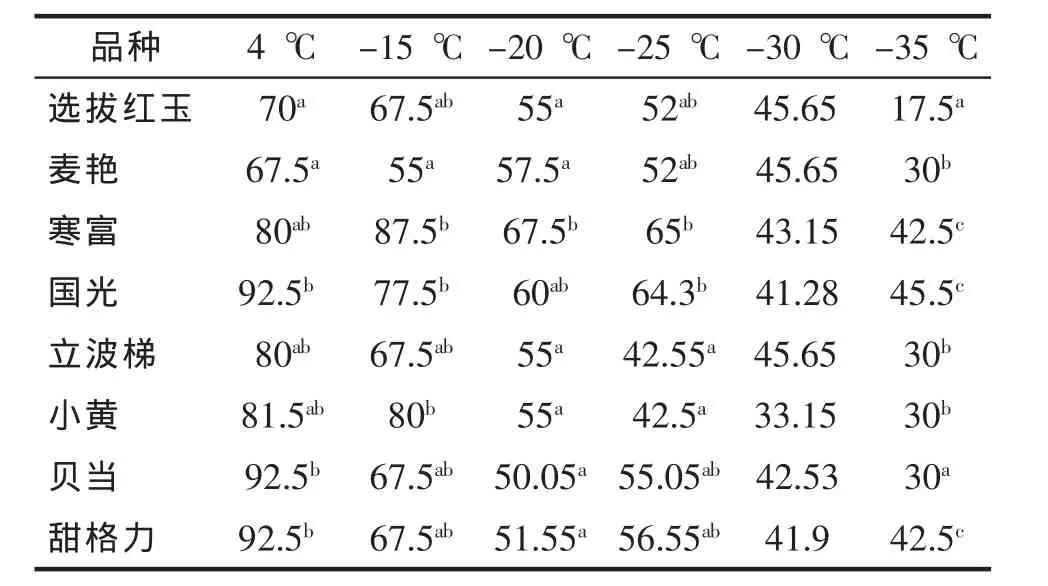
表2 不同低温处理后苹果品种枝条萌芽率比较(%)Tab.2 Effect of low-temperature stress on germination rate in apple branches(%)
2.2 不同低温处理后苹果枝条相对电导率的变化
如表3所示,在4℃条件下8个苹果品种的相对电导率为19.88%~25.69%,不同低温处理处理后苹果品种相对电导率较4℃显著升高;在-15℃条件下8个苹果品种的相对电导率为30.65%~43.75%,麦艳、甜格力的对电导率均著较低分别9.88%、20.3%;在-20℃低温处理下8个苹果品种的相对电导率为35.16%~46.67%,寒富、甜格力的对电导率均著较低分别为35.16%~37.69%;在-25℃低温处理后苹果枝条的相对电导率差异不显著;在-30℃低温处理下8个苹果品种的相对电导率为58.6%~65.48%;在-35℃条件下8个苹果枝条相对电导率显著较高均超过60%。依据相对电导率的变化,用Logistic方程拟合,8个苹果品种的拟合度(r)均达显著水平。如表2所示,8个品种半致死温度范围为-16.17~-21.097℃,寒富、甜格力品种的半致死温度均低于-20℃。
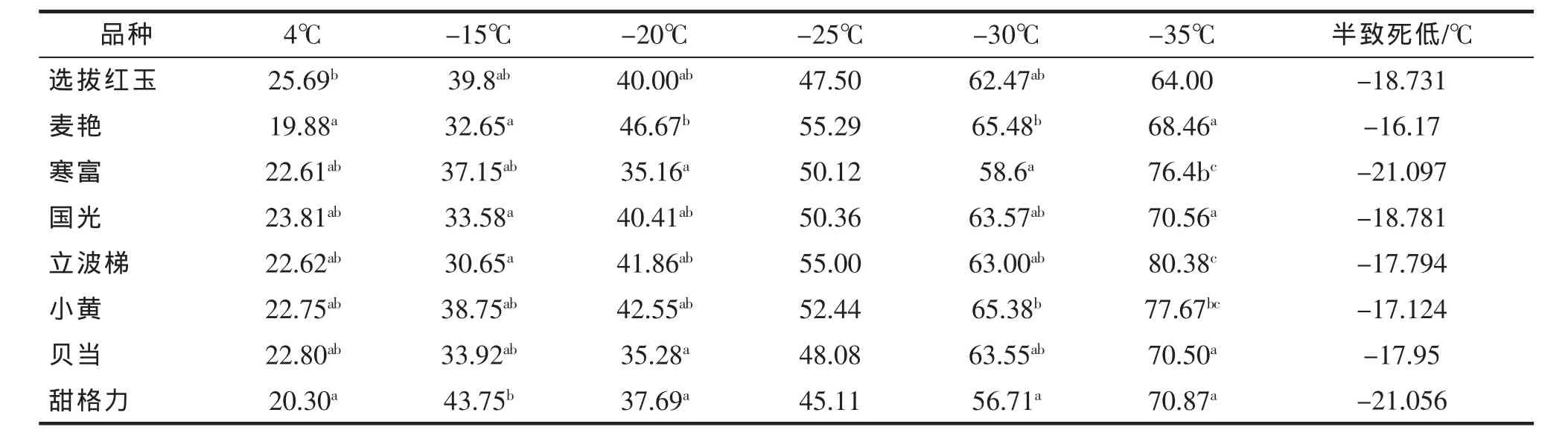
表3 不同低温处理后苹果品种枝条相对电导率(%)Tab.3 The dynamics of relative conductivity of apple branches treated by different low temperature(%)
2.3 不同低温处理后苹果枝条丙二醛含量的变化
如表4所示,在4℃条件下8个苹果品种的丙二醛为 3.235~1.221 μg/g,国光显著最低为 1.221 μg/g;不同低温处理处理后苹果品种丙二醛较4℃显著升高,总体呈“S”型升高趋势趋势;在-15℃条件下8个苹果品种的丙二醛为1.859~15.52 μg/g,国光显著最低为 1.859 μg/g;在-20 ℃低温处理后8个苹果品种的丙二醛为5.196~12.864 μg/g国光显著最低为5.196 μg/g;在-25℃低温处理后8个苹果品种的丙二醛为 3.623~16.316 μg/g,甜格力显著最低为3.623 μg/g;在-30℃低温处理后苹果枝条的丙二醛差异不显著;在-35℃条件下8个苹果枝条丙二醛含量均显著较高,贝当丙二醛相对较低为 42.453 μg/g。
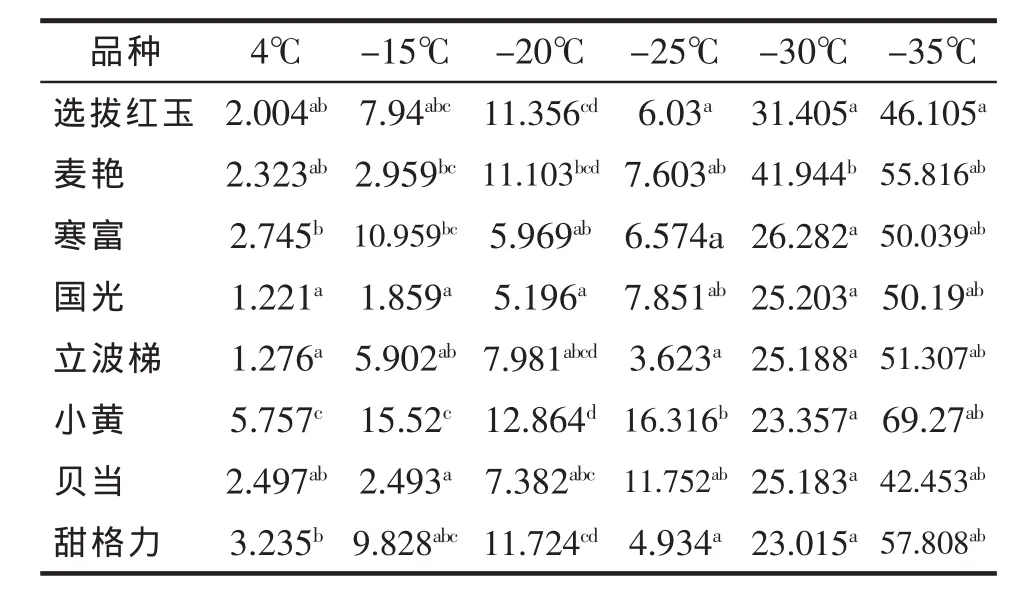
表4 不同低温处理后苹果品种枝条丙二醛含量的测定(μg/g)Tab.4 The dynamics of aldehyde of apple branches treated by different low temperature(μg/g)
2.3 不同低温处理后苹果枝条脯氨酸含量的变化
如表5所示,在4℃条件下8个苹果品种的脯氨酸为 3.547~29.054 μg/g,寒富显著最高为 29.054 μg/g,不同低温处理处理后苹果品种脯氨酸较4℃显著升高,总体呈“S”型升高趋势趋势;在-15℃条件下8个苹果品种的脯氨酸为4.22~34.944 μg/g,国光显著最高为34.944 μg/g;在-20℃低温处理处理后8个苹果品种的脯氨酸为8.032~24.435 μg/g,立波梯显著最高为24.435 μg/g;在-25℃低温处理处理后8个苹果品种的脯氨酸为7.268~23.156 μg/g,寒富显著最高24.435 μg/g;在-30℃低温处理后苹果枝条的脯氨酸差异不显著;在-35℃低温处理处理后8个苹果枝条脯氨酸显著较低,小黄脯氨酸相对较高为48.174 μg/g。

表5 不同低温处理后苹果品种枝条脯氨酸含量的测定(μg/g)Tab.5 Effect of low-temperature on relative conductivity in apple branches(μg/g)
2.4 不同低温处理后苹果枝条可溶性蛋白含量的变化
如表6所示,在4℃条件下8个苹果品种的可溶性蛋白含量差异不显著,经过不同低温处理处理后苹果品种可溶性蛋白含量较4℃显著升高,总体呈“S”型升高趋势趋势;在-15℃条件下8个苹果品种的可溶性蛋白为0.337~0.651 μg/g,寒富可溶性蛋白含量显著最高为0.651 μg/g;在-20℃条件下8个苹果品种的可溶性蛋白为0.181~0.588 μg/g,立波梯可溶性蛋白含量显著最高为0.588 μg/g;在-25℃条件下8个苹果品种的可溶性蛋白为0.245~0.929 μg/g,寒富可溶性蛋白含量显著最高为0.929 μg/g;在-30和35℃低温处理后苹果枝条的可溶性蛋白差异不显著。
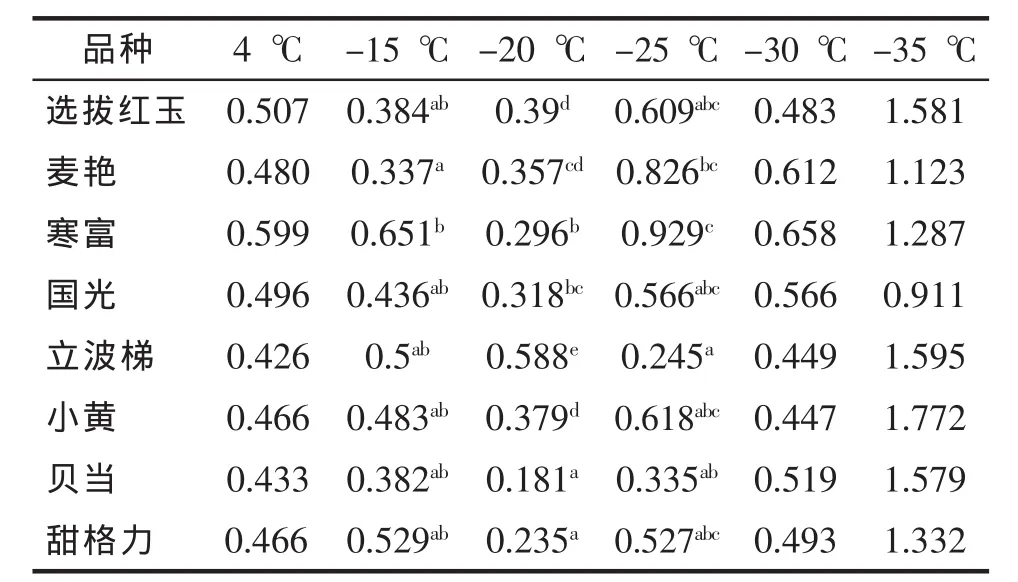
表6 不同低温处理后苹果品种枝条可溶性蛋白含量的测定(μg/g)Tab.6 Effect of low-temperature on soluble protein contents in apple branches(μg/g)
2.6 不同生理指标与相对电导率的相关性分析
如表7所示,利用SPSS17.0软件对8个品种不同低温诱导下的丙二醛、脯氨酸含量、可溶性蛋白与相对电导率的相关性分析。结果表明,丙二醛与相对电导率呈显著正相关,相关系数为0.465;脯氨酸含量与相对电导率呈显著负相关,相关系数为-0.438;可溶性蛋白与相对电导率呈极显著负相关,相关系数为-0.654。
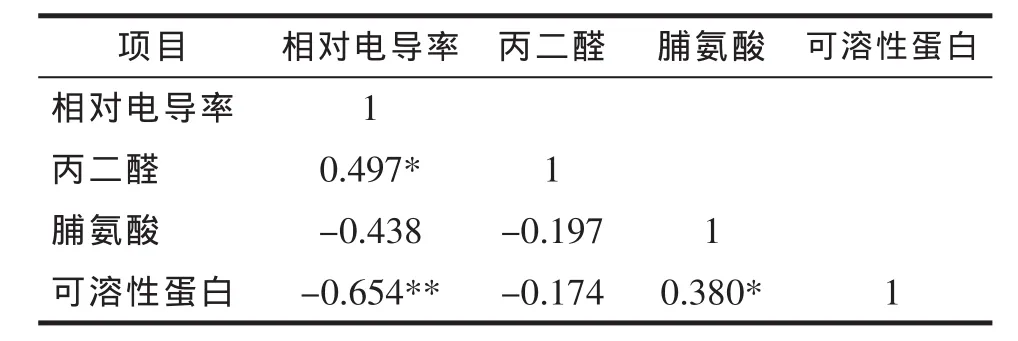
表7 3个指标与相对电导率的相关性分析Tab.7 Correlation analysis between three indexes and relative conductivity
3 讨论
张钊等[22]认为枝条萌芽率是反映植物低温胁迫下的1个重要的直观指标,通过模拟低温环境下对苹果1年生枝条低温胁迫后萌芽率的检测,可以直观的检测出苹果枝条低温胁迫后芽的萌发能力,本试验结果表明,在-20℃低温处理后枝条的萌芽率均超过50%,在-25℃低温处理后立波梯、小黄枝条的萌芽率低于50%,其他的苹果品种均高于50%。通过不同低温胁迫后寒富、国光苹果枝条的萌芽率相对较高。
相对电导率是反映植物膜系统状况的一个重要的生理指标,植物在受到低温胁迫的情况下对植物体的细胞膜结构造成损伤,从而细胞膜容易破裂,膜蛋白受伤害因而使胞质的胞液外渗而使相对电导率增大[9-10],本试验通过相对电导率的检测并计算临界半致死温度 (LT40),寒富的半致死温度为-21.097℃,刘国成等对‘寒富’苹果抗寒性的研究表明其花芽的半致死温度为-32℃左右,本试验进行的部位是去皮后进行研磨,测定。通过潘俨等[23]研究果树鉴定后1年生组织抗寒能力的顺序为:表皮>皮层韧皮部木质部>形成层>木质部>髓部。本研究中除去表皮后进行枝条的研磨后经试验处理后测定各项指标,所以苹果品种枝条的抗寒能力是低于花芽的半致死温度的。
植物器官衰老或在逆境条件下往往发生膜脂过氧化作用,其产物丙二醛会严重损害生物膜,通常利用它作膜脂过氧化指标,表示细胞膜脂过氧化程度及对逆境的强弱,丙二醛含量高说明植物抗寒性弱,反之,则抗寒性强[14-15],本实验结果表明丙二醛含量与相对电导率呈显著负相关。
植物在受到低温逆境胁迫时,游离脯氨酸便会大量积累,以适应细胞内外渗透压的变化,且积累指数与植物的抗逆性有关[19]。关于游离脯氨酸含量与抗寒性的关系已有许多报道,但观点尚不统一,本实验结果表明苹果枝条游离脯氨酸含量与相对电导率呈显著负相关,且随环境温度下降而升高与潘俨等[23]试验结果一致。
可溶性蛋白质的亲水性较强,能增加细胞的保水能力,从而提高植物的抗寒性,本试验结果显示可溶性蛋白含量与相对电导率呈极显著负相关,研究结果与在梨[13]上的一致。
4 结论
本研究通过进行低温诱导,测定8个苹果的萌芽率、相对电导率及其logistic曲线计算临界半致死温度、脯氨酸含量、可溶性蛋白含量、丙二醛含量,研究结果表明:苹果枝条经过低温胁迫后,寒富、国光、甜格力在石河子地区抗寒能力较好,可以引入新疆北疆地区进行大面积推广种植。
[1]俞德浚.中国果树分类学[M].北京:中国农业出版社,1979.
[2]李育农.苹果属植物种质资源研究[M].北京:中国农业出版社,2001.
[3]李淑玲,冯建荣,李亚兰,等.引入石河子地区的苹果品种抗寒性检测[J].果树学报,2012,29(6):1010-1016.
[4]翟衡,史大川,束怀瑞.我国苹果产业发展现状与趋势[J].果树学报,2007,24(3):355-360.
[5]陈学森,沈洪波,张艳敏.杏及大樱桃花器官冻害调查[J].园艺学报,2001,28(4):373.
[6]韩浩章.苏南地区主要落叶果树的需冷量及休眠解除生理机制的研究[D].南京农业大学,2004:6.
[7]Lyons JM.Chilling Injury in Plants[J].Annual Review of Plant Physiology,1973,24:445-446.
[8]张钊,吴经柔,徐熹楼.新疆北部苹果幼树越冬观察[J].新疆农业科学,1961(4):121-124.
[9]梅立新,蒋宝,赵政阳,等.几种方法测定苹果矮化砧木枝条抗寒性指标的比较[J].西北农业学报,2008,17(6):103-106.
[9]Lyons J M,Raison J K.Oxidative activity mitochondria isolated from Plant tissued sensitive and resistant to chilling injury[J].Plant Physiology,1970,45:386.
[10]Lu S L,Mark R.Cold acclimation of young kiwifruit vine under artificial hardening conditions[J].Hort Science,1990,25(12):1628-1630.
[11]朱根海,刘祖祺,朱培仁.应用Logistic方程确定植物组织低温半致死温度的研究[J].南京农业大学学报,1986(3):11-16.
[12]万清林.草莓抗寒特性分析.北方园艺[J].1990(8):4-7.
[13]岳英,鲁晓燕,杨小娟,等.梨抗寒性生理指标的筛选[J].石河子大学学报:自然科学版,2011,29(5):551-554.
[14]高志红,章镇,韩振海.果梅种质枝条抗寒性鉴定[J].果树学报,2005,22(6):709-711.
[15]汤照云,吕明,张霞,等.高温胁迫对葡萄叶片三项生理指标的影响[J].石河子大学学报:自然科学版,2006,24(2):198-200
[16]王华,王飞.低温胁迫对杏花SOD活性和膜脂过氧化的影响[J].果树科学,2000,17(3):197-201.
[17]和红云,薛琳,田丽萍,等.低温胁迫对甜瓜幼苗根系活力及渗透调节物质的影响[J].石河子大学学报:自然科学版,2008,26(5):583-586.
[18]王宇霖.苹果栽培学[M].北京:科学出版社,2011.
[19]宋烨,翟衡,姚玉新,等.引进苹果加工品种的生物学特性及利用[J].山东农业科学,2008(5):104-107.
[20]张军,杨敏生,张钢,等.新疆野苹果天然群体抗寒性的电阻抗图谱分析[J].林业科学,2011,47(4):20-25.
[21]陈云华,刘刚,尚振江,等.伊犁河谷苹果冻害调查分析[J].新疆农业大学学报,2009,32(5):63-67.
[22]张钊,吴经柔,徐熹楼.新疆北部苹果幼树越冬观察[J].新疆农业科学,1961(4):122-123.
[23]潘俨,车凤斌,郑素慧,等.温185核桃一年生枝条的抗寒力测定分析[J].新疆农业科学,2012,49(3):454-460.

