氯化钴预处理对大鼠脂肪干细胞成脂及增殖的影响
黄佳诚, 柳大烈, 黄子龙, 南 华
实验研究
氯化钴预处理对大鼠脂肪干细胞成脂及增殖的影响
黄佳诚, 柳大烈, 黄子龙, 南 华
目的观察脂肪来源间充质干细胞(ADSCs)在经氯化钴(CoCl2)预处理的条件下,其增殖、细胞状态变化以及成脂肪化倾向。方法通过有限稀释法分离、培养SD大鼠ADSCs,取第3代ADSCs,分别向骨细胞、脂肪细胞定向诱导分化鉴定,利用流式细胞仪检测大鼠ADSCs细胞表面标志物CD29,CD34,CD44,CD45的表达。将ADSCs经不同浓度CoCl2干预,利用Western blot检测缺氧诱导因子1α(HIF-1α)的表达情况。同时,利用MTT实验来检测大鼠ADSCs在不同浓度的CoCl2下细胞增殖的改变;并且通过油红O定量检测大鼠ADSCs在经历缺氧后的成脂情况。结果第3代ADSCs在倒置显微镜下观察,大多呈梭形,经流式鉴定,大鼠ADSCs细胞表面标志物CD29、CD44表达率高,而CD34、CD45表达率低,体外诱导培养的大鼠ADSCs能够向成骨细胞和成脂细胞分化,具有较高的自我更新能力。在MTT实验中,400、200 μmol/L CoCl2组,ADSCs增值减弱;而100、50 μmol/L CoCl2的实验组,缺氧造成的对细胞增殖和细胞毒性与空白对照组相比,没有变化(P>0.05)。HIF-1α的表达随着培养基中的CoCl2的浓度而增加。在光镜下观察发现,随着CoCl2浓度的升高以及时间的延长,大鼠ADSCs的成脂倾向越发明显(P<0.001)。结论ADSCs在处于体外适量的CoCl2干预情况时,其增殖并不会受到影响,并且呈显著的增强其成脂倾向。
脂肪来源干细胞; 氯化钴; 成脂分化
自体脂肪组织抽吸注射移植术是常见的整形手术,有关提高脂肪成活率的研究一直是脂肪移植术中的重点。有学者提出脂肪移植术后脂肪吸收率较高的原因可能是由于脂肪组织移植后,脂肪细胞处于一个相对局部缺氧的环境从而导致其坏死、液化[1]。一些研究表明,在移植的脂肪组织中加入事先培养好的脂肪来源干细胞(adipose-derived stem cells, ADSCs)可以达到更好的临床效果[1-2]。氯化钴(CoCl2)是一种成熟的缺氧模型制造剂,已被广泛用于制作体外和体内细胞缺氧的环境[3-6]。自2013年2-8月,我们通过ADSCs经由一个梯度的CoCl2的浓度体外培养,检测ADSCs在该环境下培养时缺氧诱导因子-1α(hypoxiainducible factor-1α,HIF-1α)的表达,并通过MTT实验及油红O染色定量检测,观察随着缺氧程度及缺氧时间的改变,脂肪干细胞增殖能力及成脂趋势的变化。
1 材料与方法
1.1 主要试剂与仪器
SD成年大鼠(南方医科大学实验动物中心提供);Ⅰ型胶原酶、地塞米松、胰岛素、β-甘油磷酸钠、维生素C、1- 甲基-3- 异丙基黄嘌呤、吲哚美辛、DMEM-F12、胎牛血清(FBS)、细胞表面抗原检测用试剂鼠抗人CD29-PE、CD34-FITC、CD44-FITC、CD45-FITC(美国BIOLEGEND公司);兔抗鼠单克隆抗体HIF-1α(美国SANTA CRUX公司);CoCl2(美国SIGMA公司);Olympus倒置显微镜, HERUS CO2培养孵箱, 超净工作台,低温离心机, BD FACS Calibur 流式细胞仪。
1.2 实验方法
1.2.1 大鼠ADSCs的获取 无菌条件取大鼠腹股沟脂肪垫, 用PBS冲洗,超净台内切碎后用加入0.1%Ⅰ型胶原酶吸管反复吹打,37 ℃孵育45 min, 加入基础培养基终止消化, 离心, 重悬细胞, 150目筛网过滤;再次离心后,重悬细胞,并将细胞悬液移入培养瓶中, 置37 ℃、5%CO2条件下静置培养。24 h后即可见到有少量细胞贴壁;48 h后换液, 5~7 d 细胞长满瓶底后胰酶消化,扩大培养。
1.2.2 ADSCs的流式细胞仪鉴定 取培养至3代的细胞,PBS洗1遍,计数,1×106/管分装5管,抗体用0.1%BSA稀释,100 μl/管,抗体室温避光孵育1 h。流式细胞仪检测ADSCs表面抗原的表达。
1.2.3 ADSCs多向分化能力的检测 选取第3 代ADSCs 接种到6孔板, 每皿5×104/ml细胞, 在37℃、5%CO2条培养24 h后,分别加入成骨诱导剂(0.1 μmol/L地塞米松、50 mg/L维生素C、10 mmol/L β-磷酸甘油钠)或成脂诱导剂(0.25 μmol/L地塞米松、50 μmol/L吲哚美辛、0.5 mmol/L IBMX、10 mg/L牛胰岛素),对照组为单纯含10%FBS的培养基。每3 d换液,分别于7 d和28 d后,用茜素红钙盐染色法及油红O染色法来测定ADSCs的多向分化能力。
1.2.4 MTT检测不同浓度的CoCl2对细胞增殖的影响 选取第3代ADSCs接种到96孔板,每孔2000个细胞,在37 ℃、5%CO2条培养24 h后,分别加入CoCl2使得每个孔中CoCl2的浓度分别为0、50、100、200、400 μmol/L,并设置校零孔。然后分别在加药6、24、48、72 h后加入20 μl的MTT试剂,然后通过酶标仪测得其在490 nm下的OD值。
1.2.5 Western blot检测不同组中HIF-1α蛋白表达
提取各组中的ADSCs蛋白,定量后添加SDS-PAGE上样缓冲液煮沸7 min,每组上样20 μg,经10%SDS-PAGE凝胶电泳,湿转法将蛋白转移至PVDF膜,5%的脱脂奶4 ℃封闭2 h,兔抗鼠HIF-1α(1∶1000) 4 ℃过夜,羊抗兔近红外二抗4 ℃避光封闭2 h,Odyssey近红外成像系统中扫描、分析。
1.2.6 选取第3 代ADSCs 接种到6孔板, 每皿5×104/ml细胞, 在37 ℃、5%CO2条件培养24 h后,加入CoCl2使其浓度分别为100、50、0 μmol/L。3 d换液1次,保留其药物浓度,每天在显微镜下观察,并于7、14 d后用油红O染色后,加入异丙醇溶液500 μl/孔,震荡脱色10 min,使细胞内染色甘油三酯充分溶解,酶标仪540 nm处测光吸收值[7]。
1.3 统计学方法
2 结果
2.1 大鼠ADSCs的原代培养与形态学观察
原代ADSCs培养48 h换液后,即可观察到贴壁细胞,细胞形态短小,呈长梭形(图1a)。培养至4 d,细胞明显增多、变大,长梭形、纺锤形形态更加明显(图1b)。在传代培养中,细胞基本保持长梭形的形态(图1c)。
2.2 ADSCs分化能力鉴定
成骨诱导7 d后,油红O染色可见细胞内有鲜红色透亮脂滴形成(图2a)。成骨诱导后茜素红染色均阳性,表明诱导后脂肪干细胞外基质中有钙结节形成(图2b)。
2.3 大鼠ADSCs的流式细胞仪鉴定
流式细胞仪检测发现,ADSCs阳性表达间充质细胞表面标志CD29、CD44,阳性率均为90%以上,低表达造血干细胞表面标志CD34、CD45(图2c),表明取得的ADSCs纯度较高。
2.4 不同浓度的CoCl2对ADSCs增殖的影响
MTT检测发现,加入200、400 μmol/L的CoCl2相比空白对照组,ADSCs的增殖能力受很大抑制(P<0.05);而100 μmol/L和50 μmol/L组ADSCs的增殖能力并未产生明显影响(P>0.05,图3)。
2.5 不同浓度的CoCl2对ADSCs的HIF-1α表达的影响
Western blot检测结果显示,HIF-1α蛋白在50 μmol/L和100 μmol/L组中的细胞均有表达,且均高于对照组的表达量(图4)。
2.6 不同浓度的CoCl2培养液对ADSCs成脂的影响
观察各组细胞在倒置显微镜下的形态发现,相比对照组,CoCl2组呈较多脂滴(图5)。在对照组中,通过油红O染色后定量测量发现,相比对照组,加入CoCl2组中的ADSCs的成脂肪趋势更加明显(P<0.001,表1)。
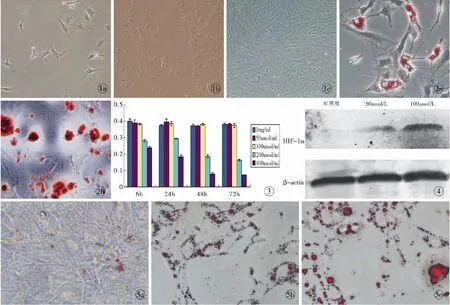
图1 ADSCs的形态 a. 原代ADSC培养2 d后(×200) b. P1代ADSCs 培养4 d后(×100) c. P3代ADSCs培养4 d后(×100)图2 脂肪干细胞的分化能力 a. ADSCs成脂诱导7 d后油红O染色 (×400) b. ADSCs成骨诱导28 d后茜素红染色(×200)图3 MTT实验检测处于不同浓度的CoCl2后,不同时间ADSCs增殖能力的变化图4 Western blotting检测各组标本中HIF-1α的表达图5 培养14 d后,观察光镜下各组油红O染色结果 a.对照组(×200) b.50 μmol/L组(×200)c.100 μmol/L组(×200)
Fig1 ADSCs under the inverted microscope. a. original ADSCs at 2 days after culture (×200). b. P1 ADSCs at 4 days after culture (×100). c. P3 ADSCs at 4 days after culture (×100).Fig2 ADSCs differentiation a. ADSCs of adipogenic differentiation at 7 days by Oil red staining (×400). b. ADSCs of osteogenic differentiation at 7 days by Alizarin red staining (×200) .Fig3 The proliferation activity levels of ADSCs at different CoCl2concentration in each group.Fig4 The protein levels of HIF-1α in each groups.Fig5 ADSCs at 14 days after culture by Oil red staining in each groups. a. control group(×200). b. 50 μmol/L group(×200).c. 100 μmol/L group(×200).
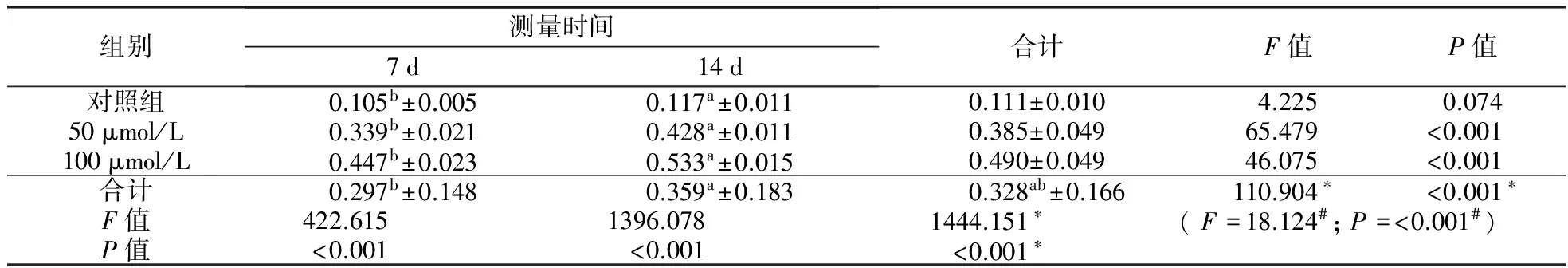
表1 不同浓度的CoCl2对ADSCs的成脂分化的影响Tab1 Effect of CoCl2 at different concentrations on ADSCs adipogenic differentiation n=5
注:*主效应的F统计量和P值;#交互效应的F统计量和P值
3 讨论
脂肪干细胞因具有易获得性及不涉及伦理问题等优点而成为理想的种子细胞来源[8-9]。在临床中已有实验证实,将脂肪干细胞混入需要移植的脂肪细胞后,能较单一的脂肪细胞注射达到更好疗效[10]。从而提示我们需要探求脂肪干细胞在这样一个相对缺氧环境中,它的增殖是否受到影响以及在这种情况下转归如何。
目前,国内外一些研究表明,将用于治疗的间充质干细胞事先经过一定程度的预缺氧,可以得到更好的治疗效果,并提出这可能是由于细胞内的HIF-1的调节[11-13]。HIF-1分为HIF-1α和HIF-1β的形式存在,其中HIF-1α属于功能性亚基,HIF-1β属于结构性亚基,HIF-1α亚基的表达活性决定了HIF-1的生理活性,因此,HIF-1α在调控组织中氧代谢的适应反应中起重要作用。目前,已经明确的受缺氧诱导因子1调控的靶基因有100多个[2,14]。研究表明,这些靶基因影响着干细胞的增殖、分化、迁移等[15-18]。本研究发现,ADSCs在50 μmol/L和100 μmol/L的CoCl2的缺氧环境下,HIF-1α蛋白的表达均高于不缺氧组,即在该浓度的缺氧环境下,可以诱导HIF-1α蛋白的表达。
CoCl2是一种成熟的缺氧模型介导试剂,已被广泛应用在体外和体内激活HiF-α[3-6]。所以,有必要探求脂肪干细胞在增殖及转归过程中是否受到CoCl2浓度的影响,于是我们通过让ADSCs处于含有梯度CoCl2浓度的培养环境,采用MTT检测他们的增殖率。我们可以发现,脂肪干细胞只有在处于200、400 μmol/L这样的培养环境,才会出现增值减弱和死亡的现象。低浓度CoCl2的培养环境并不会对ADSCs的增值产生影响。而且,通过Western blotting我们证明了CoCl2能使HIF-1α的表达随着其浓度的升高而上升。ADSCs具有稳定扩增的特性,在正常体外环境培养时,并不会表现出特定的分化倾向。我们的研究表明,ADSCs在CoCl2环境下培养时,随着浓度的提高,脂肪干细胞的成脂倾向越发明显。我们使用了经过MTT试验得出的对ADSCs增殖没有影响的0、50、100 μmol/L这3个组,在没有加入成脂诱导剂量的情况下,在50 μmol/L组中我们可以观察到脂肪干细胞发生了明显的自体成脂倾向,而对照组中则没有改变,同时随着CoCl2的浓度的上升,100 μmol/L脂肪干细胞的成脂趋势会显得更快更加明显。这提示我们在进行含有脂肪干细胞的脂肪移植术中,移植的脂肪干细胞由于处于一定的缺氧环境,脂肪干细胞可能会具有一种成脂分化的趋势,并且它的增殖并没有受到影响。这也可能是由于缺氧诱导因子HiF-α调控靶基的结果,从而使脂肪干细胞能够快速增殖并分化为成熟的脂肪细胞,并使术后效果较单一的脂肪移植术好。因此,在进行含有脂肪干细胞的脂肪移植术时,事先将脂肪干细胞进行一定的预缺氧处理可能会取得更好的临床疗效。
本实验通过体外实验比较了不同浓度的CoCl2对ADCSs增殖及分化的影响,由此显示,适当的CoCl2培养环境会刺激脂肪干细胞的成脂分化能力并且不影响其增殖。但是,究竟通过哪些信号通路并且通过什么样的方式调整还有待于进一步地研究。
[1] 付冰川, 高建华, 鲁 峰, 等. 新鲜分离的脂肪SVF细胞促进脂肪移植存活的实验研究[J]. 中华整形外科杂志, 2010,26(4):289-294.
[2] Schumacker PT. Hypoxia inducible factor 1(HIF-1)[J]. Crit Care Med, 2005,33(12 Suppl):S423-S425.
[3] Pacary E, Legros H, Valable S, et al. Synergistic effects of CoCl(2) and ROCK inhibition on mesenchymal stem cell differentiation into neuron-like cells[J]. J Cell Sci, 2006,119 (Pt 13):2667-2678.
[4] Kim KS, Rajagopal V, Gonsalves C, et al. A novel role of hypoxia-inducible factor in cobalt chloride-and hypoxia-mediated expression of IL-8 chemokine in human endothelial cells[J]. J Immunol, 2006,177(10):7211-7224.
[5] Tanaka T, Kojima I, Ohse T, et al. Cobalt promotes angiogenesis via hypoxia-inducible factor and protects tubulointerstitium in the remnant kidney model[J]. Lab Invest, 2005,85(10):1292-1307.
[6] Song YR, You SJ, Lee YM, et al. Activation of hypoxia-inducible factor attenuates renal injury in rat remnant kidney[J]. Nephrol Dial Transplant, 2010,25(1):77-85.
[7] Sen A, Lea-Currie YR, Sujkowaka D, et al. Adipogenic potential of human adipose derived stromal cells from multiple donors is heterogeneous[J]. J Cell Biochem, 2001,81(2):312-319.
[8] Sagrinati C, Ronconi E, Lazzeri E, et al. Stem-cell approaches for kidney repair: choosing the right cells[J]. Trends Mol Med, 2008,14(7):277-285.
[9] Le Blanc K. Immunomodulatory effects of fetal and adult mesenchymal stem cells[J]. Cytotherapy, 2003,5(6):485-489.
[10] 曹孟君, 钱奕炜, 宋富贵, 等. 自体脂肪干细胞辅助脂肪移植77例分析[J]. 中国美容整形外科杂志, 2012,23(6):335-338.
[11] Liu H, Liu S, Li Y, et al. The role of SDF-1-CXCR4/CXCR7 axis in the therapeutic effects of hypoxia-preconditioned mesenchymal stem cells for renal ischemia/reperfusion injury[J]. PLoS One, 2012,7(4):e34608.
[12] Yamamoto Y, Fujita M, Tanaka Y, et al. Low oxygen tension enhances proliferation and maintains stemness of adipose tissue-derived stromal cells[J]. Biores Open Access, 2013,2(3):199-205.
[13] Yu X, Lu C, Liu H, et al. Hypoxic preconditioning with cobalt of bone marrow mesenchymal stem cells improves cell migration and enhances therapy for treatment of ischemic acute kidney inju-ry[J]. PLoS One, 2013,8(5):e62703.
[14] Adams JM, Difazio LT, Rolandelli RH, et al. HIF-1: a key mediator in hypoxia[J]. Acta Physiol Hung, 2009,96(1):19-28.
[15] Wang Y, Tang Z, Xue R, et al. Differential response to CoCl2-stimulated hypoxia on HIF-1α, VEGF, and MMP-2 expression in ligament cells[J]. Mol Cell Biochem, 2012,360(1-2):235-242.
[16] Dong N, Qin W, Xue Y, et al. Hypoxia affects in vitro proliferation and differentiation of mouse corneal epithelial progenitor cell[J]. In Vitro Cell Dev Biol Anim, 2013,49(7):508-514.
[17] Przybyt E, Krenning G, Brinker MG, et al. Adipose stromal cells primed with hypoxia and inflammation enhance cardiomyocyte proliferation rate in vitro through STAT3 and Erk1/2[J]. J Transl Med, 2013,11:39.
[18] Ratajczak MZ, Zuba-Surma E, Kucia M, et al. The pleiotropic effects of the SDF-1-CXCR4 axis in organogenesis, regeneration and tumorigenesis[J]. Leukemia, 2006,20(11):1915-1924.
Effectofcobaltchloridepreprocessingontheproliferationandadipogenicdifferentiationofratadipose-derivedstemcells
HUANGJia-cheng,LIUDa-lie,HUANGZi-long,etal.
(DepartmentofPlasticandCosmeticSurgery,ZhuJiangHospital,SouthernMedicalUniversity,Guangzhou510282,China)
ObjectiveTo observe the effect of cobalt chloride(Cocl2) preprocessing on the proliferation and adipogenic differentiation of rat adipose-derived stem cells(ADSCs).MethodsRat ADSCs were isolated from adipose tissue obtained from rat and were cultured, ADSCs at Passage 3 were cultured in adipogenic, osteogenetic differentiation medium and underwent identification, flow cytometric analysis for cell surface antigen CD29, CD34, CD44 and CD45 were performed. To confirm the effect of cobalt chloride preprocessing on adipogenic differentiation of ADSCs, CoCl2, a HIF stabilizer was used to mimic the hypoxic condition. The expression of HIF-1α were observed by Western blotting. Growth condition of the cells was observed by inverted microscope. MTT method was used to observe cell proliferation activity at different concentrations after hypoxic culture. The effects of hypoxic condition to ADSCs adipogenic differentiation was detected by Oil Red O quantitative assay.ResultsMost ADSCs at Passage 3 were spindle-shaped under the inverted microscope. Flow cytometric analysis showed CD29 and CD44 were positive; CD 34 and CD45 were negative. ADSCs were induced in vitro to osteoblasts and lipoblasts. MTT method revealed the Optical Density value of 100 and 50 μmol/L-1CoCl2and control group were no significant differences between each groups (P>0.05). HIF-1 alpha protein was increased with the CoCl2concentration increasing. At 7th and 14th days after hypoxia culture, Oil Red O quantitative assay showed hypoxia had a significant impact on ADSCs adipogenic capacity (P<0.001).ConclusionCobalt chloride preprocessing condition will enhance the adipogenic differentiation ability of ADSCs and proliferation activity will not be affected.
ADSCs; Cobalt chloride; Adipogenic differentiation
10.3969/j.issn.1673-7040.2014.04.016
R332
A
1673-7040(2014)04-0235-05
2013-11-18)
国家自然科学基金资助项目(81171831)
510282 广东 广州,南方医科大学珠江医院 整形美容外科
黄佳诚(1987-),男,江苏泰州人,硕士研究生.
柳大烈,510282,南方医科大学珠江医院 整形美容外科,电子信箱:liudalie@hotmail.com

