荜茇明碱对人乳腺癌MDA-MB-231细胞放射增敏作用
姚建新, 姚志峰, 李占峰, 刘永彪
荜茇明碱(piplartine)又称荜茇酰胺(piperlongumine),化学名为 5,6 二氢-1-[1-氧代-3-(3,4,5-三甲氧基苯基)-2-丙烯基]-2(1H)吡啶酮,具有诸如镇痛、镇静、抗炎、抗血小板凝集、抗真菌、抗血吸虫、抗焦虑以及抗抑郁等多种药理活性[1]。研究发现,荜茇明碱可显著抑制乳腺癌[2]、前列腺癌[3]、白血病细胞[4]等多种实体瘤和 血 液 系 统 肿 瘤的生长增殖,诱导肿瘤细胞的凋亡[4-5],并能干扰细胞周期进程[3,5],而肿瘤细胞的放射敏感性与细胞凋亡以及细胞在增殖周期各时相的分布密切相关。本研究选择三阴性乳腺癌MDA-MB-231细胞为研究对象,观察荜茇明碱对该细胞放射敏感性的影响并探讨可能机制,从而为今后临床能使用荜茇明碱作为放射增敏剂提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 人乳腺癌细胞株MDA-MB-231购自中国科学院上海细胞生物研究所细胞库。采用含10%胎牛血清的高糖DMEM完全培养液 (内含青-链霉素100 u/ml),置于含5%CO2、37℃恒温培养箱中培养,为单层贴壁生长。每2~3 d传代1次,取对数生长期细胞进行实验。
1.1.2 药物 荜茇明碱由华东师范大学余家会课题组合成,用二甲基亚砜(DMSO)配成5 mmol/L的储备液,过滤除菌,置于-20℃冰箱保存,使用时DMSO稀释至<0.1%。
1.1.3 试剂及仪器 高糖DMEM培养基、0.25%胰酶、磷酸盐缓冲液(PBS)、青-链霉素溶液为GIBCO公司产品;胎牛血清购于杭州四季青生物工程材料有限公司;DMSO、Annexin V-FITC/PI凋亡检测试剂盒为南京凯基公司产品;β-action抗体、Bax抗体、Bcl-2抗体均购自美国Santa Cruz公司;辣根过氧化酶标记二抗购自北京中杉金桥生物技术有限公司;活性氧试剂盒为碧云天生物工程公司产品;Giemsa染液为南京建成生物工程研究所产品。余为国产分析纯试剂。主要仪器有CO2培养箱(Heraeus公司)、流式细胞仪(FACScan,美国BD公司)和双光子型医用高能直线加速器(瑞典ELEKTA公司)。
1.2 方法
1.2.1 细胞照射 实验分为单独照射组和加药照射组,均采用6 MV X线进行不同剂量照射,剂量率为 300 cGy/min,源皮距(source skin distance,SSD)为100 cm,照射野为15 cm×15 cm,照射时机架角转至180°,培养皿下垫1.5 cm厚的组织补偿胶,单独照射组和联合处理组 (荜茇明碱联合照射组)的吸收剂量均为6 Gy。
1.2.2 克隆形成试验 观察荜茇明碱对MDA-MB-231细胞的放射增敏效应。取一定数量MDA-MB-231细胞置6 cm培养皿传代,待细胞生长面积30%~40%时用于下一步试验,每次试验均取对数生长期细胞,以0.25%胰酶消化、离心并制成单细胞悬液。设立 3 个药物浓度组(0、1、2.5 μmol/L),配置上述3种浓度的无血清培养液各100 ml,移走6 cm培养皿中的旧培养液;分为3个浓度组,每个培养皿加入5 ml培养液,放入培养箱中培养24 h;待荜茇明碱作用于细胞24 h后,平均分组照射0、2、4、6和8 Gy的剂量。照射结束后,立即行细胞播种,根据不同的照射剂量接种不同数量的细胞,即按照200,500,1 000,2 000,4 000 个细胞对应 0、2、4、6和8 Gy照射剂量进行接种,每个剂量点设3个平行样;各组细胞经上述处理后在37℃、含5%CO2培养箱静止培养14 d;当培养皿中出现肉眼可见的克隆时,终止培养弃去培养基,用PBS漂洗后,无水乙醇固定15 min,弃固定液后Giemsa染液染色20 min,流水冲去染液,空气干燥,显微镜下行克隆计数,计数≥50个细胞的克隆。试验重复3次。按下列公式计算克隆形成率 (planting efficiency,PE)和细胞存活分数(survival fraction,SF)。 PE(%)= 克隆数/细胞接种数 ×100%,SF=照射各剂量点PE/0 Gy PE×100%。为扣除荜茇明碱本身作用对试验结果的影响,本试验以单独加药组的SF为基准,对加药照射组的SF进行校正从而得到荜茇明碱的放射增敏作用。
按多靶单击模型SF=1-(1-e-D/D0)N使用SPSS 17.0中的非线性回归法拟合细胞存活曲线,计算单独照射组和加药照射组的D0和Dq值,并计算放射增敏比(SER)。SERD0=单独照射组D0/加药照射组D0;SERDq= 单独照射组 Dq/加药照射组 Dq;SERSF2=单独照射组SF2/加药照射组SF2。
1.2.3 FCM检测细胞凋亡 实验分组如下:①空白对照组,未作处理;② 单独加药组,加入1 μmol/L荜茇明碱;③ 单独照射组,照射剂量为6 Gy;④ 加药照射组,在相同剂量的照射前加入等体积的1 μmol/L荜茇明碱。将细胞接种于6孔板中,待细胞贴壁后进行上述处理后收集细胞,将细胞消化、悬浮,PBS洗涤离心,70%冷乙醇固定,-20℃保存过夜备用。重新收集细胞,取1×106个细胞,1 000 r/min,离心5 min,弃固定液,2 ml PBS悬浮细胞,400目筛网过滤 1 次,1 000 r/min,离心 5 min,弃去 PBS,经AnnexinV-FITC和PI双染色,室温避光染色30 min,FCM检测细胞凋亡率,数据获取用 CELLQuest软件,试验重复3次。
1.2.4 Western blot法检测凋亡相关蛋白的表达 实验分组如下:① 空白对照组,未作处理;② 单独加药组,加入浓度为2.5 μmol/L的荜茇明碱;③ 单独照射组,照射剂量为6 Gy;④ 加药照射组,在相同剂量的照射前加入等体积的2.5 μmol/L荜茇明碱。按上述分组处理后收集细胞,预冷的PBS洗2遍,离心。加适量预冷的细胞裂解液,置于冰上裂解30 min,12 000 r/min,4℃离心 20 min, 取上清液备用。按照Bradford蛋白浓度测定试剂盒测定蛋白,并调整各组蛋白质量浓度一致。蛋白提取物经定量后,各组取等量蛋白加入等量10%SDS-PAGE上样缓冲液,并置95~100℃水中变性5 min,行SDSPAGE垂直电泳,电转PVDF膜,丽春红染色观察转膜情况。加5%脱脂奶粉于4℃冷库封闭过夜,TBST洗膜1.5 h后加一抗Bcl-2,Bax鼠抗人单克隆抗体,内参照β-actin羊抗鼠单克隆抗体 (均为1∶1 000稀释),过夜孵育(37℃孵育),TBST洗膜1.5 h后加辣根过氧化物酶(HRP)标记羊抗鼠IgG二抗,37℃孵育1 h,TBST洗膜 40 min后,ECL试剂显色、曝光,并翻拍成照片。
1.2.5 FCM检测细胞活性氧水平 2′,7′-二氯荧光黄 双 乙 酸 盐 (2′,7′-dichlorofluorescin diacetate,DCFH-DA)是非标记性的氧化敏感的荧光探针,可了解细胞内活性氧的水平。将对数生长期细胞接种于6孔培养板,生长至90%融合时,按1.2.3要求进行分组处理后吸出6孔板中的培养液,用PBS洗涤3次,收集1×106个经上述处理的细胞,用无血清培养基清洗3次。将上述细胞重悬于DCFH-DA(终浓度为 10 μmol/L)1 ml探针中,37℃避光孵育20 min后吸去染液,用不含EDTA的胰酶消化,PBS洗涤3次,300网过滤后,上FCM测定细胞内DCF的荧光强度,以488 nm为激发波长,525 nm为发射波长。以上试验重复3次。
1.3 统计学方法
采用SPSS17.0统计软件包对试验数据进行t检验和单因素方差分析,所有数据均以s表示,检验水准α=0.05。
2 结果
2.1 细胞存活分数
按实验分组要求处理各组细胞,扣除药物本身作用对试验结果的影响,相同照射剂量的加药照射组SF均比单独照射组低,两组的SF差异有统计学意义(P<0.05)。根据多靶单击模型拟合的细胞存活曲线见图1,表1示随着荜茇明碱浓度增加,D0、Dq和SF2均逐渐减小。

图1 不同浓度荜茇明碱联合X射线照射后多靶单击模型拟合的细胞存活曲线
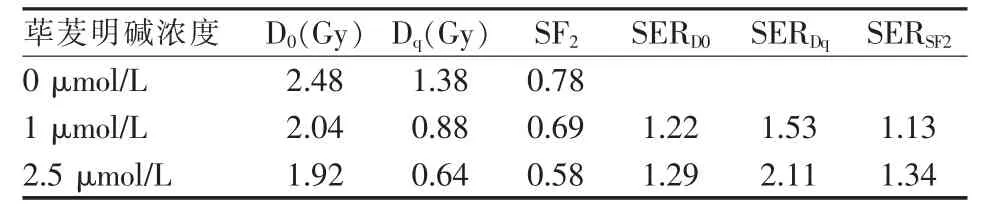
表1 不同浓度荜茇明碱联合X射线照射后多靶单击模型拟合细胞存活曲线放射生物学参数
2.2 荜茇明碱联合X射线照射对细胞凋亡的影响
经1 μmol/L荜茇明碱处理后的细胞凋亡率为(7.5±0.60)%,经6 Gy X射线单独照射后的细胞凋亡率为(5.8±1.65)%,当1 μmol/L荜茇明碱和X线共同处理MDA-MB-231细胞后48 h,细胞凋亡率为(34.6±2.05)%,较荜茇明碱组以及单独X线照射组均有明显增高,且高于两者引起的凋亡率之和,与单独照射组相比,差异有统计学意义 (P<0.05),表2、图2、3。
表2 不同处理因素对MDA-MB-231细胞凋亡的影响

表2 不同处理因素对MDA-MB-231细胞凋亡的影响
注:与单独加药组相比,aP<0.05;与单独照射组细胞,bP<0.05
组别 坏死细胞(Q1) 早期凋亡(Q2)正常细胞(Q3) 晚期凋亡(Q4)对照组 0.45±0.01 0.85±0.03 97.65±2.55 1.05±0.02单独加药组 1.55±0.05 4.50±0.35 90.95±3.42 3.00±0.46单独照射组 0.98±0.06 3.20±0.65 93.30±1.48 2.60±0.48加药照射组 2.58±0.08 18.40±1.05ab62.82±2.45 16.20±2.45ab
2.3 荜茇明碱联合X射线对细胞凋亡相关蛋白表达的影响
与对照组细胞相比,单独照射组和单独加药组细胞的Bcl-2蛋白表达均有下降,Bax蛋白表达均有增加,Bcl-2与Bax的灰度比值均降低(P<0.05);荜茇明碱单独处理组细胞与单独照射组细胞的Bcl-2蛋白和Bax蛋白表达没有明显差异(P>0.05);而与对照组细胞和单独照射组细胞相比,荜茇明碱和X射线照射联合处理组细胞的Bcl-2蛋白表达有明显的下降,Bax蛋白的表达有明显的上升,Bcl-2与Bax的灰度比值均降低(P < 0.05),图 4、表 3。
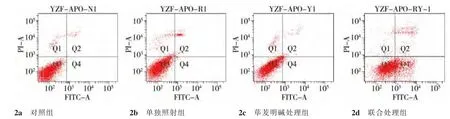
图2 各组细胞的凋亡情况±s,n=3)

图3 各处理组细胞凋亡率

图4 各处理组凋亡相关蛋白的表达
表3 不同处理组凋亡相关蛋白Bcl-2、Bax的表达(n=3,

表3 不同处理组凋亡相关蛋白Bcl-2、Bax的表达(n=3,
注:与对照组相比,aP<0.05;与单独照射组相比,bP<0.05;与单独加药组相比,cP<0.05
组别 Bcl-2 Bax Bcl-2/Bax对照组 1.55±0.09 0.42±0.02 3.69±0.15单独照射组 1.43±0.02a 0.74±0.1a 1.93±0.27a单独加药组 1.19±0.03ab 0.82±0.07ab 1.45±0.05ab加药照射组 0.72±0.08abc 0.48±0.05abc 0.49±0.07abc
2.4 荜茇明碱联合X射线对细胞活性氧水平的影响
装载探针的各组细胞均检测到荧光,与对照组相比,单独加药组(1 μmol/L)与单独照射组(6 Gy)细胞的荧光强度的差异无统计学意义 (P>0.05),而加药照射组细胞的平均荧光强度与其他各组相比均显著提高(P<0.05),图 5。
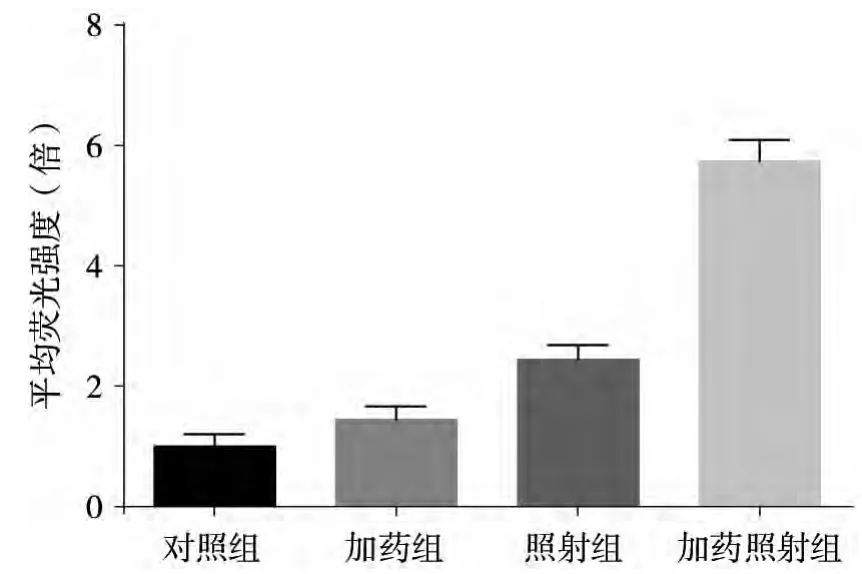
图5 各处理组细胞活性氧水平
3 讨论
三阴性乳腺癌(TNBC)是指雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER-2)均为阴性的一种特殊类型乳腺癌,其对内分泌治疗和分子靶向药物曲妥珠单抗均无效[6]。由于TNBC细胞含有突变型p53(mtp53),该型乳腺癌对临床放疗的敏感性较其他类型差[7]。
荜茇明碱对多种肿瘤细胞具有特异性的细胞毒作用,诱导肿瘤细胞凋亡,而对正常细胞没有明显毒性作用[8-9]。荜茇明碱在体外能抑制MDA-MB-231细胞的增殖,且呈现一定的浓度、时间依赖关系[2]。DNA是X线杀伤肿瘤细胞的主要靶点,因此基于靶学说的多靶单击模型SF=1-(1-e-D/D0)N在放射生物学领域被广泛用于衡量细胞的放射敏感性[10]。 本研究结果表明,加药照射组 D0、Dq和 SF2较单独照射组均降低(P<0.05,表 1),D0减小,意味着在相对高剂量区,荜茇明碱增加了细胞的放射敏感性,Dq值减小,意味着在很小剂量的照射就可使细胞进入致死性损伤的指数性存活曲线部分。本实验中,1 μmol/L及 2.5 μmol/L的荜茇明碱放射增敏比(SERD0)分别为 1.22 和 1.29。
研究发现,肿瘤受电离辐射后,凋亡反应的增加与放射敏感性的提高成正相关[11]。本研究结果表明,单独荜茇明碱预处理并没有提高细胞的凋亡率,而联合X线照射后,则明显增加了照射引起的晚期凋亡和早期凋亡。由此可见,低细胞毒浓度的荜茇明碱虽然本身不诱导MDA-MB-231细胞的凋亡,但可能通过影响凋亡相关的调控途径来增加放射线诱导的细胞凋亡。
在细胞凋亡的调控基因中,Bcl-2家族是目前发现的与凋亡关系密切的原癌基因之一[12]。Kong等[3]研究证实了荜茇明碱能促进前列腺癌细胞的凋亡,进一步研究发现荜茇明碱未明显改变Bax的表达,但使Bcl-2表达下降,Bax/Bcl-2比值下降。本研究结果发现,荜茇明碱和X线照射联合处理组Bax表达水平明显高于对照组和单独处理组,而Bcl-2的表达明显低于对照组和单独处理组,Bax/Bcl-2增加,而肿瘤细胞Bax/Bcl-2的表达程度与其放射敏感性呈正相关,说明了荜茇明碱可能是通过调节Bcl-2家族蛋白的表达表现出放射增敏效应的。
有研究提示氧化应激是一种普遍的细胞凋亡调控因子,其参与了细胞凋亡的过程,并起了关键作用。为了减少有氧代谢过程中活性氧(ROS)对细胞的损害,正常细胞自身具有一系列有效的抗氧化防御系统,是机体参与消除氧自由基的主要生物分子,能够通过不断清除细胞代谢过程中产生的ROS,维持细胞内氧化还原水平动态平衡,被认为是肿瘤抗辐射的物质基础。
在荜茇明碱诱导MDA-MB-231细胞凋亡的过程中,ROS水平升高,并与浓度呈正相关[2]。本实验结果证实荜茇明碱可通过提高射线照射后MDAMB-231细胞内ROS的水平发挥增敏作用。有研究证实,Bcl-2能抗过氧化反应保护脂质膜、保持细胞的氧化还原状态[13]。因此提出Bcl-2是一种抗氧化剂,可通过抗氧化剂的作用或通过抑制氧自由基的产生而抑制细胞死亡的观点。本研究表明,荜茇明碱联合X线照射明显降低Bcl-2的表达的同时,也明显增加胞内ROS水平,从而明显增加细胞凋亡。我们推测,活性氧应激途径与细胞凋亡调控途径似乎存在某种内在联系,这或许正是值得进一步研究之处。
[1] 张 鹏,黄启来,华子春.荜茇酰胺的药理作用研究进展[J].中草药,2012,43:201-204.
[2] Yao ZF, Yao JX, He X, etal.Experimentalstudy of piperlongumine inducing apoptosis of human breast adenoma MDA-MB-231 cells [J].Chinese-German J Clin Oncol, 2013,12:319-325.
[3] Kong EH, Kim YJ, Kim YJ, et al.Piplartine induces caspasemediated apoptosis in PC-3 human prostate Cancer cells[J].Oncol Rep,2008,20:785-792.
[4] Bezerra DP,Militao GC,de Castro FO,et al.Piplartine induces inhibition of leukemia cell proliferation triggering both apoptosis and necrosis pathways[J].Toxicol In Vitro, 2007, 21: 1-8.
[5] Jyothi D,Vanathi P,Mangala Gowri P,et al.Diferuloylmethane augments the cytotoxic effects of piplartine isolated from Piper chaba[J].Toxicol In Vitro, 2009, 23: 1085-1091.
[6] Bauer KR,Brown M,Cress RD,et al.Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast Cancer, the socalled triple-negative phenotype:a population-based study from the California Cancer Registry [J].Cancer, 2007, 109: 1721-1728.
[7] Dent R,Trudeau M,Pritchard KI,et al.Triple-negative breast Cancer: clinical features and patterns of recurrence [J].Clin Cancer Res, 2007, 13: 4429-4434.
[8] Raj L,Ide T,Gurkar AU,et al.Selective killing of Cancer cells by a small molecule targeting the stress response to ROS [J].Nature, 2011, 475: 231-234.
[9] 姚志峰,姚建新,刘永彪.荜茇明碱抗肿瘤作用及其机制[J].国际肿瘤学杂志,2013,40:259-263.
[10]何信佳,宫文静,安永恒.塞来昔布对胃癌SGC7901细胞放射敏感性的实验研究 [J].中华肿瘤防治杂志,2011,18:260-263.
[11] Meyn RE, Stephens LC, Ang KK, et al.Heterogeneity in the development of apoptosis in irradiated routine tumors of different histologies[J].Int J Radiat Biol Phys, 1993: 583.
[12] Tsukahara S, Yamamoto S, Ahmed S, et al.Inhalation of lowlevel formaldehyde increases the Bcl-2/Bax expression ratio in the hippocampus ofimmunologically sensitized mice [J].Neuroimmunomodulation,2006,13:63-68.
[13] Métrailler-Ruchonnet I, Pagano A, Carnesecchi S, et al.Bcl-2 protects against hyperoxia-induced apoptosis through inhibition of the mitochondria-dependent pathway[J].Free Radic Biol Med,2007,42:1062-1074.

