CT灌注成像评价抗血管生成药物不同给药方式的疗效
刘 丽, 陈 波, 吴垠垠, 袁 磊, 曹建民, 卢光明, 许 健
肿瘤血管生成是肿瘤生长的“血管性开关”。因此,抗血管生成治疗是肿瘤研究的又一重要领域。O’Reilly等[1]的实验证明重组人血管内皮细胞抑制剂在抗血管生成治疗中显示出明显的剂量依赖性。基于此,探索新的更有效的肿瘤抗血管治疗方案具有临床实际意义。本实验通过CT灌注成像评价抗血管生成药物重组人血管内皮抑制素注射液不同给药方式治疗兔后腿VX2移植瘤的效果,探索不同给药途径进行抗血管治疗在肿瘤治疗中的疗效差异。
1 材料与方法
1.1 实验动物及试剂
雄性新西兰大白兔21只,6~8周龄,重2~2.5 kg,购于南京军区南京总医院比较医学科,符合医学实验动物标准,无特异病原体级饲养。实验细胞株为抗兔型VX2细胞株,(由东南大学中大医院介入科实验中心惠赠)。重组人血管内皮抑制素注射液购自山东先声麦得津生物制药有限公司。
1.2 方法
1.2.1 建模方法及实验分组 分别取 5 ml VX2细胞株种植于3只兔左后腿肌肉间。饲养14 d,经磁共振扫描监测肿瘤长到2 cm大小,则培育传代荷瘤兔成功,取出肿瘤组织制备成瘤组织悬浊液。另选取健康成年新西兰大白兔18只,分别在左后腿肌肉间注射肿瘤组织混悬液5 ml。饲养10 d,待其长至1.5 cm为建模成功。将模型动物按数字法随机分为静脉组、局部组和对照组,每组6只。其中静脉组连续7 d于耳缘静脉按说明书给予重组人血管内皮细胞抑制素注射液;局部组经皮穿刺于肿瘤局部行瘤内注药术,将相当于7 d静脉给药剂量的注射液1次性注入瘤内,若瘤体过大则选择多点注射;对照组在瘤内注射相当剂量的生理盐水。治疗前后行CT灌注检查。治疗7 d后将实验动物处以安乐死、取瘤组织行病理检查。
1.2.2 CT灌注成像检测及图像处理分析 CT灌注成像技术通过静脉团注对比剂碘帕醇注射液(300 mg/L)后对选定层面行同层动态扫描,获得该层面内每一像素的时间密度曲线 (time-density curve,TDC),根据该曲线的数学模型计算出血流量(BF)、血容量(BV)和表面渗透性(PS)等参数值。 首先行常规CT平扫,扫描参数:120 kV,160 mA,矩阵512×512,扫描周期0.5 s/周,重建层厚2 mm。扫描范围从中下腹部至小腿,观察种植肿瘤的部位,然后进行CT灌注扫描。以肿瘤最大层面为中心监测层面,灌注扫描范围为4 cm。使用高压注射器以3 ml/s的速率注入对比剂8 ml,延迟3 s后开始灌注扫描,总灌注时间40 s。扫描参数:120 kV,100 mA,矩阵512×512,扫描周期0.5 s/周,重建层厚2 mm。
所有图片均传入西门子Syngo工作站进行后处理,应用Body PCT软件进行灌注后处理,以统一方式画取感兴趣区(region of interest,ROI),计算 BF、BV、PS血流动力学参数。所有数据的测量取8个ROI区,最后取平均值。同时在CT增强图像上测量每个肿瘤的长径与短径 (mm),计算相对瘤体积 =a2b × 0.52(mm3)(a为短径,b 为长径),参照文献[2]计算抑瘤率。抑瘤率=(对照组肿瘤体积-治疗组肿瘤体积)/对照组瘤体积 ×100%。
1.2.3 病理组织学检查 分别进行常规苏木精-伊红染色(HE)及肿瘤标本的微血管密度(MVD)免疫组化检测。MVD计数参照文献[3]报道的方法,记录3个视野内的微血管数,取平均数作为该肿瘤组织的MVD值。
1.3 统计学分析
采用SPSS16.0软件进行统计学分析。定量资料以均数±标准差表示。数据均为定量资料采用Kolmogorov-Smirnov Test进行正态性检验。各组间数据符合正态性以均数±标准差表示,组内比较采用2 Independent Samples Test方法,各组间多重比较采用单向方差分析(One-Way ANOVA)。分析两正态定量资料间的相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤生长
实验建模成功率100%。治疗7 d后静脉组肿瘤平均体积(617.56 ± 45.78)mm3、局部组(546.37 ±65.35)mm3、对照组 (1247 ± 67.58) mm3,静脉组及局部组均较空白对照组小(P<0.05),而静脉组与局部组间差异无统计学意义(P>0.05)。静脉组及局部组抑瘤率分别为50.52%和56.21%(P>0.05)。此外,局部组中有1只动物肿瘤出现明显完全坏死(图 1)。
2.2 CT灌注定量分析

图1 局部组治疗前(1a~1d)、后(1e~1h)CT灌注图
治疗前后三组CT灌注结果见图1~3,各组CT灌注参数均符合正态分布,与病理测量结果的比较见表1。组内比较结果显示,静脉组及局部组治疗后 BF、BV、PS较治疗前减少(P< 0.05)。 而对照组治疗前后灌注参数差异无统计学意义 (P>0.05)。治疗后组间比较显示,静脉组与局部组BF、BV、PS差异无统计学意义(P>0.05),均少于对照组(P < 0.05)。
2.3 病理及免疫组化检查
HE染色检查示各组瘤组织均有坏死区,但静脉组及局部组切片中可见大片坏死结构,中心区散在分布残留肿瘤细胞碎裂的核结构,周围实质性成分较少。对照组HE染色见少量坏死区(图4)。免疫组化染色结果见表1、图4。Pearson相关性分析得出BF、BV、PS与 MVD 值均有相关性(表 1)。
3 讨论
血管抑制性治疗是一种以阻止和 (或)减少病变组织内血管生成为策略的治疗方法。许多抗血管生成药物,如重组人血管内皮抑制素注射液、贝伐珠单抗、伊马替尼等已经在临床或临床前实验阶段取得了不同程度的效果[4]。CT灌注成像在肿瘤血管生成及抗肿瘤治疗疗效评价方面显示出良好的应用前景[5-8]。我们采用重组人血管内皮抑制素注射液,用CT灌注检查方法结合病理检查评价不同途径的肿瘤抗血管生成治疗疗效,探索新的肿瘤抗血管治疗途径。
表1 三组VX2肿瘤治疗前后CT灌注参数及病理指标比较
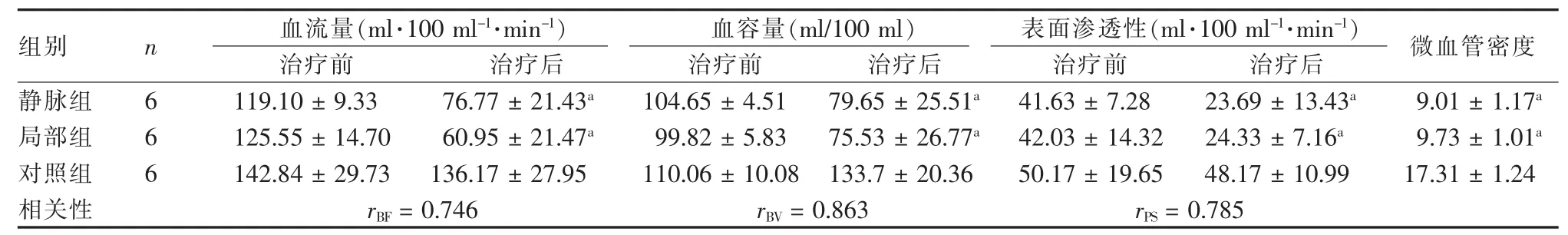
表1 三组VX2肿瘤治疗前后CT灌注参数及病理指标比较
与对照组比较,aP<0.05
组别 n 血流量(ml·100 ml-1·min-1) 血容量(ml/100 ml) 表面渗透性(ml·100 ml-1·min-1) 微血管密度治疗前 治疗后 治疗前 治疗后 治疗前 治疗后静脉组 6 119.10±9.33 76.77±21.43a 104.65±4.51 79.65±25.51a 41.63±7.28 23.69±13.43a 9.01±1.17a局部组 6 125.55±14.70 60.95±21.47a 99.82±5.83 75.53±26.77a 42.03±14.32 24.33±7.16a 9.73±1.01a对照组 6 142.84±29.73 136.17±27.95 110.06±10.08 133.7±20.36 50.17±19.65 48.17±10.99 17.31±1.24相关性 rBF=0.746 rBV=0.863 rPS=0.785

图2 静脉组治疗前(2a~2d)、后(2e~2h)CT灌注图

图3 对照组治疗前(3a~3d)、后(3e~3h)CT灌注图
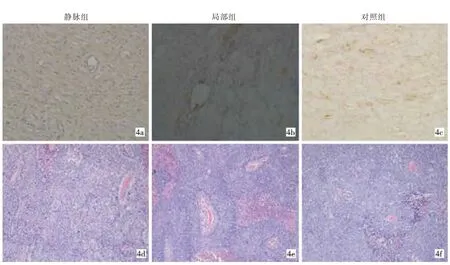
图4 三组微血管密度(4a~4c免疫组化染色,4d~4f HE,×200)
本研究中,各组治疗后肿瘤体积的变化说明单纯抗血管治疗并不能完全抑制肿瘤进展,但能在一定程度上控制肿瘤进展。本文结果表明,各CT灌注参数与MVD均具相关性,因此,可以结合CT灌注与病理检查评价肿瘤微血管状态。对于治疗前后各组CT灌注检查结果的组内比较及治疗组与对照组的比较分析可见,重组人血管内皮抑制素在抗血管治疗过程中,可降低肿瘤MVD,降低肿瘤灌注量;改善肿瘤血管微环境,修剪不成熟的血管和强化残留的血管,提高残留血管的完整性和功能,使血管网的结构趋于正常,降低肿瘤血管渗透性。而对照组中多种血管生成因子促进不成熟血管生成,肿瘤细胞生长较为旺盛,需更多血液供应,刺激MVD增加,而这种异常增生的血管“渗透性”明显增高。
另外,静脉组与局部组间疗效无差异的原因可能是影响血管生成的因素多且复杂,肿瘤内部非均一性及血流灌注在空间和时间分布上不均衡所致。也可能由于局部给药次数的原因,局部给药经皮穿刺一次性注入相当于7 d静脉给药剂量总和的重组人血管内皮抑制素注射液,短时间瘤内高浓度药物可能使肿瘤短期急剧血管生成抑制,导致肿瘤中心出现彻底坏死区,但是由于重组血管内皮抑制素半衰期短暂,造成局部高浓度药物持续时间较短,可能出现短暂抑制后的各种促血管生成因子增加,导致残存周围肿瘤实质内血管生长,致使灌注量增加。此外,动物模型间存在较大的个体差异、样本数量较少也可能是形成误差的另一原因。但是,在局部组中1只动物肿瘤出现彻底坏死,而这种现象在静脉组及对照组中均未见到,进一步肯定了局部高浓度的内皮抑制素能产生强烈的抑制肿瘤血管内皮细胞的生长、抑制肿瘤血供的效应。但是,此动物肿瘤体积较其他稍小,可能因为抗血管生成治疗针对肿瘤早期及新生血管更有效,而对于进展期肿瘤及成熟血管效果较差。因此,不同的给药途径对肿瘤血管生成具有不同的影响效果,但其具体机制还有待进一步研究。
本研究的局部用药仍然存在以下问题:①局部药物浓度的确定,其安全浓度和最佳抑制效应浓度的确定。②局部应用内皮抑制素对肿瘤转移的抑制作用疗效的评定,包括其作用持续时间、药物在肿瘤区和非肿瘤区的分布等。
总之,CT灌注成像能无创、准确、动态地监测肿瘤抗血管治疗的疗效。局部瘤内注药术为肿瘤抗血管治疗提供了一种新的临床治疗途径。
[1] O’ReillyMS, Boehm T, Shing Y, etal.Endostatin:an endogenous inhibitor of angiogenesis and tumor growth[J].Cell,1997,88:277-285.
[2] 汪力慧,李 凯.血管内皮抑素对小鼠体内Lewis肺癌血管生成及转移影响的研究 [J].中国肿瘤临床,2008,35:587-590, 598.
[3] Weidner N.Intratumor microvessel density as a prognostic factor in Cancer[J].Am J Pathol, 1995, 147: 9-19.
[4] Hillman GG,Singh-Gupta V,Al-Bashir AK,et al.Dynamic contrast-enhanced magnetic resonance imaging of sunitinibinduced vascular changes to schedule chemotherapy in renal cell carcinoma xenograft tumors [J].Transl Oncol, 2010, 3: 293-306.
[5] 刘 丽.肿瘤血管生成的影像学评价及新进展 [J].医学研究生学报,2012,25:1102-1108.
[6] Chen Y, Zhang J, Dai J, et al.Angiogenesis of renal cell carcinoma: perfusion CT findings[J].Abdom Imaging, 2010, 35:622-628.
[7] Yao J, Yang ZG, Chen HJ,et al.Gastric adenocarcinoma: can perfusion CT help to noninvasively evaluate tumor angiogenesis?[J].Abdom Imaging, 2011, 36: 15-21.
[8] 陈 波,许 健,曹建民,等.氩氦刀冷冻治疗肺癌及疗效评估[J].介入放射学杂志, 2009, 18: 510-514.

