糖尿病大鼠外周血管病变中结缔组织生长因子的表达及其意义
杨 静, 姜会庆
糖尿病大鼠外周血管病变中结缔组织生长因子的表达及其意义
杨 静, 姜会庆
目的初步探讨结缔组织生长因子在糖尿病外周血管病变发生过程中的作用。方法24只健康SD大鼠随机分成糖尿病组(A组)和对照组(B组)。 A组腹腔注射链脲佐菌素诱导建立糖尿病大鼠模型;12周后处死,取双侧股动脉HE染色观察管壁病变情况,免疫组织化学染色检查CTGF在血管壁中的表达情况,电镜观察血管壁的超微结构。结果①HE染色:血管管腔面积与血管外截面面积之比(ST),A组较B组降低(P<0.05)血管壁厚度与血管外径之比(WT),A组较B组增加(P<0.05),提示A组管腔狭窄,血管顺应性降低。②免疫组化染色:A组CTGF表达呈阳性(+),并主要表达于血管内皮细胞和平滑肌细胞胞浆内;而B组大鼠外周血管CTGF表达基本呈阴性(-),两组间差异有统计学意义(P<0.05)。③电镜观察:A组血管内皮细胞及平滑肌细胞肿胀变形,体积增大,胞浆丰富,内有发达的细胞器,以增生的粗面内质网及线粒体为主,血管基底膜增厚。结论STZ诱导的糖尿病大鼠外周血管在病程12周时出现了明显的病理变化,包括动脉管腔狭窄、内皮细胞损伤、平滑肌细胞肥大、细胞外基质增生及血管基底膜增厚;同时,CTGF在内皮细胞及平滑肌细胞上的表达出现显著增强,提示血管病变可能与CTGF表达增加有关。
糖尿病; 链脲佐菌素; 外周血管病变; 结缔组织生长因子
糖尿病外周血管病变(peripheral vascular lesions, PVL)是糖尿病的一种严重并发症,最常见于下肢血管,发病率为正常人群的4倍。据Walters等[1]报道,Ⅰ型糖尿病患者并发外周血管病变的发生率为8.7%,Ⅱ型糖尿病患者并发外周血管病变的发生率为23.5%。结缔组织生长因子(connective tissue growth factor, CTGF)是1988年由Almendral等[2]首先在小鼠成纤维细胞内发现的一种生长因子,被视为转化生长因子β1(transforming growth factor β1, TGF-β1)的下游反应元件,主要由成纤维细胞、平滑肌细胞和内皮细胞合成分泌,它能促进内皮细胞、平滑肌细胞、成纤维细胞等细胞有丝分裂,趋化细胞、诱导黏附、调节细胞增殖分化和调节细胞外基质(extracellular matrix, ECM)产生。在皮肤、肺、肾等器官的纤维化过程中表达明显增强[3]。2009年,笔者通过观察STZ诱导的Ⅰ型糖尿病大鼠外周血管病变中结缔组织生长因子的表达与血管病变的情况,探讨CTGF在糖尿病PVL发生、发展过程中的作用及意义,了解PVL的发病机制。
1 材料与方法
1.1 实验动物与主要试剂 健康清洁级雌性SD大鼠24只,3个月龄,体质量(150±20) g,由中国人民解放军南京军区南京总医院比较医学科提供。链脲佐菌素(streptozocin, STZ;美国SIGMA公司),快速血糖试纸(美国强生公司),兔抗鼠CTGF单克隆抗体(美国 SANTA CRUZ 公司),超敏SP试剂盒及DAB显色试剂盒(南京宇盛达实业有限公司),盐酸氯胺酮注射液(江苏恒瑞医药股份有限公司)。
1.2 STZ诱导糖尿病大鼠模型制作 将24只大鼠随机分成2组:糖尿病组(A组,n=12)和对照组(B组,n=12)。禁食10 h后,分别测定两组大鼠体质量及空腹血糖值,按STZ 60 mg/kg(60 ml/kg)空腹体质量的剂量,一次性向A组大鼠腹腔内注射STZ。B组大鼠仅给予0.1 mol/L柠檬酸-柠檬酸三钠缓冲液,腹腔注射60 ml/kg空腹体质量。用药72 h后大鼠尾静脉采血测血糖,以随机血糖>16.7 mmol/L且能维持1周以上,确定为糖尿病大鼠模型建立标准。不能达到上述标准者,72 h后补注STZ(以15 mg/kg空腹体质量剂量,腹腔内注射)。STZ诱导糖尿病大鼠成模后,每2周称量大鼠体质量,测随机血糖,对不能达到上述标准的大鼠和死亡大鼠,及时排除实验组并予以补充。整个实验过程中,不使用胰岛素及其他降糖药物。
1.3 取材及标本处理 STZ诱导成模后12周,称量大鼠体质量,测随机血糖,禁食12 h后,以10%盐酸氯胺酮(100 mg/kg)腹腔内注射,麻醉生效后立即处死大鼠,并迅速于大鼠双侧后肢膝关节上方1.0 cm至股动脉起始处切取股动脉,取该段股动脉中段,长约0.5 cm的血管,常规HE染色、免疫组织化学染色及电镜观察。
1.4 组织病理学观察 ①数据采集。显微镜下观察标本血管病理改变情况,测量血管内、外周长,计算血管内(r)、外半径(R)及血管截面积(S)和管腔面积(s),并由此计算血管壁厚度与血管外径之比(WT,%)及管腔面积与血管截面积之比(ST,%),进行统计分析。②免疫组化染色光镜下观察。阳性细胞为棕黄色着色,结合阳性细胞数和染色强度两个方面,进行免疫组织化学染色结果的分析。每个标本随机选取10个包括血管内膜及平滑肌层全层的高倍视野(×400),对阳性细胞进行计数,取其平均值再结合染色强度,作为该标本的阳性染色结果,(-)为未见阳性细胞或阳性细胞数<30%,阳性染色弱;(+)为阳性细胞数≥30%,阳性染色强。③电镜下观察。在透射电镜下观察超薄切片(×106)血管内皮细胞、平滑肌细胞变化情况及基底膜厚度改变。
2 结果
A组较B组血管管腔狭窄,管壁增厚,差异显著。染色结果:A组出现管腔狭窄、内膜皱褶;平滑肌细胞胞核及胞浆淡染,核周出现空泡样改变,细胞肥大,胞浆丰富,基底膜增厚明显,血管壁较对照组增厚(图1a)。B组动物的股动脉HE染色显示,组织结构正常,血管壁较薄,血管基底膜较薄(图1b)。
数据测定:HE染色的切片显微镜下拍照,因血管为空腔脏器,面积可因挤压、塌陷等原因发生改变,而血管周径相对恒定,因此,选择人工定位血管周径,计算机测量血管内、外周径(L,l),计算出血管管腔面积、血管外横截面面积(S、s)。根据测量结果,计算管腔面积与血管外截面面积之比(ST),两组数据分别进行方差分析(表1)。
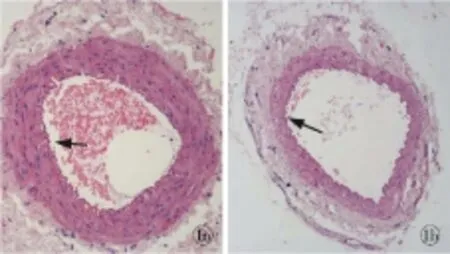
图1 两组大鼠股动脉形态学表现(HE ×40) a. A组股动脉:血管管径狭窄,血管壁明显增厚 b. B组股动脉:血管形态结构基本正常,血管壁较薄
Fig1 Changes of femoral arteries in two group of rats (HE ×40).
a. the femoral artery with narrowed vessel and thickened vessel wall.b. the normal femoral artery with thinner vessel wall in group B.
A组较B组血管壁中有明显CTGF的表达,差异显著。对免疫组织化学染色,染色阳性信号为棕黄色颗粒,主要定位于血管内皮细胞及平滑肌细胞的胞浆区,阴性对照无棕黄色着色。观察发现,12周时B组偶可见少量散在棕黄色着色,大部分检查结果为阴性;A组血管壁中有明显CTGF的表达,血管内皮细胞及平滑肌细胞胞浆区可见大量棕黄色阳性着色区,大部分检查结果为阳性。对染色结果进行非参数检验,A组与B组比较P<0.01,其差异有统计学意义(表2)。CTGF免疫组化染色阴性对照。
A组血管内皮细胞及平滑肌细胞超微结构发生改变:电镜下观察B组血管内皮细胞及平滑肌细胞结构正常,无明显改变;A组血管内皮细胞及平滑肌细胞肿胀变形,体积增大,胞浆丰富,内有发达的细胞器,以增生的粗面内质网及线粒体为主,血管基底膜增厚,提示合成、分泌活跃。

表1 两组大鼠股动脉ST和WT的比较
注:与B组相比较,*P<0.01,**P<0.05
表2 两组大鼠股动脉免疫组织化学染色结果的比较
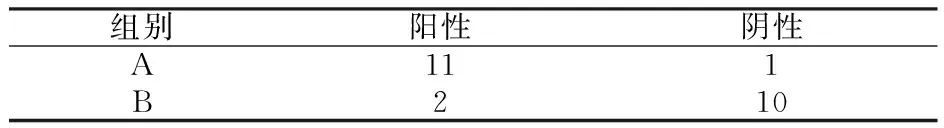
Tab 2 Comparison of IHC results in the two groups n=12
注:P<0.01
3 讨论
引起糖尿病血管损伤的机制有很多,通过对糖尿病肾病及糖尿病性视网膜病变的研究[4-5]证实,高血糖通过激活蛋白激酶C(PKC),增加TGF-β的产生,可以导致细胞外基质增加,血管基底膜增厚,引起血流障碍。作为TGF-β的下游因子,结缔组织生长因子是一个重要的促组织纤维化蛋白,在TGF-β刺激下成纤维细胞能够长时间产生高水平的CTGF,直接或间接增强纤维连接蛋白、各型胶原和整合素等ECM成分的产生[6],而利用CTGF中和抗体却能够明显减轻TGF-β所诱导的胶原合成[7]。Wang等[8]通过研究证实,应用CTGFsiRNA可有效抑制TGF-β1介导的猪成纤维细胞的CTGF及ECM的表达。这个实验提示我们,如能阻抑CTGF表达将有望阻断或减少由TGF-β过表达导致血管基底膜的增厚,从而阻止或减缓糖尿病外周血管病变的发生及发展。
正常组织内各种管腔内皮细胞均可产生CTGF,且CTGF在血管内皮细胞呈原位表达,可促进血管内皮细胞黏附、增殖、迁移,并呈剂量依赖性。血管平滑肌细胞(vascular smooth muscle cell, VSMC)的功能,主要是通过收缩和舒张来维持血管壁的张力,通过增生和产生ECM来维持血管的完整性,其增殖、迁移可导致新生内膜形成,这在血管损伤修复形成和发展的过程中起到了关键性的作用[9]。2008年,有学者通过下调CTGF表达,抑制了VSMC的增殖和迁移[10],证实了CTGF对VSMC的作用。研究者们通过RNA干扰靶向抑制了CTGF后发现,血管平滑肌细胞分泌下游纤维化因子的过程被阻抑,有效干预了血管纤维化的过程[11]。随后的研究发现, CTGF在诱导VSMC表型转化和钙化中,发挥了重要作用,可能通过诱导VSMC转分化为成骨细胞而促进血管钙化[12]。在本次实验中,A组血管壁中有明显CTGF的表达,血管内皮细胞及平滑肌细胞胞浆区可见大量棕黄色阳性着色区,提示CTGF在细胞内呈过表达。电镜结果显示,正是在上述区域内血管壁出现了明显病理性改变。
本研究中,我们以STZ腹腔注射SD大鼠,成功建立糖尿病模型。在病程12周时光学显微镜及电镜下呈现明显外周血管病变,管壁粗糙,管腔狭窄,血管内皮皱褶,内皮细胞及平滑肌细胞增生和(或)肥大及ECM沉积、基底膜增厚,说明糖尿病外周血管病变已发生,且免疫组化显示,CTGF在上述病理改变部位即血管内皮细胞及平滑肌细胞胞浆内表达明显增高。目前的研究显示,CTGF在糖尿病肾病早期即出现表达明显增高[13],且在糖尿病大鼠视网膜病变中,CTGF的产生早于微循环血管的改变[14]。上述研究结果提示,CTGF有可能在早期通过诱导血管内皮细胞及平滑肌细胞增殖转化及促进ECM的产生等途径,参与了糖尿病外周血管病变发生及发展过程。CTGF信号转导通路的激活可能是糖尿病外周血管病变发生发展的重要机制。但其具体作用机制及能否通过阻断CTGF途径来改善糖尿病外周血管病变的发生、发展,尚有待进一步研究。
[1] Walters DP, Gatling W, Mullee MA, et al. The prevalence、detection、and epidemiological correlates of peripheral vascular disease: a comparison of diabetic and non-diabetic subjects in an English community[J]. Diabet Med, 1992,9(8):710-715.
[2] Almendral JM, Sommer D, Macdonald-Bravo H, et al. Complexity of the early genetic response to growth factors in mouse fibroblasts[J]. Mol Cell Biol, 1988,8(5):2140-2148.
[3] Ito Y, Aten J, Nguyen TQ. Involvement of connective tissue growth factor in human and experimental hypertensive nephrosclerosis[J]. Nephron Exp Nephrol, 2011,117(1):e9-e20.
[4] Wang S, Denichilo M, Brubaker C, et al. Connective tissue growth factor in tubulointerstitial injury of diabetic nephropathy[J]. Kidney Int, 2001,60(1):96-105.
[5] Tikellis C, Cooper M, Twigg SM, et al. Connective tissue growth factor is up-regulated in the diabetic retina: amelioration by angiotensin-converting enzyme inhibition[J]. Endocrinology, 2004,145(2):860-866.
[6] Moussad EE, Rageh MA, Wilson AK, et al. Temporal and spatial expression of connective tissue growth factor (CCN2;CTGF) and transforming growth factor beta type1 (TGF-βeta1) at the uteroplacental interface during early pregnancy in the pig[J]. Mol Pathol, 2002,55(3):186-192.
[7] Ruperez M, Lorenzo O, Blanco-Colio LM, et al. Connective tissue growth factor is a mediator of angiotensⅡ-induced fibrosis[J]. Circulation, 2003,108(12):1499-1505.
[8] Wang JF, Olson ME, Ma L, et al. Connective tissue growth factor siRNA modulates mRNA levels for a subset of molecules in normal and TGF-beta1-stimulated porcine skin fibroblasts[J]. Wound Repair Regen, 2004,12(2):205-216.
[9] Ohtsuka M, Miyashita Y, Shirai K. Lipids deposited in human atheromatous lesions induce apoptosis of human vascular smooth muscle cells[J]. J Atheroscler Thromb, 2006,13(5):256-262.
[10] 霍晓川, 罗俊生, 孙霄云, 等. CTGF反义RNA对血管平滑肌细胞增殖和迁移的影响[J]. 辽宁医学院学报, 2008,29(1):4-6.
[11] 阂新文, 郎明健, 杨汉东, 等. RNA干扰选择性下调血管平滑肌细胞结缔组织生长因子的表达[J]. 中国组织工程研究与临床康复, 2007,11(49):9842-9846.
[12] 彭依群, 黄 娟, 黄 汉, 等. 结缔组织生长因子对体外培养的小鼠血管平滑肌细胞钙化的作用[J]. 中华内分泌代谢杂志, 2013,29(1):64-68.
[13] 于 倩, 张 沫, 刘德敏. TGF-β1、CTGF基因的过表达与早期糖尿病肾病关系的研究[J]. 天津医药, 2012,40(3):262-265.
[14] 胡艳滨, 张静楷, 孙智勇, 等. 实验性糖尿病大鼠视网膜细胞凋亡和微血管改变及结缔组织生长因子的表达[J]. 中华眼科杂志, 2011,(6):521-526.
Expressionofconnectivetissuegrowthfactorintheperipheralvascularlesionsofdiabeticratanditssignificance
YANGJing,JIANGHui-qing.
(DepartmentofBurnandPlasticSurgery,AnhuiSecondProvincialPeople′sHospital,Hefei230011,China)
ObjectiveTo observe the effect of connective tissue growth factor (CTGF) on the development of peripheral vascular lesions of diabetes.MethodsTwenty-four Sprague-Dawley rats were divided randomly into Diabetes Mellitus group (A,n=12) and Normal Control group (B,n=12). Streptozotocin was injected intraperitoneally into the rats in group A to establish the model of diabetic rats. At the 12th week, the rats were sacrificed and their femoral artery were harvested. HE stain, immunohistochemistry stain and electron microscope were applied to observe the pathologic structure, the expression of CTGF and ultrastructure of femoral artery, respectively.Results①HE staining: the ratio of the area of vessel lumen and that of whole vessel in group A was obviously lower than that in group B (P<0.05). Accordingly, the ratio of the thickness of vessel wall and the radius of whole vessel in group A was obviously higher than that in group B (P<0.05). These results suggested that the vessel lumen in group A became stenotic and the vessel compliance decreased. ②Immunohistochemistry staining: In group A, CTGF was expressed in vascular endothelial cells and smooth muscle cells. In group B, the expression of CTGF was almost absent. The difference was much significant (P<0.01). ③Electron microscope: Swelling, enlargement, deformity and hyperplasia of cytoplasm and endoplasmic reticulum were observed in both endothelial cells and smooth muscle cells. The basement membrane also became thick.ConclusionEvident peripheral vascular lesions were observed in streptozotocin-induced diabetic rats, described as follows: Stenosis of vessel lumen, impairment of vascular endothelial cells, hypertrophy of smooth muscle cells, hyperplasia of extra cellular matrix and thickening of basement membrane, at the same time, the expression of CTGF in group A was obviously elevated, which suggested the possible relation between the peripheral vascular lesions and the expression of CTGF.
Diabetes mellitus; Streptozotocin; Peripheral vascular lesions; Connective tissue growth factor
230011 安徽 合肥,安徽省第二人民医院 烧伤整形科(杨 静);南京军区南京总医院 烧伤整形科(姜会庆)
杨 静(1978-),女,安徽宣城人,主治医师,硕士.
10.3969/j.issn.1673-7040.2014.08.019
R-322
A
1673-7040(2014)08-0502-05
2014-03-06)

